枯草芽孢杆菌木聚糖酶的克隆表达及其酶解两种木聚糖的产物分析
2016-04-15韦露莎吴一飞西北农林科技大学林学院陕西杨凌712100
韦露莎,吴一飞,陈 辉(西北农林科技大学林学院,陕西 杨凌 712100)
枯草芽孢杆菌木聚糖酶的克隆表达及其酶解两种木聚糖的产物分析
韦露莎,吴一飞,陈 辉*
(西北农林科技大学林学院,陕西 杨凌 712100)
摘 要:通过基因克隆方法获得枯草芽孢杆菌木聚糖酶XynA,考察经镍离子亲和柱纯化后的XynA分别在桦木木聚糖和毛榉木木聚糖中的酶解情况,利用薄层色谱法(thin layer chromatography,TLC)及基质辅助激光解吸/电离飞行时间质谱(matrix-assisted laser desorption/ionization time-of-flight mass spectrometry,MALDI-TOF/MS)法鉴定木聚糖酶XynA的酶解产物。运用MALDI-TOF/MS分析枯草芽孢杆菌木聚糖酶XynA酶解桦木木聚糖和毛榉木木聚糖产物不同的聚合度寡糖的分布情况。结果表明:在桦木木聚糖酶解液中,产生的中性木寡糖主要为木二糖(X2)和木三糖(X3),酸性木寡糖聚合度为4~12,并且每一个酸性木寡糖上仅连接着一个甲基葡萄糖醛酸侧链(MeG)。在毛榉木木聚糖酶解液中,产生的中性木寡糖与在桦木木聚糖酶解液中相同,酸性木寡糖的结构相似,聚合度为4~16。因此木聚糖酶XynA具有生产木二糖(X2)和木三糖(X3)以及酸性木寡糖(MeGXn)的功能。
关键词:木聚糖内切酶;低聚木糖;基质辅助激光解吸/电离飞行时间质谱
引文格式:
韦露莎,吴一飞,陈辉.枯草芽孢杆菌木聚糖酶的克隆表达及其酶解两种木聚糖的产物分析[J].食品科学,2016,37(5):108-113.DOI:10.7506/spkx1002-6630-201605020.http://www.spkx.net.cn
WEI Lusha,WU Yifei,CHEN Hui.Cloning and expression of Bacillus subtilis xylanase and determination of hydrolysis products of two different xylans by it[J].Food Science,2016,37(5):108-113.(in Chinese with English abstract)
β-1,4-木聚糖内切酶(endo-1,4-β-D-xylanase,EC 3.2.1.8)在降解木聚糖过程中发挥着重要的作用,它通常通过内切方式水解木聚糖主链中的β-1,4-木糖苷键,从而将长链的木聚糖降解为低聚木糖,并常带有甲基葡萄糖醛酸、阿拉伯呋喃糖等侧链基团,在食品、农业和纸浆制造工业中有着潜在的用途[1-2]。枯草芽孢杆菌(Bacillus subtilis)作为一种非致病性的革兰氏阳性菌,其分泌的木聚糖酶XynA归属于GH11(glycoside hydrolasesfamily 11)家族[3],该酶在烘焙及酿造工业的应用中能有效减少反应处理时间并提高产物的质量[4-5]。而通过研究该酶在木聚糖中酶解特性,能使其更好地利用半纤维资源来用于食品、药品及保健品的生产[6-8]。
低聚木糖也称为木寡糖,是一种新型的功能性的食品添加剂,在提高食物的质量上有很大的潜能。作为一种非消化糖,它不会被唾液、胃液、胰液、肠液中的酶类所分解,可直达大肠被肠道内的细菌所利用,因而被视为高效的双歧杆菌增殖因子。它还可以改善食物本身的味道,其甜度与砂糖相似却具有低致龋性及热量较低的优势。一般认为低聚木糖(Xn)是由木二糖至木十糖等成分组成,糖链上不带有侧链基团,以木二糖和木三糖为主要功能因子的低聚糖[9-10]。而带有甲基葡萄糖醛酸侧链(MeG)的木寡糖则为酸性木寡糖(MeGXn),可应用于治疗膀胱炎的抗炎药物和治疗黏多糖贮积症药物的制备[11-13]。由于木寡糖或木多糖结构较为复杂,或有各种不同支链的存在,无挥发性,无显色基团,且具有热不稳定性,因此在结构鉴定方面一直存在很大的难度,而基质辅助激光解析/电离飞行时间质谱(matrix assisted laser desorption/ionization-time of flight-mass spectrometry,MALDI-TOF/MS)作为一种新型的分析糖类物质结构的方法,与传统的凝胶排阻色谱法相比,可以迅速给出糖类物质的准确分子质量,且由于所需样品的量极少,灵敏度较高[14-15],目前该技术已被成功应用于大蒜寡糖与多糖、藻类多糖等的测定[16-17]。本实验首先通过基因克隆的方法获得木聚糖酶XynA,再利用该酶分别酶解桦木木聚糖和毛榉木木聚糖,最终利用MALDI-TOF/MS法确定酶解出的低聚木糖产物的聚合度分布情况。
1 材料与方法
1.1材料
1.1.1菌株和质粒
大肠杆菌(Escherichia coli)Rosetta 2、枯草芽孢杆菌(Bacillus subtilis)168、质粒(pET15b)为西北农林科技大学林学院森林微生物实验室保存。
1.1.2试剂
限制性内切酶、修饰酶、T4 DNA和LaTaqDNA聚合酶连接酶 美国NEB公司;酵母粉、蛋白胨和牛肉膏 英国Oxoid公司;基因组DNA提取试剂盒、质粒小量提取试剂盒、DNA纯化回收试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)纯化回收试剂盒德国Qiagen公司;异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG) 生工生物工程(上海)股份有限公司;DNA标样 美国Fermentas公司;PD-10除盐柱 美国GE公司;镍离子亲和色谱柱 美国Bio-Rad公司;二羟基苯甲酸(2,5-dihydroxybenzoic)、桦木木聚糖标准品和毛榉木木聚糖标准品 美国Sigma公司。
1.1.3引物设计与合成
根据美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)公布的枯草芽孢杆菌xynA基因序列设计1 对引物:上游引物:5’-ATGTCCCTC GAGAGCACAGACTACTGGCAAAATT-3’;下游引物:5’-CGATAAGGATCCCCTACCTCCAGCAATTCCAA-3’;上下游引物中下划线部分分别为XhoI和BamHI酶切位点,引物由Sangon公司合成。
1.1.4仪器与设备
4700MALDI-TOF质谱仪(配置氮激光器,激光波长为337 nm,加速电压20 kV,反射电压19.5 kV,扫描速率1 s/scan,正离子模式检测,分子质量扫描范围为m/z 400~3 000 u) 美国 AB Sciex公司。
1.2方法
1.2.1xynA基因的扩增
以枯草芽孢杆菌168基因组DNA为模板,用引物对xynA基因进行PCR扩增。
PCR反应体系为:枯草芽孢杆菌168基因组DNA (100 ng/μL)0.5 μL,上、下游引物(10 pmol/μL)各2.5 μL,5×La Taq DNA聚合酶Buffer 10 μL,La Taq DNA聚合酶(2 U/μL)2.5 μL,dNTPs (2 mmol/L)2.0 μL,ddH2O 32.5 μL。PCR扩增条件为:98 ℃变性3 min;98 ℃变性10 s,54 ℃退火30 s,72 ℃延伸15 s,循环30 次;72 ℃延伸7 min。PCR产物用15 g/L琼脂糖凝胶进行电泳分析。
1.2.2pET15b-xynA表达载体的构建及诱导表达
回收扩增的xynA基因片段,用限制性内切酶XhoI 和BamHI进行双酶切,回收目的片段,与经同样双酶切处理的大肠杆菌表达载体pET15b连接,构建表达载体pET15b-xynA。将表达载体pET15b-xynA转化到大肠杆菌Rosetta 2感受态细胞中,构建重组菌Rosetta 2(pET15bxynA)。将重组菌接入到含氨苄青霉素的LB培养平板中,筛选出阳性重组菌。挑选阳性菌落接入到含氨苄青霉素的LB培养液培养至对数生长期,加入IPTG至终浓度为100 μmol/L,30 ℃条件下诱导培养4 h。离心收集菌体,用5 mL 50 mmol/L pH 7.4的磷酸缓冲溶液(含20 mmol/L咪唑、0.5 mmol/L NaCl)悬浮细胞,超声波破碎细胞,于4 ℃条件下10 000×g离心15 min,收集上清液为进一步的纯化备用。
1.2.3木聚糖酶XynA的纯化回收及酶活力测定
Ni-IDA Agarose预装柱(1 cm×5 cm)用平衡缓冲液(20 mmol/L pH 7.4的磷酸盐缓冲液,0.5 mmol/L NaCl)平衡后,将粗酶液以1 mL/min速率上样,然后用平衡缓冲液以相同速率洗去未吸附的蛋白质及杂质,用50 mmol/L咪唑缓冲液进行洗脱,收集目标蛋白。将收集到的蛋白用10 kD的离心膜浓缩至2.5 mL,上样到PD-10除盐柱中,用3.5 mL磷酸盐缓冲液洗脱得到除盐后的蛋白。使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析纯化及除盐后的蛋白样品。
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[18]测定纯化后木聚糖酶XynA的活性,产物以D-木糖作为标准,反应体系为0.9 mL 0.5%预热的底物中加入0.1 mL酶液,准确反应10 min后加入1.5 mL DNS混匀,沸水中准确反应5 min,冷却后在540 nm波长处测其吸光度。不同pH值缓冲液(50 mmol/L)使用范围:pH 4.0~7.5为磷酸-柠檬酸缓冲液,pH 7.5~9.0为Tris-HCl缓冲液,pH 9.0~10.0为甘氨酸-NaOH缓冲液。
1.2.4 酶解产物的薄层色谱法(thin layer chromatography,TLC)及MALDI-TOF/MS分析
配制桦木木聚糖和毛榉木木聚糖酶解反应溶液,底物分别为质量分数0.5%桦木木聚糖和质量分数0.5%毛榉木木聚糖溶液,缓冲液为pH 6.5,50 mmol/L醋酸盐缓冲液,XynA酶量为40 μg/mL,37 ℃条件下反应18 h,所得的酶解产物用薄层色谱及基质辅助激光解吸电离/飞行时间质谱法进行分析。经过除盐处理后的样品与二羟基苯甲酸基质溶液分别以1∶1、1∶5、1∶10的体积比混匀,取0.75 μL的混匀的样品点在样品靶上,室温下晾干。质谱数据由4700 MALDI-TOF/TOF分析器获得,运用4000 Explorer v3.0软件进行数据处理。内标物为2 mg/mL α-环糊精(摩尔质量为972.86 g/mol)。
2 结果与分析
2.1木聚糖水解酶基因的克隆、鉴定与表达载体构建
根据NCBI公布的xynA基因序列设计特异性引物,从枯草芽孢杆菌168基因组DNA中PCR扩增出721 bp的xynA基因片段,该基因片段编码207 个氨基酸,信号肽基因已被剔除,并添加有6聚组氨酸标签(6×His-tag)。将xynA基因片段连接到大肠杆菌表达质粒pET15b中,构建重组质粒pET15b-xynA(图1),载体转化E.coli Rosetta 2,筛选获得阳性克隆菌。
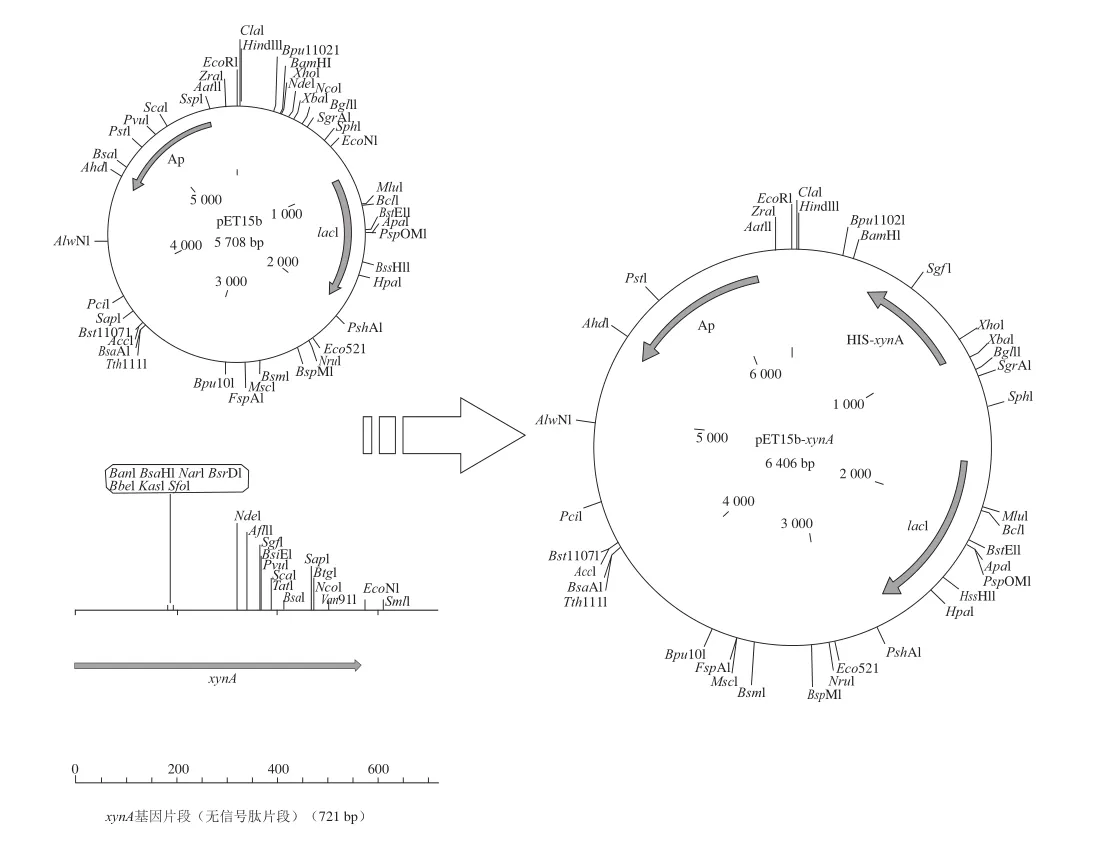
图1 表达载体pET155bb--xxyynnAA的构建Fig.1 Construction of the expression vector pET15b-xynA
2.2木聚糖水解酶的诱导表达、纯化及酶活力鉴定
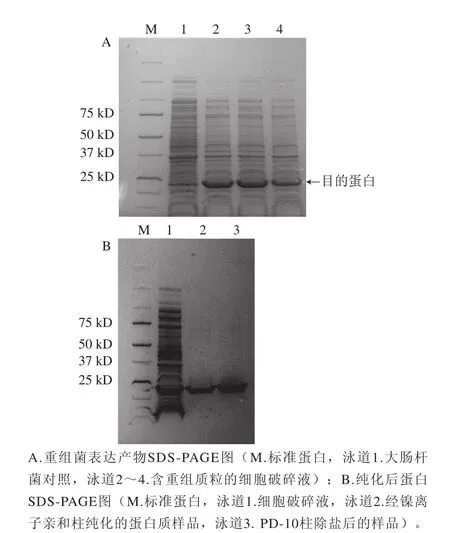
图2 重组菌表达产物及纯化后蛋白SDS-PAGGEE图Fig.2 SDS-PAGE of crude and purified proteins expressed by recombinant strain
将筛选出的重组菌株接种于LB培养基中,采用常规IPTG诱导后,收集菌体超声破碎,经过镍离子亲和柱一步纯化后获得电泳纯的木聚糖酶XynA,纯化蛋白经浓缩除盐步骤后进行SDS-PAGE分析和木聚糖酶活力的检测。SDS-PAGE分析表明,诱导的重组菌有明显的重组蛋白表达带(图2A),经分离纯化后得到一条清晰高纯度的XynA蛋白条带,分子质量约为22.9 kD(图2B)。经酶活力测定分析,木聚糖酶XynA最适温度为50 ℃,最适pH值为6.5。
2.3酶解产物的TLC分析
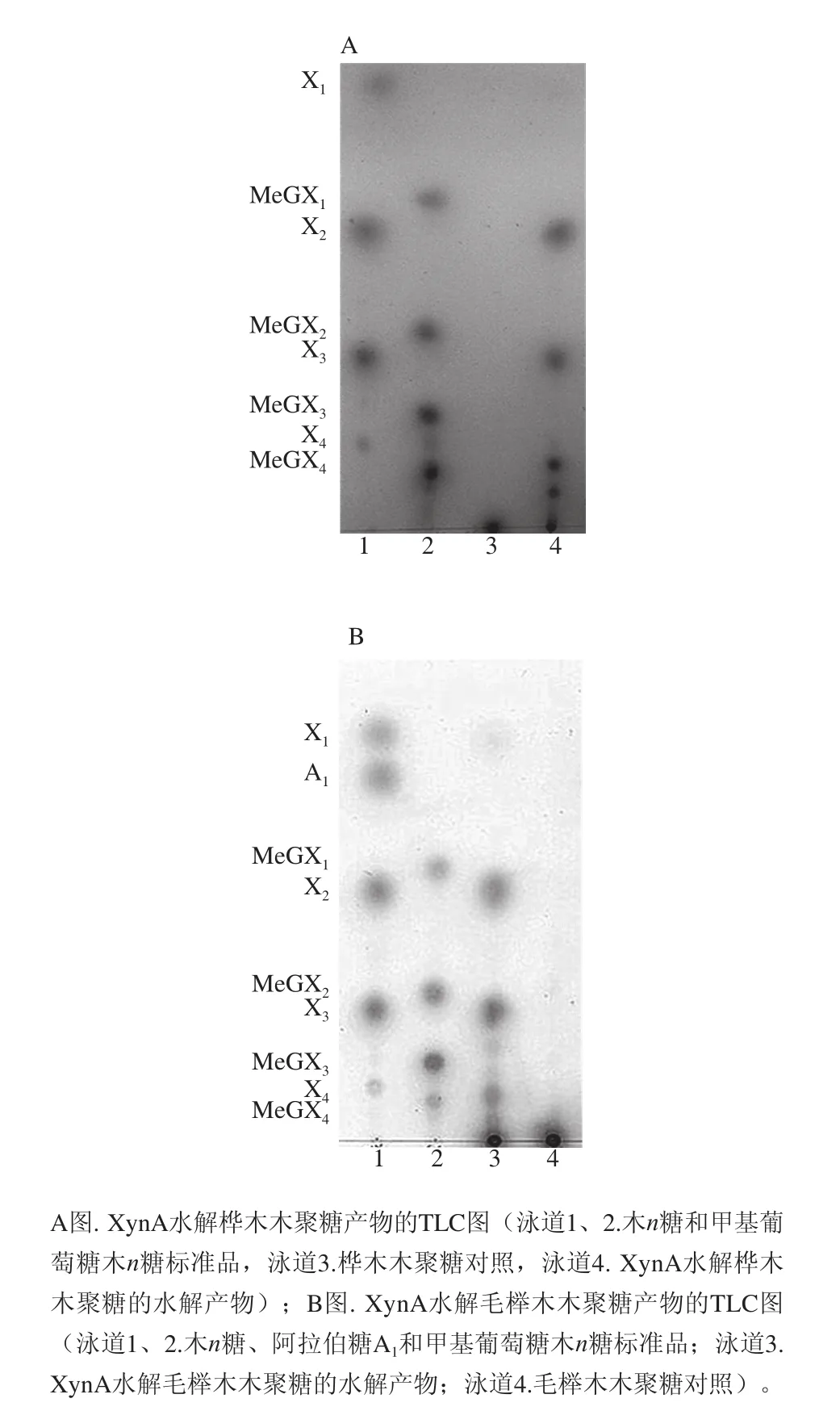
图3 XynA水解桦木和毛榉木木聚糖产物的TLCC分析Fig.3 TLC analysis of hydrolysis products from birchwood xylan and beechwood xylan digested by XynA
利用重组表达木聚糖酶XynA分别水解桦木木聚糖和毛榉木木聚糖,酶解得到的产物用薄层析色谱进行分析。图3A结果表明XynA水解桦木木聚糖生成的产物有中性木寡糖和酸性木寡糖,中性木寡糖为不含有支链的低聚木糖(Xn),而酸性木寡糖为含有甲基葡萄糖醛酸(MeG)侧链的低聚木糖(MeGXn)[19]。中性木寡糖主要为木二糖(X2)和木三糖(X3),没有检测到游离单糖成分;酸性木寡糖有甲基葡萄糖醛酸木四糖(MeGX4),更长链的酸性木寡糖将由MALDI-TOF/MS进行进一步的鉴定。由图3B可观察到相似的产物生成,含有中性木寡糖X2和X3以及酸性木寡糖MeGX4。因此推测XynA木聚糖水解酶在无论何种来源的甲基葡萄糖醛酸木聚糖中,酶解出来的产物均含有为X2、X3和MeGX4。由于TLC在检测分子质量较大的木寡糖上存在局限性,因此酶解液里生成产物的分子质量将由MALDI-TOF/MS法来确定。
2.4酶解产物的MALDI-TOF/MS法分析
MALDI-TOF/MS是目前测定生物大分子分子质量、纯度和结构的最有效的方法之一[20],采用该法可以对酶解产物的分子质量分布进行进一步的测定。由于基质的浓度能影响其与样品形成的结晶的均匀性以及样品的分散性,最终会影响出峰的质量以及灵敏度[21-22],因此首先考察样品/基质比率条件,取桦木木聚糖酶解液样品与基质(二羟基苯甲酸)分别以1∶1、1∶5和1∶10的体积比混匀,由图4A、4B可知,样品与基质分别以1∶1和1∶5体积比混匀后,出峰的质量较差,在m/z大于1 000时样品峰信号弱甚至不出峰。而当样品与基质体积比为1∶10时(图4C),样品能被有效地离子化,形成阳离子化分子离子峰[M+Na]+、[M+K]+和[M+Na+K]+,其质谱峰信噪比高、分辨率高,且背景和干扰峰少,因此确定样品与基质的混合比例为1∶10。图4C中,谱图的离子峰峰值大约以132 u递增,与木聚糖的明显特征糖元木糖残基m/z 132吻合,m/z 1 011.2对应内标物环糊精的[M+K]+峰,根据表1对图中的离子峰进行归属,发现在桦木木聚糖酶解液中,木寡糖分子质量分布在m/z 750~1 965之间,聚合度为4~12,其中聚合度为11的峰信号较弱,并且在聚合度为4以上的木寡糖上,均只连接着一个甲基葡萄糖醛酸侧链。
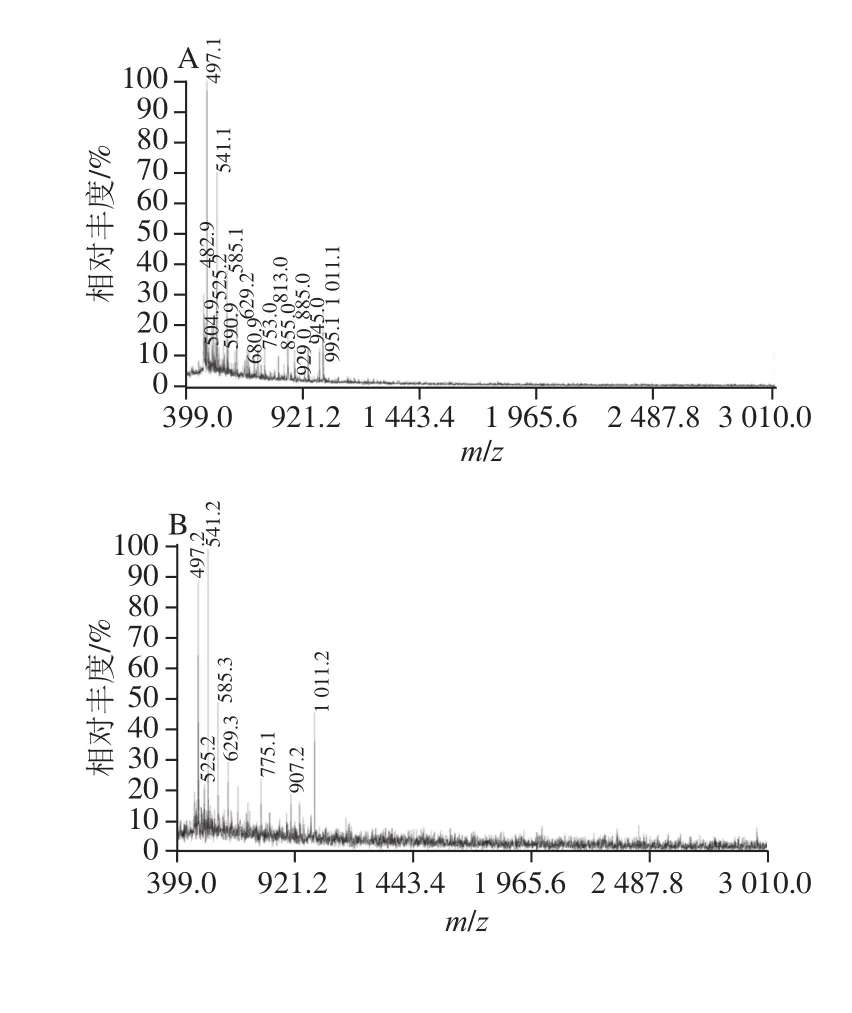
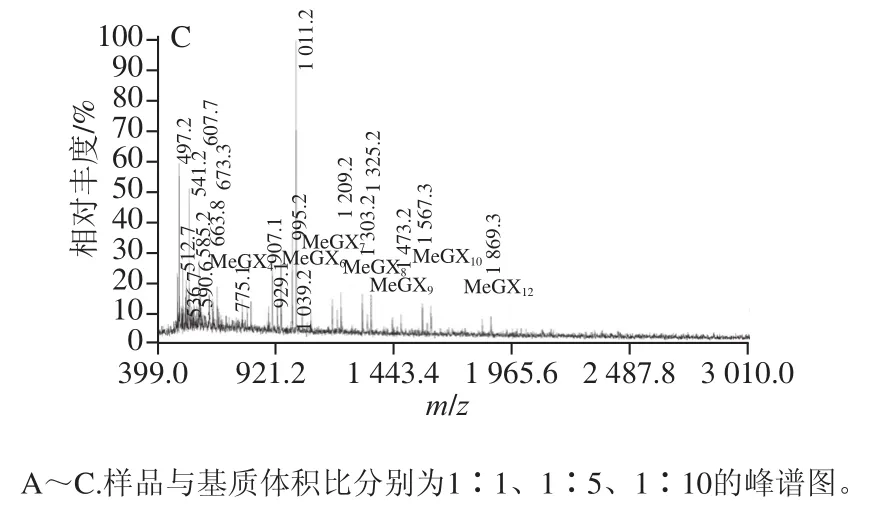
图4 桦木木聚糖酶解液与不同比例基质的MALDI-TOF/MS峰谱图Fig.4 MALDI-TOF/MS analysis of mixtures of birchwood xylan hydrolysate with matrix at various ratios
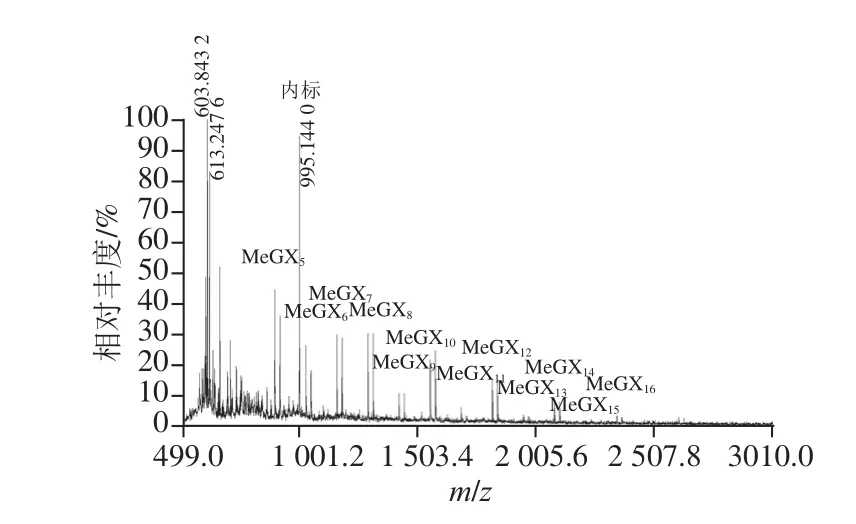
图5 XynA水解毛榉木木聚糖产物的MALDI-TOF/MSS分析Fig.5 MALDI- TOF/MS analysis of hydrolysates from beechwood xylan digested by XynA
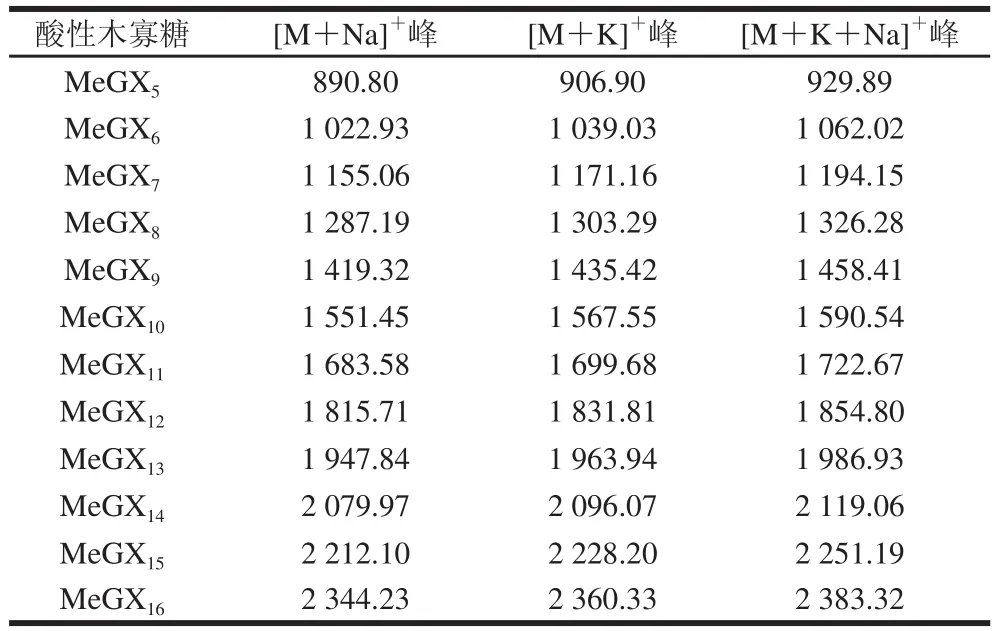
表1 酸性木寡糖离子峰理论分子质量(m/z)Table 1 Theoretic molecular weight of MeGXn(m/z)
按照之前优化的样品/基质条件对毛榉木木聚糖酶解液进行测定,如图5所示,样品能被有效的离子化,出峰好且峰信号强。同样根据表1对图中的离子峰进行归属,发现在毛榉木木聚糖酶解液中,木寡糖分子质量分布在m/z 850~2 500之间,聚合度为5~16,产物与桦木木聚糖中的酶解产物相似,在聚合度为5以上的木寡糖上均只连接着一个甲基葡萄糖醛酸基团,而两者聚合度的差异可能是由于桦木木聚糖和毛榉木木聚糖上连接着的甲基葡萄糖醛酸侧链出现频率的差异所致。由于低分子质量区域受到木聚糖酶及基质影响,聚合度在4~5以下的木寡糖难以在图谱上辨认,因此可结合之前TLC结果对低分子质量的产物进行鉴定。
3 结论与讨论
近年来木聚糖酶研究和应用已经成为国内外研究的热点,木聚糖酶作为一种重要的工业酶制剂,可广泛应用于农业、食品,饲料甚至医药等行业,特别是在益生元的制备中,具有广阔的应用前景[23-24]。本研究以食品级安全的枯草芽孢杆菌分泌的木聚糖酶XynA为对象,通过基因克隆方法获得木聚糖酶XynA,并确定了XynA的纯化方法,结果显示获得电泳级纯的木聚糖酶XynA,该酶最适反应温度为50 ℃,最适pH值为6.5。接着探索了木聚糖酶XynA在桦木木聚糖和毛榉木木聚糖中的水解表现,利用TLC和MALDI-TOF/MS方法对酶解产物进行鉴定,结果表明在桦木木聚糖酶解液中,产生的中性木寡糖为主要木二糖和木三糖,酸性木寡糖的聚合度为4~12,并且侧链都只连接着一个甲基葡萄糖醛酸基团。在毛榉木木聚糖酶解液中,产生的中性木寡糖也主要为木二糖和木三糖,而酸性木寡糖的聚合度为4~16,并且侧链也都只连接着一个甲基葡萄糖醛酸基团。根据对这两种不同来源的木聚糖的酶解液产物分析,推测XynA在木聚糖上的酶解位点并不是随机的,可能与甲基葡萄糖醛酸基团有关,导致酶解出只带有一个甲基葡萄糖醛酸基团的酸性木寡糖,并且推测该酶在无论何种来源的甲基葡萄糖醛酸木聚糖中,酶解出来的中性木寡糖主要为木二糖和木三糖。而木二糖和木三糖作为一种重要的功能性的食物添加剂,可被添加在奶制品、软饮料、茶、蛋糕等食品中,有潜在的经济价值[25-26]。未来运用阴离子交换色谱等方法对XynA酶解液中的中性木寡糖和酸性木寡糖进行分离,可以实现对木聚糖资源最大化程度的利用。
参考文献:
[1]KHASIN A,ALCHANATI I,SHOHAM Y.Purification and characterization of a thermostable xylanase from Bacillus stearothermophilus T-6[J].Applied and Environmental Microbiology,1993,59(6):1725-1730.DOI:0099-2240/93/061725-06.
[2]S˘-PEREIR P,COSTA-FERREIRA M,AIRES-BARROS M R.Enzymatic properties of a neutral endo-1,3(4)-beta-xylanase Xyl II from Bacillus subtilis[J].Journal of Biotechnology,2002,94(3):265-275.DOI:10.1016/S0168-1656(01)00436-9.
[3]HENRISSAT B,DAVIES G.Structural and sequence-based classification of glycoside hydrolases[J].Current Opinion in Structural Biology,1997,7(5):637-644.DOI:10.1016/S0959-440X(97)80072-3.
[4]PA˙S G,BERRIN J,BEAUGRAND J.GH11 xylanases:structure/function/properties relationships and applications[J].Biotechnology Advances,2012,30(3):564-592.DOI:10.1016/j.biotechadv.2011.10.003.
[5]VERJANS P,DORNEZ E,DELCOUR J A,et al.Selectivity for water-unextractable arabinoxylan and inhibition sensitivity govern the strong bread improving potential of an acidophilic GH11 Aureobasidium pullulans xylanase[J].Food Chemistry,2010,123(2):331-337.DOI:10.1016/j.foodchem.2010.04.039.
[6]JANNIERE L,BREAND C,EHRLICH S D.Structurelly stable B.subtilis cloning vector[J].Gene,1990,87(1):53-61.DOI:10.1016/0378-1119(90)90495-D.
[7]FERRARI E,LEWIS P J.Improved plasmid vectors for the production of the multiple fluorescent protein fusions in B.subtilis[J].Gene,2001,264(2):289-297.DOI:10.1016/S0378-1119(01)00338-9.
[8]WANG Y,FU Z,HUANG H,et al.Improved thermal performance of Thermomyces lanuginosus GH11 xylanase by engineering of an N-terminal disulfide bridge[J].Bioresource Technology,2012,112:275-279.DOI:10.1016/j.biortech.2012.02.092.
[9]ACHARY A A,PRAPULLA S G.Xylooligosaccharides(XOS)as an emerging prebiotic:microbial synthesis,utilization,structural characterization,bioactive properties,and applications[J].Comprehensive Reviews in Food Science and Food Safety,2011,10(1):2-16.DOI:10.1111/j.1541-4337.2010.00135.x.
[10]CRITTENDEN R G,PLAYNE M J.Production,propertiesand applications of food-grade oligosaccharides[J].Trends in Food Science & Technology,1996,7(11):353-360.DOI:10.1016/S0924-2244(96)10038-8.
[11]ANDERSON V R,PERRY C M.Pentosan polysulfate:a review of its use in the relief of bladder pain or discomfort in interstitial cystitis[J].Drugs,2006,66(6):821-835.DOI:10.2165/00003495-200666060-00006.
[12]DOCTOR V M,SAULS V.Isolation and anticoagulant properties of a new sulfated xylan:comparison with heparin and a sodium pentosan polysulfate(SP-54)[J].Thrombosis Research,1983,30(6):573-578.DOI:10.1016/0049-3848(83)90265-7.
[13]SCHUCHMAN E H,GE Y,LAI A,et al.Pentosan polysulfate:a novel therapy for the mucopolysaccharidoses[J].PLoS ONE,2013,8(1):e54459.DOI:10.1371/journal.pone.0054459.
[14]WYATT M,HAVARDS,STEIN B.Analysis of transition-metal acetylacetonate complexes by matrix-assisted laser desorption/ionization time-of-flight mass spectrometry[J].Journal of Mass Spectrometry,2008,22(1):11-18.DOI:10.1002/rcm.3327.
[15]BERKENKAMP S,MENZEL C,KARAS M,et al.Performance of infrared mat rix-assisted laser desorption/ionization massspectrometry with lasers emitting in the 3 mm wavelength range[J].Rapid Communications in Mass Spectrometry,1997,11(13):1399-1406.
[16]黄雪松,阎凤超,吴建中.基质辅助激光解析电离飞行时间质谱法测定大蒜寡糖和多糖分子质量分布[J].食品科学,2011,32(2):146-149.
[17]韩瑶.寡糖的基质辅助激光解吸电离飞行时间质谱分析方法研究[D].青岛:中国海洋大学,2006.
[18]NC-ICB.Units of enzyme activity[J].European Journal of Biochemistry,1979,97(2):319-320.DOI:10.1111/j.1432-1033.1979.tb13116.x.
[19]EBRINGEROVA A,HROMADKOVA Z.Xylans of industrial and biomedical importance[J].Biotechnology & Genetic Engineering Reviews,1999,16(1):325-346.DOI:10.1080/02648725.1999.10647982.
[20]HARVEY D J.Ma trix-assisted laser desorption/ionization mass spectrometry of carbohydrates[J].Mass Spectrometry Reviews,1999,18(6):349-450.DOI:10.1002/(SICI)1098-2787(1999)18:6<349::AIDMAS1>3.0.CO;2-H.
[21]COLBY S M,KING T B,REILLY J P.Improving the resolution of matrix-assisted laser desorption/ionization time-of-flight mass spectrometry by exploiting thecorrelation between ion position and velocity[J].Rapid Communications in Mass Spectrometry,1994,8(11):865-868.DOI:10.1002/rcm.1290081102.
[22]任凤霞,赵毅民.基质辅助激光解吸-电离质谱在糖复合物分析中的应用进展[J].解放军药学学报,2003,19(5):363-366.
[23]SWENNEN K,COURTIN C M,DELCOUR J A.Nondigestible oligosaccharides with prebiotic properties[J].Critical Reviews in Food Science and Nutrition,2006,46(6):459-471.DOI:10.1080/10408390500215746.
[24]RASTALL R A.Functional oligosaccharides:application and manufacture[J].Annual Review of Food Science and Technology,2010,1(1):305-339.DOI:10.1146/annurev.food.080708.100746.
[25]VAZQUEZ M J,ALONSO J L,DOMINGUEZ H,et al.Xylooligosaccharides:manufacture and applications[J].Trends in Food Science & Technology,2000,11(11):387-393.DOI:10.1016/S0924-2244(01)00031-0.
[26]OTIENO D O,AHRING B K.The potential for oligosaccharide production from the hemicellulose fraction of biomasses through pretreatment processes:xylooligosaccharides(XOS),arabinooligosaccharides(AOS),and mannooligosaccharides(MOS)[J].Carbohydrate Research,2012,360(1):84-92.DOI:10.1016/j.carres.2012.07.017.
Cloning and Expression of Bacillus subtilis Xylanase and Determination of Hydrolysis Products of Two Different Xylans by It
WEI Lusha,WU Yifei,CHEN Hui*
(College of Forestry,Northwest A&F University,Yangling 712100,China)
Abstract:Matrix assisted laser desorption ionization time-of-flight mass spectrometry(MALDI-TOF/MS)was applied to analyze molecular weight distribution of hydrolysis products from birchwood xylan and beechwood xylan digested by Bacillus subtilis xylanase(XynA),obtained through recombinant expression and purified by Ni+-IDA column chromatography.The hydrolysis products were identified by thin layer c hromatography(TLC)and MALDI-TOF/MS.Results showed the enzymatic hydrolysis of birchwood xylan yielded mainly xylobiose(X2)and xylotriose(X3)as well as acidic xylooligosacchrides with a degree of polymerization(DP)of 4–12 each including a single methyl-glucuronic acid side chain.Both xylobiose and xylotriose were found in the hydrolysate of beechwood xylan as well as acidic xylooligosacchrides with a DP of 4–16 structurally similar to those from birchwood xylan.Therefore,the recombinant XynA has the potential to produce X2,X3and acidic xylooligosacchrides.
Key words:xylanase; xylooligosaccrides; matrix-assisted laser desorption/ionization time-of-flight mass spectrometry(MALDI-TOF/MS)
中图分类号:Q819
文献标志码:A
文章编号:1002-6630(2016)05-0108-06
DOI:10.7506/spkx1002-6630-201605020 10.7506/spkx1002-6630-201605020.http://www.spkx.net.cn
*通信作者:陈辉(1961—),男,教授,博士,研究方向为森林保护学。E-mail:chenhui@nwsuaf.edu.cn
作者简介:韦露莎(1987—),女,博士研究生,研究方向为半纤维素的酶解。E-mail:lusafei@163.com
基金项目:国家自然科学基金面上项目(31170607)
收稿日期:2015-04-28
