丰年虫卵壳色素的制备及稳定性与体外抗氧化活性研究
2016-04-15许彦腾张建新何秋芬西北农林科技大学食品科学与工程学院陕西杨凌712100
许彦腾,张建新,何秋芬,文 欢(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
丰年虫卵壳色素的制备及稳定性与体外抗氧化活性研究
许彦腾,张建新*,何秋芬,文 欢
(西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
摘 要:利用超声波辅助乙醇溶液提取丰年虫卵壳色素,采用红外光谱对色素结构进行初步鉴定,通过紫外-可见扫描光谱分别研究光照、温度、pH值、食品添加剂、金属离子及氧化还原剂对色素稳定性的影响,分别测定色素的总抗氧化能力、羟自由基(·OH)与2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate)free radical,ABTS+·)清除活性,以考察色素体外抗氧化活性。结果表明:丰年虫卵壳色素为黑褐色粉末,可能由一类含有羟基、烷烃—CH2、碳碳三键及醚键的酰胺-芳香族复合物组成,其提取液在397 nm波长处获得最大吸收峰。色素对光和高温敏感,pH值变化、蔗糖、碳酸钠、碳酸氢钠、柠檬酸钠、Na+及K+对色素稳定性影响较小,苯甲酸钠、Ca2+、Zn2+、Fe3+、Fe2+、Cu2+及Pb2+则对色素均具有一定程度的破坏,酸性条件、柠檬酸、酒石酸、可溶性淀粉、Mg2+及Al3+则对色素具有增色效应。丰年虫卵壳色素容易被氧化剂破坏,但具有较高的耐还原性和良好的体外抗氧化活性,清除·OH与ABTS+·的IC50分别为6.104、0.377 mg/mL。说明该色素可作为天然添加剂应用于食品中,起到一定的抗氧化作用。
关键词:丰年虫卵壳;色素;稳定性;体外抗氧化
引文格式:
许彦腾,张建新,何秋芬,等.丰年虫卵壳色素的制备及稳定性与体外抗氧化活性研究[J].食品科学,2016,37(5):94-101.DOI:10.7506/spkx1002-6630-201605018.http://www.spkx.net.cn
XU Yanteng,ZHANG Jianxin,HE Qiufen,et al.Preparation,stability and in vitro antioxidant activity of pigment from Chirocephalus diaphanous eggshell[J].Food Science,2016,37(5):94-101.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605018.http://www.spkx.net.cn
食用色素按照来源途径可分为两大类:合成色素和天然色素。合成色素由于其色泽艳丽、着色力强、稳定性好、成本较低等优点,在食品行业应用较为广泛。但越来越多的研究表明不少合成色素具有慢性毒性,甚至可致癌[1-2]。天然色素主要是从植物[3-7]与微生物[8-11]中获取,具有较高的食用安全性,部分天然色素还具有保健功能活性[12-16]。因此,随着科技的进步和生活水平的提高,天然色素越来越被人们关注[3,12-19 ]。
丰年虫(Chirocephalus diaphanous),又名丰年虾、仙女虾[20-21],常见于中亚、欧洲、北美西部、非洲干旱地带及澳大利亚的淡水池塘中。我国丰年虫主要分布在西部内陆盐井、盐湖等高盐分水体中[22]。丰年虫生命力旺盛,生活周期短,多以浮游生物为食物,且进食量较大[23]。我国丰年虫资源丰富,开发潜力大。然而,丰年虫主要作为渔业饲料,利用途径少,造成大量宝贵的资源被浪费[23]。有关丰年虫的研究,目前还主要集中在养殖技术、生理生化及生态与习性等方面,缺乏对其营养价值及工业应用的深入研究,对丰年虫卵壳色素的研究还未见报道。本实验利用超声波辅助乙醇-水体系提取、制备丰年虫卵壳色素,研究了光照、温度、pH值、食品添加剂、金属离子及氧化还原剂对该色素稳定性的影响,并从总抗氧化能力、羟自由基(·OH)与2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate)free radical,ABTS+·)清除活性对该色素体外抗氧化能力进行了初步探索,以期为丰年虫卵壳色素的深入研发提供一定数据参考。
1 材料与方法
1.1材料与试剂
丰年虫卵壳,陕西省定边县华威生物科技有限公司提供。
ABTS(纯度>98%) 上海如吉生物科技发展有限公司;KBr(光谱纯) 美国PIKE Technologies公司;其他化学试剂均为分析纯。
1.2仪器与设备
101-2型电热鼓风干燥箱、HH-4型电热恒温水浴锅北京科伟永兴仪器有限公司;JP-100A-2型高速多功能粉碎机 上海市永久品工贸有限公司;100 目(孔径约0.1 mm)标准检验筛 浙江省上虞市大亨桥化验仪器厂;FA2004型电子分析天平 北京赛多利斯仪器系统有限公司;KQ-600DB型数控超声波清洗器 昆山市超声仪器有限公司;SC-3610型低速离心机 安徽中科中佳科学仪器有限公司;HS-840u型超净工作台 苏州净化仪器设备有限公司;R250型旋转蒸发器 上海申生科技有限公司;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司;LGJ-100型冷冻干燥机 北京四环科学仪器厂;UV-2550型紫外-可见分光光度计 日本岛津公司;Avatar330型红外光谱仪 美国尼高力仪器公司。
1.3方法
1.3.1丰年虫卵壳预处理
将丰年虫卵壳于50℃鼓风干燥至恒质量,粉碎。干粉于40 ℃索氏抽提10 h,除去脂肪,室温自然干燥至恒质量,过筛,密封,冷藏备用。
1.3.2丰年虫卵壳色素提取液的制备
根据之前的提取工艺优化实验结果,准确称取1 g丰年虫卵壳脱脂粉,溶于50 mL的体积分数60%乙醇,于80℃、360 W条件下超声辅助提取49 min,之后4 500 r/min离心10 min,将上清液稀释于200~700 nm波长范围内进行紫外-可见光谱扫描,观察提取溶液的吸收峰。
1.3.3丰年虫卵壳色素稳定性研究
色素保存率计算公式如下:

式中:A0为初始色素溶液或空白对照色素溶液在最大吸收峰处吸光度;At为色素溶液在最大吸收峰处t时间后的吸光度。
1.3.3.1光照对丰年虫卵壳色素稳定性的影响
将相同体积稀释后的色素溶液,装入具塞比色管中,分别置于室内暗处(柜内,报纸包扎)、室外自然光下及超净工作台紫外灯下,及时记录溶液初始吸光度,之后每1 d取样观察颜色变化,并测定吸光度。
1.3.3.2温度对丰年虫卵壳色素稳定性的影响
将相同体积稀释后的色素溶液,装入具塞比色管中,分别置于4、40、60、80 ℃的避光环境中,及时记录溶液初始吸光度,之后每1 h取样观察颜色变化,并测定吸光度。
1.3.3.3pH值对丰年虫卵壳色素稳定性的影响
将稀释后的色素溶液分装于6 个锥形瓶,分别用移液器吸取1 mol/L的HCl和NaOH将其pH值分别调节至2、4、6、8、10、12,用相同体积蒸馏水代替酸碱溶液加入色素溶液,作为空白对照。色素溶液置于避光环境中,每1 h取样观察颜色变化,并测定吸光度。
1.3.3.4食品添加剂对丰年虫卵壳色素稳定性的影响
准确称取蔗糖、葡萄糖、苯甲酸钠、碳酸钠、碳酸氢钠、柠檬酸、柠檬酸钠、酒石酸均0.2 g及可溶性淀粉0.05 g,定容于100 mL。将各添加剂溶液与稀释后的色素溶液等体积混合,用蒸馏水代替添加剂溶液作空白对照。混合溶液置于避光环境中,及时记录溶液初始吸光度,之后每1 h取样观察颜色变化,并测定吸光度。
1.3.3.5 金属离子对丰年虫卵壳色素稳定性的影响
分别用NaCl、KCl、CaCl2、MgSO4、ZnCl2、FeCl3、FeSO4·7H2O、CuSO4、(CH3COO)2Pb及AlCl3配制0.05 mol/L的Na+、K+、Ca2+、Mg2+、Zn2+、Fe3+、Fe2+、Cu2+、Pb2+及Al3+溶液并与稀释后的色素溶液等体积混合,用蒸馏水代替添加剂溶液做空白对照。混合溶液置于避光环境中,及时记录溶液初始吸光度,之后每1 h取样观察颜色变化,并测定吸光度。
1.3.3.6氧化还原剂对丰年虫卵壳色素稳定性的影响
分别配制质量分数为0.1%、0.2%、1%、2%、10%的过氧化氢溶液与质量分数0.002%、0.01%、0.02%、0.1%、0.2%的抗坏血酸溶液,并与稀释后的色素溶液等体积混合,用蒸馏水代替添加剂溶液做空白对照。混合溶液置于避光环境中,及时记录溶液初始吸光度,之后每1 h取样观察颜色变化,并测定吸光度。
1.3.4丰年虫卵壳色素固体的制备
将1.3.2节制备的色素提取液于35 ℃条件下120 r/min旋转蒸发2 h进行浓缩。浓缩液于-20 ℃冷冻2 d,之后冷冻干燥24 h(真空度5 Pa),得色素固体。
1.3.5丰年虫卵壳色素体外抗氧化活性研究
分别配制一系列质量浓度的丰年虫卵壳色素溶液,采用抗坏血酸作为阳性对照。IC50表示样品对自由基清除达到50%时的最低有效浓度[24-25]。
1.3.5.1总抗氧化能力的测定
分别吸取样液、0.2 mol/L pH 6.6的磷酸盐缓冲液、1 g/100 mL铁氰化钾溶液各1 mL于具塞比色管中,摇匀,50 ℃恒温水浴20 min,之后加入1 mL的10 g/100 mL三氯乙酸,振荡均匀,4 500 r/min离心5 min。取2 mL上清液与2 mL蒸馏水混匀,加入的400 μL的0.1 g/100 mL三氯化铁溶液,摇匀后,于700 nm波长处测定吸光度AX。样品对照组(Ax0)用蒸馏水代替铁氰化钾溶液。总抗氧化能力表示为:A700 nm=Ax-Ax0,差值越大代表总抗氧化能力越强。
1.3.5.2·OH清除活性的测定
依次吸取样液、9 mmol/L水杨酸-乙醇溶液、9 mmol/L硫酸亚铁溶液及8.8 mmol/L过氧化氢溶液1 mL于比色管中,37 ℃恒温水浴30 min,4 500 r/min离心5 min,取上清液,于510 nm波长处测定吸光度(Ax),样品对照组(Ax0)用蒸馏水代替过氧化氢溶液,再用蒸馏水代替色素溶液作为模型对照组(A0)。·OH清除率计算公式如下。
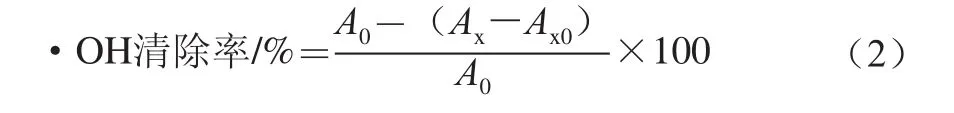
1.3.5.3ABTS+·清除活性的测定
参照文献[24]的方法,并稍作修改:将14.8 mmol/L ABTS溶液与5.2 mmol/L过硫酸钾溶液等体积混合,于避光环境中室温反应过夜,即得母液。将1 mL母液用一定体积的甲醇稀释,得ABTS工作液,并确保工作液在734 nm波长处吸光度为1.10±0.02。分别吸取1 mL样液与3 mL ABTS工作液于比色管中,混匀,避光反应10 min,4 500 r/min离心5 min,于734 nm波长处测定上清液吸光度Ax。样品对照组(Ax0)用甲醇代替ABTS工作液,用蒸馏水代色素溶液作为模型对照组(A0)。ABTS+·清除率计算公式如下。
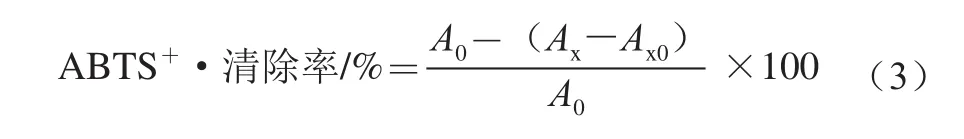
1.3.6红外光谱扫描
将2 mg干燥的丰年虫卵壳色素与200 mg溴化钾(120 ℃干燥3 h)混匀,研磨,压片,于分辨率2 cm-1、4 000~400 cm-1范围内进行红外光谱扫描。
2 结果与分析
2.1丰年虫卵壳色素紫外-可见与红外光谱特性
丰年虫卵壳色素提取液为黄褐色。由图1可知,色素提取液分别在397 nm和661 nm波长处出现吸收峰,其中397 nm波长处吸收峰非常明显。因此,将397 nm波长作为丰年虫卵壳色素检测波长。
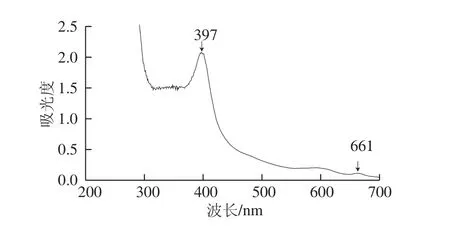
图1 丰年虫卵壳色素提取液紫外-可见光谱图Fig.1 Ultraviolet-visible spectrum of the pigment from Chirocephalus diaphanous eggshell
丰年虫卵壳色素为黑褐色。由图2可知,色素在3 400 cm-1处出现典型的—OH吸收峰,在2 922 cm-1处出现—CH2—吸收峰,在2 365 cm-1处出现—C≡C—吸收峰,1 655 cm-1处吸收峰可能由酰胺特征基团R—CO—NH2中—C=O—伸缩振动产生,1 420 cm-1处吸收峰可能由芳香族亚硝基—N=O伸缩振动产生,1 113 cm-1处吸收峰可能由醚类特征基团—C—O—C—伸缩振动产生。对1 600~1 400 cm-1范围内光谱的杂峰进行放大分析,发现1 560、1 543、1 491、1 458 cm-1处均出现吸收峰,符合苯环的振动吸收峰特征,同时增加了芳香族亚硝基存在的可能性。
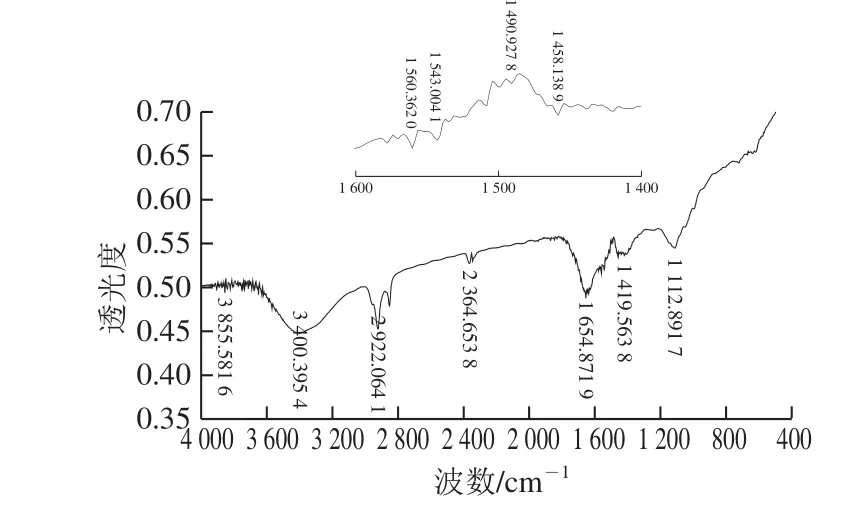
图2 丰年虫卵壳色素红外光谱Fig.2 Infrared spectrum for the pigment from Chirocephalus diaphanous eggshell
2.2丰年虫卵壳色素稳定性分析
2.2.1光照对丰年虫卵壳色素稳定性的影响
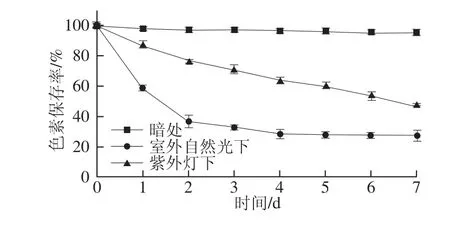
图3 光照对丰年虫卵壳色素稳定性的影响Fig.3 Effect of light on the stability of the pigment from Chirocephalus diaphanous eggshell
由图3可知,丰年虫卵壳色素对光照较为敏感。其中,室外自然光对色素的破坏程度最大,仅在2 d时间内色素保存率便下降至36.73%,7 d后色素溶液接近无色透明。而紫外光照射下色素保存率基本呈线性下降趋势,在第7天剩余47.21%。暗处的色素基本稳定,保存率几乎没有变化,7 d后仍为95.23%。所以,丰年虫卵壳色素在贮藏和使用时应避免长时间接触光照。
2.2.2温度对丰年虫卵壳色素稳定性的影响
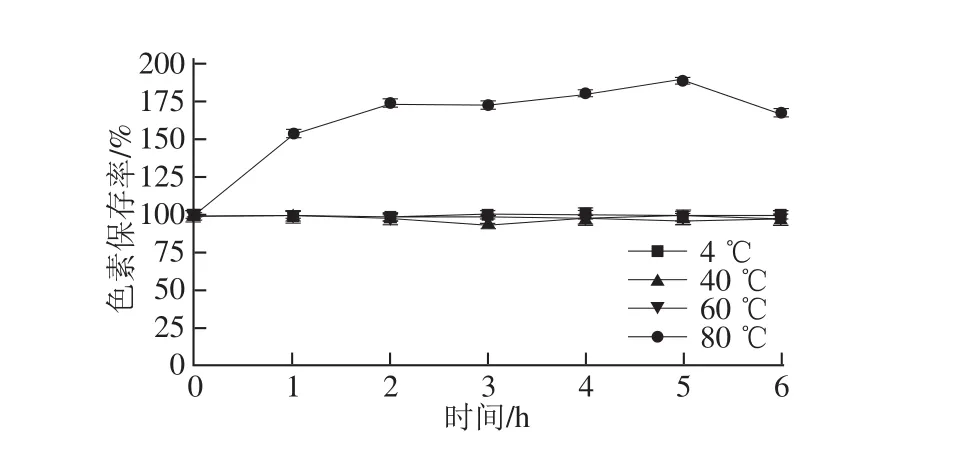
图4 温度对丰年虫卵壳色素稳定性的影响Fig.4 Effect of temperature on the stability of the pigment from Chirocephalus diaphanous eggshell
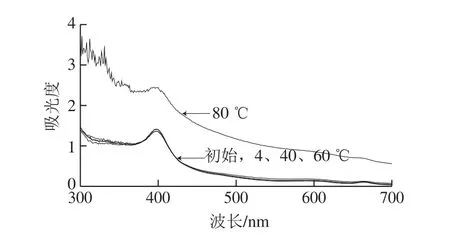
图5 不同温度下处理1 h的丰年虫卵壳色素溶液紫外-可见扫描光谱Fig.5 Ultraviolet-visible spectra of the pigment from Chirocephalus diaphanous eggshell at different temperatures for 1 h
由图4、5可知,丰年虫卵壳色素在4、40、60℃环境中较为稳定,6 h后色素保存率仍分别为99.72%、96.60%、96.67%。80 ℃对色素稳定性影响十分明显,由图4可知,仅1 h后,色素保存率便上升至153.97%,之后一直居高不下,但色素溶液刚从80 ℃水浴中取出时呈澄清的浅黄色,冷却至室温后则变混浊。由图5可知,80 ℃水浴1 h的色素溶液紫外-可见光谱扫描与其他样液有很大区别,且杂峰较多,故可推测色素长时间在80 ℃环境中被一定程度破坏,色素不稳定。
2.2.3pH值对丰年虫卵壳色素稳定性的影响
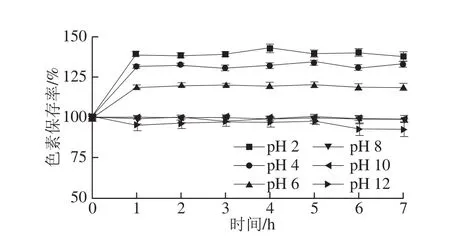
图6 pH值对丰年虫卵壳色素稳定性的影响Fig.6 Effect of pH on the stability of the pigment from Chirocephalus diaphanous eggshell
由图6可知,pH值为2、4、6时,丰年虫卵壳色素保存率显著提高,1 h后即分别达到138.99%、131.28%、119.04%,之后趋于稳定。pH值为8、10时,色素基本稳定,保存率变化不大,6 h后仍为98.90%、98.67%。pH值为12时,色素保存率略有下降,6 h后为92.86%。因此,pH值对丰年虫卵壳色素稳定性影响不大,且酸性环境具有增色效果。
2.2.4食品添加剂对丰年虫卵壳色素稳定性的影响
由表1可知,葡萄糖对色素基本没影响,6 h后色素保存率仍为96.74%。其他食品添加剂对色素稳定性均有一定影响。其中,蔗糖、碳酸钠、碳酸氢钠、柠檬酸钠对色素稳定性影响较低,6 h后色素保存率分别为93.71%、90.38%、90.41%、93.87%;苯甲酸钠对色素破坏较大,6 h后色素保存率为84.50%。并且,以上添加剂对色素的减色效果随着时间延长逐渐增大。而可溶性淀粉对色素有较弱的增色作用,1 h后色素保存率为102.08%,之后趋于稳定;柠檬酸和酒石酸对色素增色效果明显,1 h后色素保存率分别为143.74%和145.92%,之后随时间延长缓慢增加。综上,食品添加剂对丰年虫卵壳色素稳定性影响不大,适当使用酸性添加剂可起到良好的增色效果。
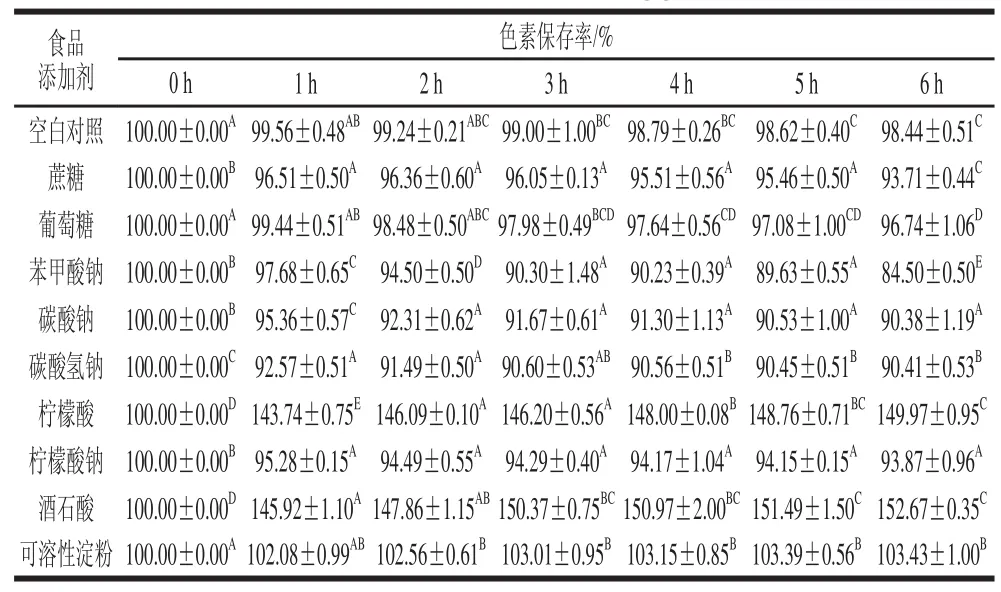
表1 食品添加剂对丰年虫卵壳色素稳定性的影响Table 1 Effect of food additives on the stability of the pigment from Chirocephalus diaphanous eggshell
2.2.5金属离子对丰年虫卵壳色素稳定性的影响
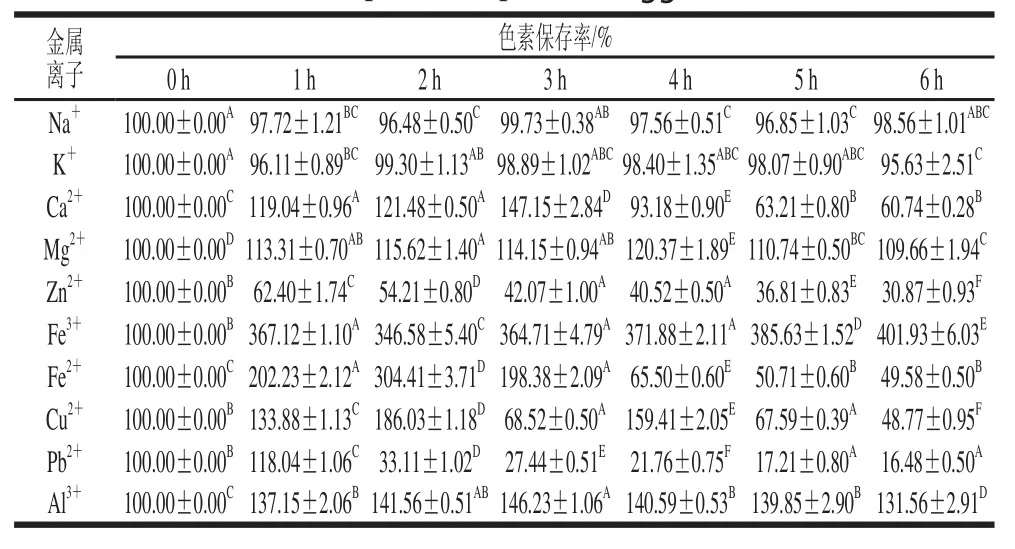
表2 金属离子对丰年虫卵壳色素稳定性的影响Table 2 Effect of metal ions on the stability of the pigment from ous eggsshheellll

表3 金属离子对丰年虫卵壳色素溶液颜色的影响Table 3 Effect of metal ions on the color of the pigment from Chirocephalus diaphanous eggshell
结合表2、3和图7可知,Na+和K+对色素稳定性基本没有影响,其扫描光谱基本与空白对照完全吻合,6 h内色素保存率均在95%以上,变化不大。Mg2+和Al3+对色素均具有一定增色效果,6 h内,Mg2+处理色素后的保存率在109.66%~120.37%之间浮动,而Al3+处理色素后的保存率在131.56%~146.23%之间浮动。其余金属离子对色素均有一定破坏作用。Ca2+起初有一定增色效果,但在2~3 h出现沉淀后,减色效果随时间延长越来越明显,6 h后色素保存率为60.74%。Zn2+加入色素溶液后立即产生沉淀,并且色素特征吸收峰消失,在397 nm波长处检测的色素保存率随时间延长逐渐下降,6 h后仅为30.87%。Fe3+和Fe2+均导致色素吸收峰消失,并自身颜色盖过色素颜色,其中Fe2+还陆续致使沉淀出现。Cu2+和Pb2+开始时均导致色素溶液混浊,后续产生沉淀,其中,Cu2+自身颜色盖过色素颜色,但保留了色素吸收峰,随时间延长峰值逐渐降低,6 h后色素保存率为48.77%;Pb2+于1 h产生大量沉淀后,色素吸收峰消失,于397 nm波长处检测的色素保存率急剧下降,6 h后色素保存率仅为16.48%。因此,丰年虫卵壳色素在贮藏和使用过程中避免接触对其稳定性影响较大的金属盐类。
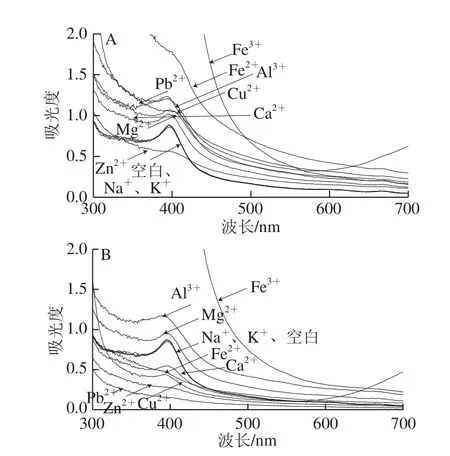
图7 不同金属离子处理1 h(A)与6 h(B)时的丰年虫卵壳色素溶液紫外-可见扫描光谱Fig.7 Ultraviolet-visible spectra of the pigment from Chirocephalus diaphanous with different metal ions for 1 h(A)and 6 h(B)
2.2.6氧化剂过氧化氢对丰年虫卵壳色素稳定性的影响
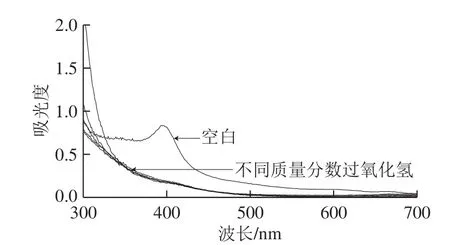
图8 过氧化氢对丰年虫卵壳色素溶液紫外-可见扫描光谱的影响Fig.8 Effect of H2O2on the ultraviolet-visible spectrum of the pigment from Chirocephalus diaphanous eggshell
由图8可知,过氧化氢处理后的色素溶液,特征吸收峰消失。由表4可知,不同质量分数的过氧化氢对色素稳定性均具有显著影响,且色素保存率随着时间的延长不断下降,且该降低趋势随着过氧化氢质量分数增加愈发明显,过氧化氢质量分数为5%时,6 h后的色素保存率仅为21.86%。所以,丰年虫卵壳色素耐氧化性较差,并可初步推断该色素具有一定的抗氧化活性基团。
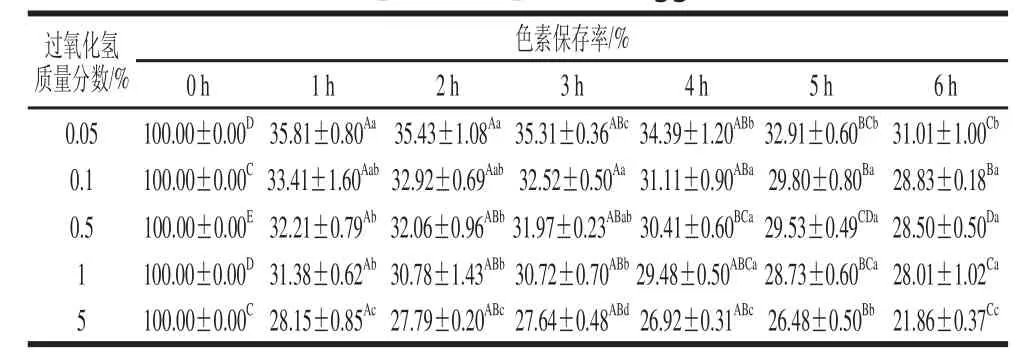
表4 过氧化氢对丰年虫卵壳色素稳定性的影响Table 4 Effect of H on the stability of the pigment from Chirocephalus diaphanous eggshell
2.2.7还原剂抗坏血酸对丰年虫卵壳色素稳定性的影响
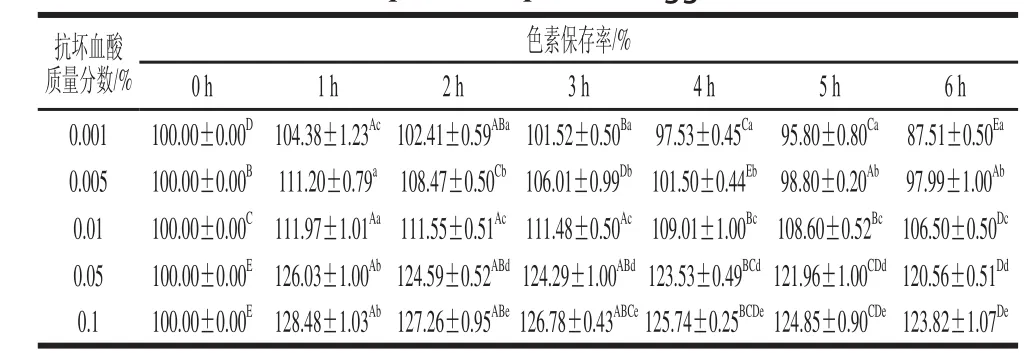
表5 抗坏血酸对丰年虫卵壳色素稳定性的影响Table 5 Effect of ascorbic acid on the stability of the pigment from Chirocephalus diaphanous eggshell
由表5可知,不同质量分数的抗坏血酸对色素起初均有一定增色效果,其中0.001%的抗坏血酸处理6 h后,色素保存率降至87.51%,反而在一定程度上破坏了色素稳定性;0.005%的抗坏血酸处理6 h后,色素保存率为97.99%,下降不明显;而0.01%、0.05%和0.1%的抗坏血酸处理过程中增色效果较为明显,并且色素保存率下降趋势缓慢,6 h后分别为106.50%、120.56%和123.82%。所以,丰年虫卵壳色素具有较高的耐还原性,并且在加工使用时,适量添加还原剂可产生一定的增色效果。
2.3丰年虫卵壳色素体外抗氧化活性分析
2.3.1总抗氧化能力
由图9可知,丰年虫卵壳色素与抗坏血酸均具有一定的抗氧化能力,且随着质量浓度的增加而上升。其中,丰年虫卵壳色素在质量浓度0.2~10.0 mg/mL范围内与吸光度呈良好线性关系,线性拟合方程为y=0.109 9x+0.080 6(R2=0.988 8);抗坏血酸则在质量浓度0.02~0.20 mg/mL范围内与吸光度呈良好线性关系,拟合方程为 y=9.246 7x+0.144 1(R2=0.994 5)。通过拟合方程分别计算出各样品在A700 nm=1时的质量浓度:色素8.366 mg/mL、抗坏血酸0.093 mg/mL,说明丰年虫卵壳色素总抗氧化能力弱于抗坏血酸,约是抗坏血酸的0.011 倍。
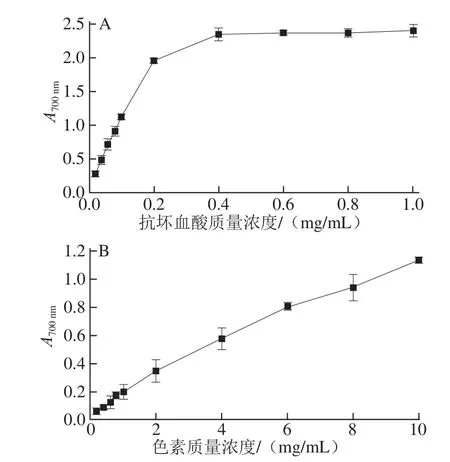
图9 抗坏血酸(A)与丰年虫色素(B)总抗氧化能力Fig.9 Total antioxidant activities of ascorbic acid(A)and the pigment from Chirocephalus diaphanous eggshell(B)
2.3.2·OH清除活性
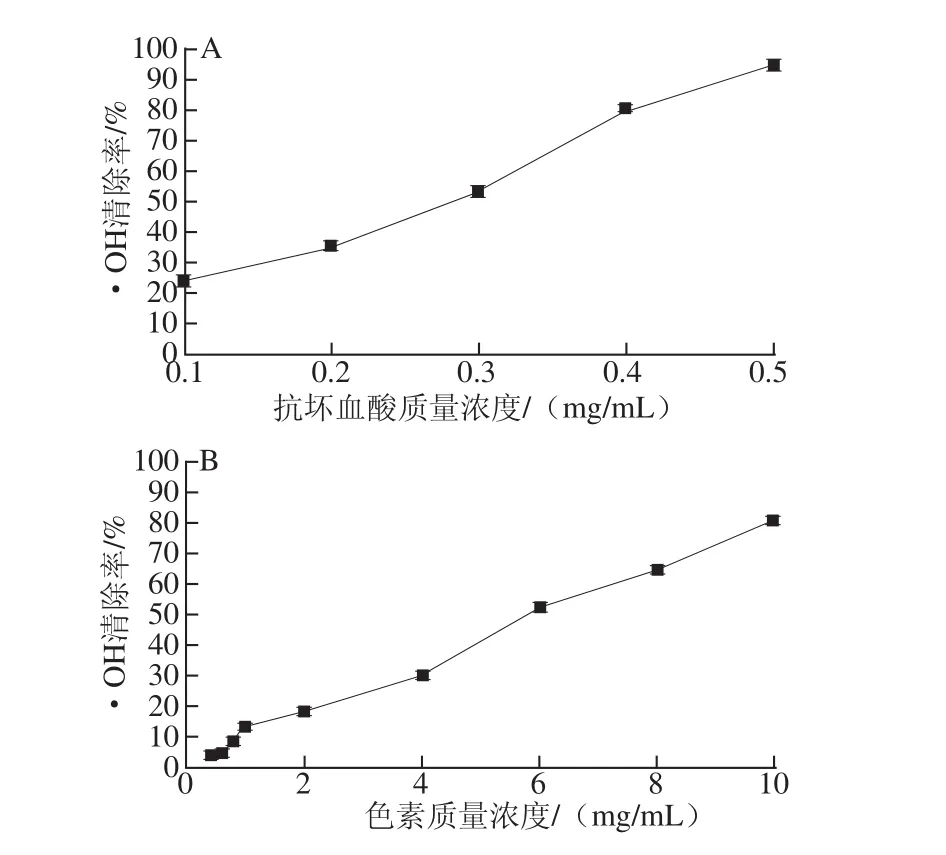
图10 抗坏血酸(A)与丰年虫色素(B)的·OH清除活性Fig.10 Hydroxyl radical scavenging activity of ascorbic acid(A)and the pigment from Chirocephalus diaphanous eggshell(B)
由图10可知,丰年虫卵壳色素与抗坏血酸均具有一定的·OH清除活性,且随着质量浓度的增加而逐渐增强。其中,丰年虫卵壳色素在质量浓度0.4~10.0 mg/mL范围内与·OH清除率呈良好线性关系,线性拟合方程为y=7.915 3x+1.683 1(R2=0.994 5);抗坏血酸则在质量浓度0.1~0.5 mg/mL范围内与·OH清除率呈良好线性关系,拟合方程为y=186.558 1x+1.357 4(R2=0.983 5)。通过拟合方程分别计算出各样品的IC50:色素6.104 mg/mL、抗坏血酸0.261 mg/mL,说明丰年虫卵壳色素·OH清除活性弱于抗坏血酸,约是抗坏血酸的0.043 倍。
2.3.3ABTS+·清除活性
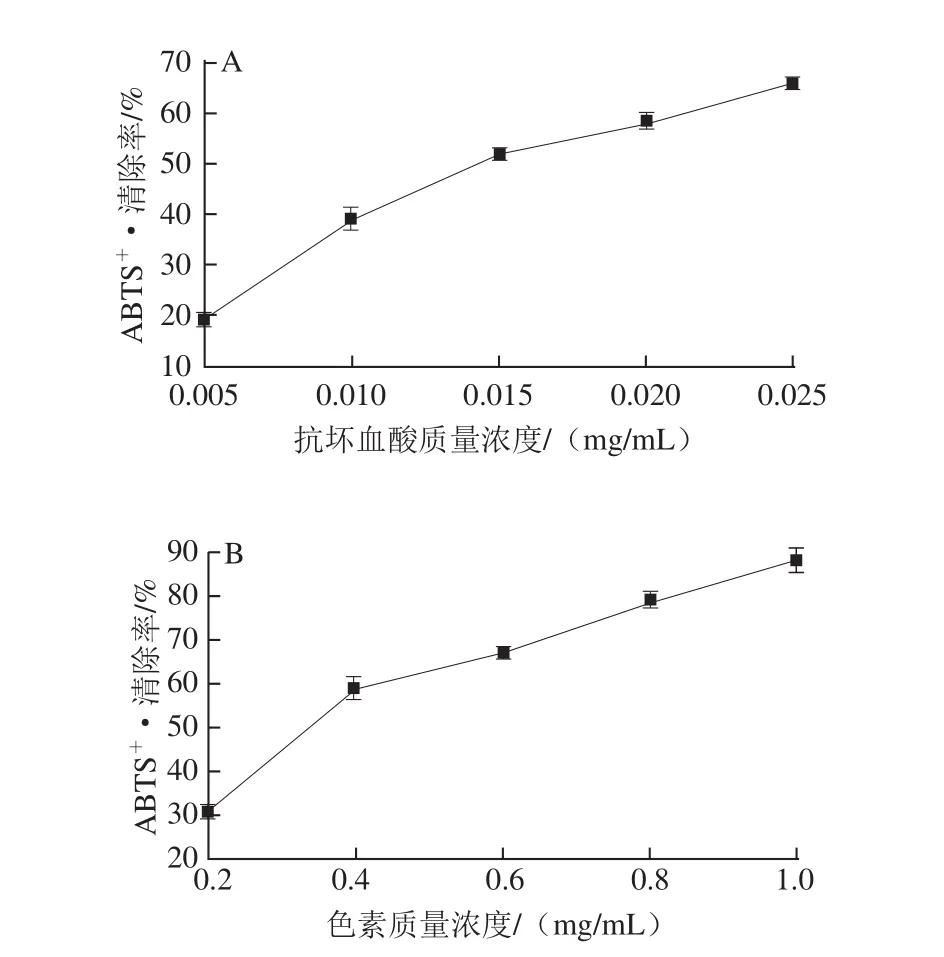
图11 抗坏血酸(A)与丰年虫色素(B)对ABBTTSS+·的清除活性Fig.11 ABTS radical scavenging activity of ascorbic acid(A)and the pigment from Chirocephalus diaphanous eggshell(B)
由图11可知,丰年虫卵壳色素与抗坏血酸均具有一定的ABTS+·清除活性,且随着质量浓度的增加而逐渐增强。其中,色素在质量浓度0.2~1.0 mg/mL范围内与ABTS+·清除率呈良好线性关系,线性拟合方程为y=66.351 0x+25.016 7(R2=0.939 8);抗坏血酸则在质 量浓度0.005~0.025 mg/mL范围内与ABTS+·清除率呈良好线性关系,拟合方程为y=2 234.181 6x+13.327 3 (R2=0.942 5)。通过拟合方程分别计算出各样品的IC50:色素0.377 mg/mL、抗坏血酸0.016 mg/mL,说明丰年虫卵壳色素ABTS+·清除活性弱于抗坏血酸,约是抗坏血酸的0.042 倍。
3 结 论
丰年虫卵壳色素为黑褐色粉末,其溶液在397 nm波长处具有最大吸收峰。红外光谱表明丰年虫卵壳色素可能是由一类含有羟基、烷烃—CH2、碳碳三键及醚键的酰胺-芳香族复合物组成的混合物。
丰年虫卵壳色素对光较为敏感,避光环境中很稳定。4、40、60 ℃及室温对色素基本无影响,80 ℃会一定程度影响色素稳定性。pH值变化对色素稳定性影响较小,且酸性条件对其具有增色效应。不同食品添加剂对色素稳定性影响不同:蔗糖、碳酸钠、碳酸氢钠及柠檬酸钠对色素稳定性影响较低,苯甲酸钠对色素破坏较大,柠檬酸、酒石酸及可溶性淀粉则对色素具有增色效应。不同金属离子对色素稳定性影响也不同:Na+和K+对色素稳定性影响很小,Mg2+和Al3+对色素均具有增色效应,Ca2+、Zn2+、Fe3+、Fe2+、Cu2+及Pb2+则对色素均具有一定程度的破坏。色素容易被氧化剂破坏,却具有较高的耐还原性,适量的还原剂对其具有增色效应。
丰年虫卵壳色素具有一定的总抗氧化能力,清除·OH与ABTS+·的IC50分别为6.104、0.377 mg/mL,虽均弱于抗坏血酸,但作为天然添加剂应用于食品中,仍可起到一定的抗氧化作用。
参考文献:
[1]李永祥,詹少华,蔡永萍,等.板栗壳色素的提取,纯化及稳定性[J].农业工程学报,2008,24(9):298-302.DOI:10.3321/j.issn:1002-6819.2008.09.060.
[2]乔华,张生万,李美萍,等.天然色素稳定性研究及其新的类型划分[J].食品科学,2006,27(9):69-73.DOI:10.3321/j.issn:1002-6630.2006.09.011.
[3]KHAN A A,IQBAL N,ADEEL S,et al.Extraction of natural dye from red calico leaves:gamma ray assisted improvements in colour strength and fastness properties[J].Dyes and Pigments,2014,103:50-54.DOI:10.1016/j.dyepig.2013.11.024.
[4]吕曼曼,刘航,苗修港,等.超声波辅助提取高粱全粉色素工艺及其体外抗氧化性分析[J].食品科学,2014,35(16):39-45.DOI:10.7506/spkx1002-6630-201416008.
[5]SWAMY G J,SANGAMITHRA A,CHANDRASEKAR V.Response surface modeling and process optimization of aqueous extraction of natural pigments from Beta vulgaris using Box-Behnken design of experiments[J].Dyes and Pigments,2014,111:64-74.DOI:10.1016/j.dyepig.2014.05.028
[6]曾惠琴,张艳明,金辉.黑米色素稳定性研究[J].食品研究与开发,2014,35(19):17-20.DOI:10.3969/j.issn.1005-6521.2014.19.005.
[7]丁月,徐超,陈霞霞,等.正交试验优化鼠曲草色素提取及其稳定性[J].食品科学,2013,34(10):103-106.DOI:10.7506/spkx1002-6630-201310022.
[8]张庆庆,张帝,汤文晶,等.水溶性和醇溶性红曲色素的光稳定性[J].食品科学,2015,36(1):94-98.DOI:10.7506/spkx1002-6630-201501018.
[9]VELMURUGAN P,KAMALA-KANNAN S,BALACHANDAR V,et al.Natural pigment extraction from five filamentous fungi for industrial applications and dyeing of leather[J].Carbohydrate Polymers,2010,79(2):262-268.DOI:10.1016/j.carbpol.2009.07.058.
[10]徐春明,李丹,王英英,等.食品色素的生物合成研究进展[J].中国食品学报,2014,14(2):225-233.
[11]魏娜,徐琼,张宁,等.掷孢酵母类胡萝卜素的提取与鉴定[J].食品科学,2014,35(19):133-137.DOI:10.7506/spkx1002-6630-201419028.
[12]SANT’ANNA V,GURAK P D,FERREIRA MARCZAK L D,et al.Tracking bioactive compounds with colour changes in foods:a review[J].Dyes and Pigments,2013,98(3):601-608.DOI:10.1016/j.dyepig.2013.04.011.
[13]李宗哲,李德远,苏丹,等.天然色素加工新进展及发展对策研究[J].中国食物与营养,2015,21(2):39-42.DOI:10.3969/j.issn.1006-9577.2015.02.010.
[14]李鹏霄,茆广华,赵婷,等.火棘果红色素的提取及抗氧化活性[J].食品科学,2013,34(17):116-119.DOI:10.7506/spkx1002-6630-201317026.
[15]盛玮,高翔,薛建平,等.黑糯玉米色素清除亚硝酸盐及阻断亚硝胺合成的研究[J].食品科学,2013,34(17):92-95.DOI:10.7506/spkx1002-6630-201317021.
[16]王威.常用天然色素抗氧活性的研究[J].食品科学,2003,24(6):96-100.DOI:10.3321/j.issn:1002-6630.2003.06.022.
[17]CEVALLOS-CASALS B A,CISNEROS-ZEVALLOS L.Stability of anthocyanin-based aqueous extracts of Andean purple corn and red-fleshed sweet potato compared to synthetic and natural colorants[J].Food Chemistry,2004,86(1):69-77.DOI:10.1016/j.foodchem.2003.08.011.
[18]LEITNER P,FITZ-BINDER C,MAHMUD-ALI A,et al.Production of a concentrated natural dye from Canadian Goldenrod(Solidago canadensis)extracts[J].Dyes and Pigments,2012,93(1):1416-1421.DOI:10.1016/j.dyepig.2011.10.008.
[19]张水军,张军兵,熊勇.天然食用色素的研究进展[J].中国食品添加剂,2014(8):172-177.
[20]张建新,王欣.丰年虫油对高血脂症小鼠降血脂及抗氧化作用[J].食品科学,2014,35(1):258-260.DOI:10.7506/spkx1002-6630-201323051.
[21]聂路,张建新,李文学,等.丰年虫水溶性蛋白的分离纯化及体外抗氧化性研究[J].食品科学,2012,33(15):122-126.
[22]黄晓燕.丰年虫卵壳壳聚糖的提取工艺优化与功能性研究[D].杨凌:西北农林科技大学,2012.
[23]谢红民,刁治民,邓君,等.青海卤虫资源现状,开发利用及可持续发展[J].四川理工学院学报(自然科学版),2006,19(1):93-96.DOI:10.3969/j.issn.1673-1549.2006.01.027.
[24]许彦腾,张建新,宋真真,等.黑水虻幼虫蛋白质的制备及体外抗氧化活性[J].核农学报,2014,28(11):2001-2009.DOI:10.11869/j.issn.100-8551.2014.11.2001.
[25]刘洪对,于丽娜,高俊安,等.五种花生抗氧化肽体外抗氧化活性比较[J].核农学报,2013,27(8):1162-1167; 1172.DOI:10.11869/hnxb.2013.08.1162.
Preparation,Stability and in Vitro Antioxidant Activity of Pigment from Chirocephalus diaphanous Eggshell
XU Yanteng,ZHANG Jianxin*,HE Qiufen,WEN Huan
(College of Food Science and Engineering,Northwest A&F University,Yangling 712100,China)
Abstract:Chirocephalus diaphanous eggshell was ground,defatted and sieved before being subjected to ultrasonic-assisted extraction with 60% ethanol solution as the solvent to obtain pigment.The structure of the pigment as well as its maximum absorption peak was determined by infrared and ultraviolet-visible spectroscopy.Then effects of light,temperature,pH,food additives,metal ions,oxidant and reductant on its stability were investigated.Total antioxidant capacity and hydroxyl and ABTS radical scavenging activities of the pigment were measured by in vitro.The results showed that the pigment was a dark brown powder composed of amide-aromatic compounds with –OH,–CH2–,–C≡C– and –C–O–C–,and the maximum absorption peak appeared at 397 nm.The pigment was sensitive to outdoor natural light,ultraviolet light and high temperature.pH,sacrose,sodium carbonate,sodium bicarbonate,sodium citrate,Na+and K+could affect the stability of the pigment.Acidic environment,citric acid,tartaric acid,soluble starch,Mg2+and Al3+had a hyperchromic effect on the pigment.However,sodium benzoate,Ca2+,Zn2+,Fe3+,Fe2+,Cu2+and Pb2+could destroy the pigment in different degrees.The pigment could be easily damaged by oxidant,but it had high capacity to resist reduction.The pigment possessed favorable total antioxidant activity,and its IC50for scavenging hydroxyl and ABTS radicals were 6.104 and 0.377 mg/mL,respectively.Therefore,the pigment can be used as a natural antioxidant.
Key words:Chirocephalus diaphanous eggshell; pigment; stability; in vitro antioxidant activity
中图分类号:TS202
文献标志码:A
文章编号:1002-6630(2016)05-0094-08
DOI:10.7506/spkx1002-6630-201605018
*通信作者:张建新(1959—),男,教授,硕士,主要从事食品营养与安全及标准化研究。E-mail:zhangjx59@foxmail.com
作者简介:许彦腾(1989—),男,硕士研究生,主要从事食品营养与安全研究。E-mail:xuyanteng89@gmail.com
收稿日期:2015-03-11
