干燥方式对金银花多酚组分及其抗氧化活性的影响
2016-04-15游玉明陈泽雄重庆文理学院林学与生命科学学院重庆402160
邹 容,游玉明,陈泽雄,胡 凯,冉 烈(重庆文理学院林学与生命科学学院,重庆 402160)
干燥方式对金银花多酚组分及其抗氧化活性的影响
邹 容,游玉明,陈泽雄,胡 凯,冉 烈
(重庆文理学院林学与生命科学学院,重庆 402160)
摘 要:研究传统热风干燥、自然阴干以及真空干燥、真空冷冻干燥等不同干燥方式对金银花多酚类物质含量及抗氧化活性的影响。采用Folin-酚比色法及高效液相色谱(high performance liquid chromatography,HPLC)法分别检测4 种干燥方式下的金银花总酚及多酚类组分含量,并比较其清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟自由基(•OH)和2,2’-二氮-双(3-乙基苯并噻唑-6-磺酸)铵盐(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonate acid)diammonium salt,ABTS)自由基的能力。结果表明:4 种干燥方式对金银花总酚含量及多酚类组分均有一定影响,其中真空冷冻干燥处理时金银花总酚及多酚类组分损失最小;不同干燥方式对金银花的抗氧化能力影响显著(P<0.05),真空冷冻干燥样品清除DPPH自由基、•OH和ABTS+•的半抑制浓度(IC50)分别为5.43、17.64、44.32 μg/mL;而自然阴干、真空干燥和热风干燥处理的样品清除DPPH自由基、•OH 及ABTS+•的IC50高于真空冷冻干燥金银花相应的IC50。相关性分析显示,金银花酚酸类组分与其抗氧化活性显著相关(P<0.05)。因此,真空冷冻干燥能较好地保留金银花多酚类物质,且具有较强的抗氧化活性,适宜用于金银花的干燥。
关键词:金银花;干燥方式;多酚;抗氧化活性
重庆文理学院校级项目(Z2014LX08);重庆文理学院特色林木种质资源创新重点实验室平台建设项目
引文格式:
邹容,游玉明,陈泽雄,等.干燥方式对金银花多酚组分及其抗氧化活性的影响[J].食品科学,2016,37(5):78-83.
ZOU Rong,YOU Yuming,CHEN Zexiong,et al.Effects of drying methods on polyphenol compounds and antioxidant activities of Lonicera japonica flower[J].Food Science,2016,37(5):78-83.(in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201605015.http://www.spkx.net.cn
金银花为我国国家卫生和计划生育委员会确认的药食两种植物材料,具有清热解毒、消炎抗菌、增强免疫等多种生理功效,是我国传统的中药材,也是功能性饮料、高档食用香料及化妆品生产的原料[1-3]。新鲜金银花含水量较高,不易长期贮存,采后必须及时干燥,但金银花具有热敏性,在干燥过程中易引起由多酚氧化酶催化以绿原酸为主的多酚类物质氧化,产生褐变和活性成分的损失[4-5]。研究表明,金银花的生物学活性大多与其所富含的绿原酸、木犀草苷及芦丁等多酚类物质有关[6-10],干燥时造成多酚类物质的损失,降低了金银花的商品价值。因此,采取适宜的干燥方式,最大限度地保留其活性成分,有利于金银花产业的健康发展。
目前,金银花主要采用阴干、晒干和热风干燥等传统干燥方法[11]以及真空干燥、变温干燥和气调干燥等现代干燥技术[12-14]。陈德经[15]研究发现晒干、真空干燥、真空冷冻干燥和微波干燥等对金银花外观质量、绿原酸含量和保存期影响显著。彭菊艳等[16]比较了真空干燥、冷冻干燥及晒干等6 种干燥方式对金银花药用品质的影响,结果同样表明不同干燥方式对金银花品质影响较大,其中蒸后烘干和微波干燥技术可作为规模化加工金银花的方法。但关于不同干燥方式对金银花多酚类物质及抗氧化活性的影响鲜有报道。因此,本实验拟研究传统干燥方法(自然阴干和热风干燥)以及现代干燥技术(真空干燥和真空冷冻干燥)对金银花总酚含量及主要多酚类组分的影响,并采用体外化学法评价不同干燥方式对其抗氧化活性的影响,以期为金银花的干燥及品质控制提供理论参考。
1 材料与方法
1.1材料与试剂
金银花采自重庆市秀山县金银花种植基地,品种为“渝蕾一号”。选取色泽鲜亮、无虫蛀、无机械损伤的新鲜金银花为原料,其含水量为78.46%。
绿原酸(chlorogenic acid)、香豆酸(p-coumalic acid)、咖啡酸(caffeic acid)、阿魏酸(ferulic acid)、肉桂酸(trans-cinnamic acid)、木犀草苷(luteolin-7-O-glucoside)、芦丁(rutin)、没食子酸标准品(纯度>95%) 美国Sigma公司;Folin-酚、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-二氮-双(3-乙基苯并噻唑-6-磺酸)铵盐(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonate acid)diammonium salt,ABTS)均为分析纯 北京索莱宝科技有限公司;甲醇(色谱纯) 成都市科龙化工试剂厂。
1.2仪器与设备
LC-20A型高效液相色谱仪 日本岛津公司;ALPHA 1-4型真空冷冻干燥机 德国Christ公司;UV 2600型分光光度计 上海天美科技科学仪器有限公司;DZF-1B型真空干燥箱 上海跃进医疗器械有限公司;DGG-9246A型电热鼓风干燥箱 上海齐欣科学仪器有限公司。
1.3方法
1.3.1干燥处理
采用自然阴干(以下简称阴干)、真空冷冻干燥(以下简称冻干)、热风干燥(以下简称热风)及真空干燥(以下简称真空)4 种方式对金银花进行干燥处理。其中自然阴干将样品置于干燥、通风良好的室内进行,温度约15~25 ℃条件下干燥72 h;真空冷冻干燥将样品于-80 ℃冰箱中预冻后,在冷阱温度为-50 ℃、隔板加热温度为20 ℃、真空度为0.12 mbar条件下干燥24 h;热风干燥在50 ℃条件下干燥12 h;真空干燥在50 ℃、0.09 MPa条件下干燥16 h。各干燥方式处理后样品含水量均低于5%,粉碎后密封避光保存,备用。
1.3.2金银花多酚类物质的提取
参考Yuan Yuan等[17]的方法:准确称取过40 目筛的金银花粉末0.5 g,加入40 mL 70%乙醇,称质量,于室温条件下采用超声辅助提取30 min,放冷,用70%乙醇补足减轻的质量,4 000 r/min离心10 min,取上清即为金银花多酚类物质提取液,用于总酚含量及多酚类组成的测定。
1.3.3多酚类物质含量的测定
采用Folin-Ciocalteu比色法[18]:分别移取稀释到适宜质量浓度的金银花多酚提取液200 μL,置于10 mL比色管中,加入1 mL 10%的Folin-酚试剂,反应4 min后,再加入1 mL 7.5%的Na2CO3溶液,用蒸馏水稀释至10 mL,摇匀、避光保存2 h,于765 nm波长处测定吸光度,结果以金银花干基中含有没食子酸当量表示,单位为mg/g。标准曲线以没食子酸标准溶液绘制,其质量浓度范围为0~50 mg/L。
1.3.3.2多酚类物质组成的测定
采用高效液相色谱法[19]:以岛津Shim-packVPODS C18柱(4.6mm×250mm,5μm)对其进行分离;流动相为2%甲酸(A相)以及2%甲酸-甲醇溶液(B相);梯度洗脱程序为:0.00~8.00min15%B,8.01~25.00min15%~50%B,25.01~40.00min50%B,40.01~45.00min50%~9 0%B,45.01~50.00min90%~15%B,50.01~60.00min15%B;流速:0.7mL/min;柱温:35℃;进样量:20μL;检测波长:280nm。
混合标准溶液的配制:准确称取50~65 mg的绿原酸、阿魏酸、香豆酸、咖啡酸、肉桂酸、芦丁以及5.8 mg的木犀草苷标准品,以70%的甲醇定容至10 mL,摇匀,-20 ℃保存备用。使用前,将此标准储备液以70%甲醇稀释至适宜质量浓度,配制混合标准工作液。
1.3.4体外抗氧化能力测定
1.3.4.1DPPH自由基清除能力测定
参考Zimmer等[20]的方法,并略作修改:用70%乙醇溶液配制质量浓度为5、10、20、40、80、160 μg/mL的多酚待测液。在比色管中依次加入2 mL待测液和2 mL 0.2 mmol/L的DPPH乙醇溶液,混匀,避光反应30 min,然后于517 nm波长处测定其吸光度A1;同时,将不同质量浓度的样品溶液2 mL与无水乙醇混匀反应后测定其吸光度A2,将2 mL DPPH和2 mL 70%乙醇溶液混匀反应后测得其吸光度A0。按照公式(1)计算样品的DPPH自由基清除率,并计算其半抑制浓度(IC50)。
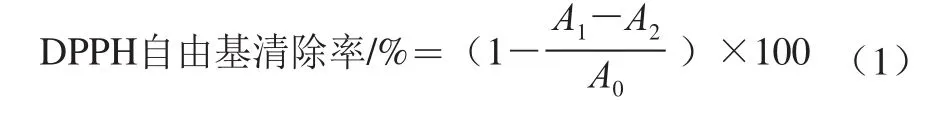
1.3.4.2羟自由基(•OH)清除能力测定
结合表2数据可以得出,22 ℃环境下,肉鸡下丘脑热休克蛋白70的浓度最高(除第10天),第3天和第10天18 ℃和26 ℃处理组肉鸡下丘脑热休克蛋白70的浓度显著高于22 ℃时(P<0.05),见表2。结合表3数据还可以得出,在试验的第1天、第3天和第10天,温度升高对肉鸡体核温度产生的影响均十分显著(P<0.05),30 ℃环境下,肉鸡体核温度均显著高于其他组别(P<0.05),见表3。
采用Fenton反应体系[21]:在比色管中加入1.8 mmol/L的硫酸亚铁溶液2 mL、1.8 mmol/L水杨酸-乙醇溶液1.5 mL以及不同质量浓度的样品待测液1 mL混匀后,加入0.03% 的H2O2溶液0.1 mL摇匀,37 ℃条件下水浴30 min,在510 nm波长处测定其吸光度A1;以蒸馏水代替样液,按上述步骤操作测定其吸光度A2;以蒸馏水代替样液和H2O2溶液,按上述步骤操作测定其吸光度A0。按照公式(2)计算样品的•OH清除率,并计算其半抑制浓度(IC50)。
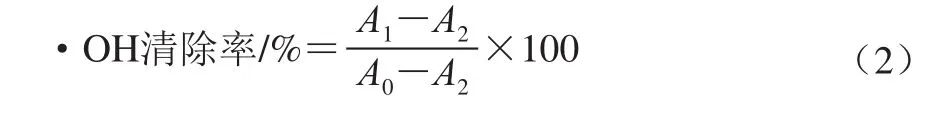
1.3.4.3ABTS+·清除能力测定
参考Zhang Yujuan等[22]的方法:取7 mmol/L的ABTS溶液和2.45 mmol/L的过硫酸钾溶液等体积混合,在室温、避光条件下静置反应12~16 h,制备成ABST+·储备液。将ABTS+·储备液用10 mmol/L pH 7.4的磷酸盐缓冲液稀释,使其在734 nm波长处的吸光度为0.70±0.02,得到ABST+·工作液。测定时取3.9 mL ABST+·工作液和0.1 mL的不同质量浓度的样品溶液混匀后,于室温条件下反应6 min,于734 nm波长处测定吸光度A1;以70%乙醇溶液为空白测定其吸光度A0。按照公式(3)计算ABTS+·清除率,并计算其半抑制浓度(IC50)。
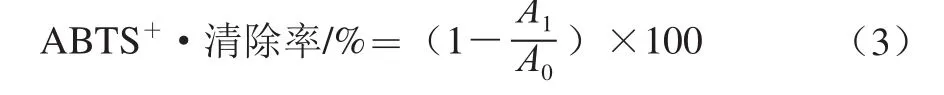
1.4数据统计处理
数据统计分析采用SPSS 21.0及Origin 8.1软件进行处理,实验重复3 次,结果以表示;采用方差分析进行Duncan’s多重比较分析,显著水平为P<0.05;相关性分析采用Pearson’s法。
2 结果与分析
2.1干燥方式对金银花总酚含量的影响
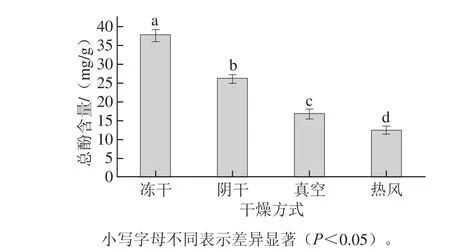
图1 干燥方式对金银花总酚含量的影响Fig.1 Effect of drying methods on the total phenolic content of Lonicera japonica
由图1可知,经4 种干燥方式处理后金银花中总酚含量的大小次序为冻干>阴干>真空>热风,且不同干燥方式之间存在显著差异(P<0.05)。其中冻干样品中总酚含量为37.74 mg/g,而采用热风干燥后,其总酚含量仅为12.43 mg/g。这可能与多酚氧化酶的作用有关,熊建华等[23]研究发现,金银花多酚氧化酶活性在45 ℃时最大,且随着温度的升高逐渐下降。本实验中,热风和真空干燥温度虽然均为50 ℃,但在热风干燥过程中,金银花样品与氧气充分接触,故多酚类物质因氧化而损失较多。而冻干处理在较低温度及高真空的环境下进行,氧气含量少且多酚氧化酶较为稳定,因此,样品中多酚类物质的损失较少。
2.2干燥方式对金银花多酚类物质组分的影响
2010年版《中华人民共和国药典》[24]规定绿原酸和木犀草苷作为金银花的主要功效成分,是评价其质量的重要指标。除此之外,芦丁、咖啡酸等也是金银花发挥生理功效的物质基础[7-9],而多酚类物质发挥其生理功效不仅与总酚含量有关,还与多酚的种类及组成有关[25]。为进一步了解不同干燥方式对金银花主要多酚类组分的影响,本实验采用高效液相色谱法分析了不同干燥条件下金银花中7 种主要多酚类物质的变化,其标准品及样品提取液的高效液相色谱图见图2,其定量分析结果见表1。
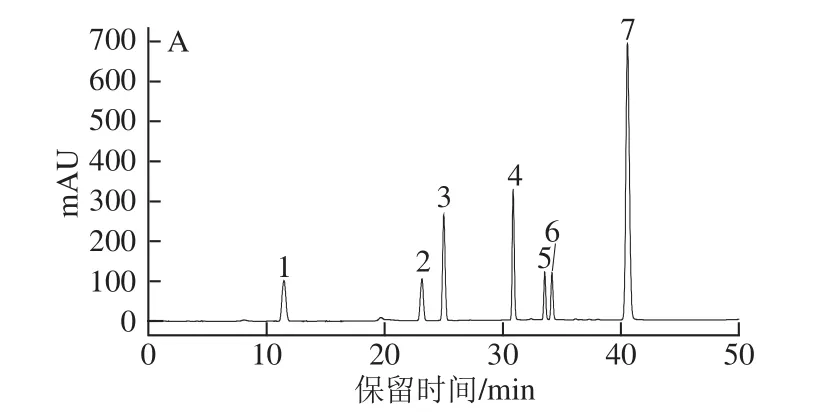
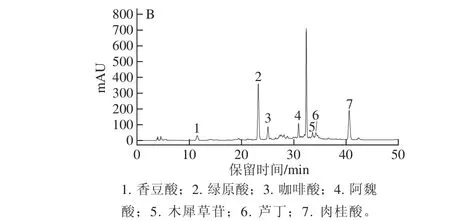
图2 多酚类化合物混合标准品(A)及冻干样提取液(BB)的高效液相色谱图Fig.2 HPLC chromatograms of phenolic compound standards(A)and phenols extracted from freeze dried Lonicera japonica(B)
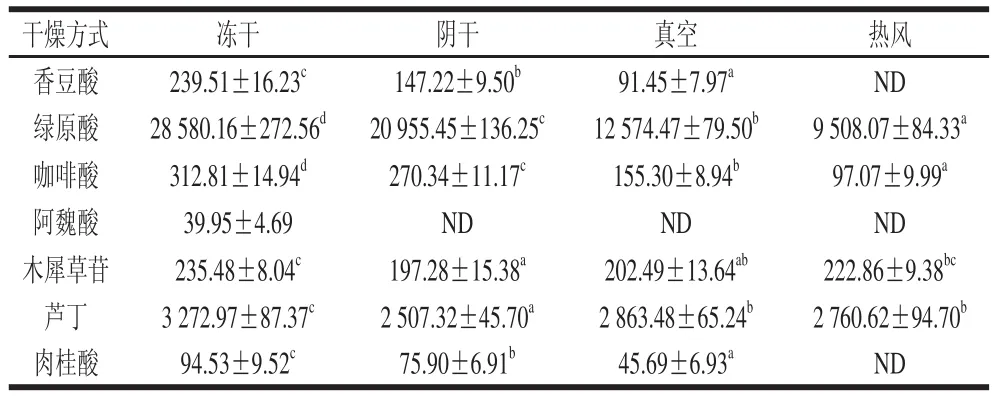
表1 干燥方式对金银花主要酚类物质含量的影响Table 1 Effect of drying methods on the contents of individual phenolic compounds in Lonicera japonica μg/g
由表1可知,不同干燥方式对金银花中绿原酸、香豆酸以及咖啡酸等5 种酚酸类物质含量影响显著(P<0.05),尤其是对绿原酸的影响最为明显,采用冻干处理时,金银花样品中绿原酸含量为28 580.16 μg/g,而采用真空和热风干燥时,其绿原酸含量分别为12 574.47、9 508.07 μg/g,低于2010年版《中华人民共和国药典》中所规定的1.5%[24];但相对酚酸类组分而言,不同干燥方式对金银花样品中木犀草苷和芦丁两种黄酮类化合物影响较小,冻干处理的金银花样品中木犀草苷和芦丁含量最高,分别为235.48、3 272.97 μg/g,阴干处理的金银花样品中其含量最低,分别为197.28、2 507.32 μg/g。前期研究表明,金银花干燥过程中,酶促氧化是导致以绿原酸为代表的酚酸类物质损失的主要途径,而该反应与氧气体积分数及干燥温度等条件密切相关[14,26]。本实验中,热风干燥在50 ℃条件下进行,此时酶活性较高且与氧气充分接触,因此造成了酚酸类物质的大量损失。而本实验中金银花黄酮类化合物损失较小,这可能是由于黄酮类化合物较绿原酸、咖啡酸等酚酸类物质热稳定性强,且不被多酚氧化酶所作用,但对光照敏感所致[27-28]。因此,本实验中金银花采用阴干处理时,受光照时间较长,而造成其芦丁及木犀草苷损失最多。
2.3干燥方式对金银花抗氧化活性的影响
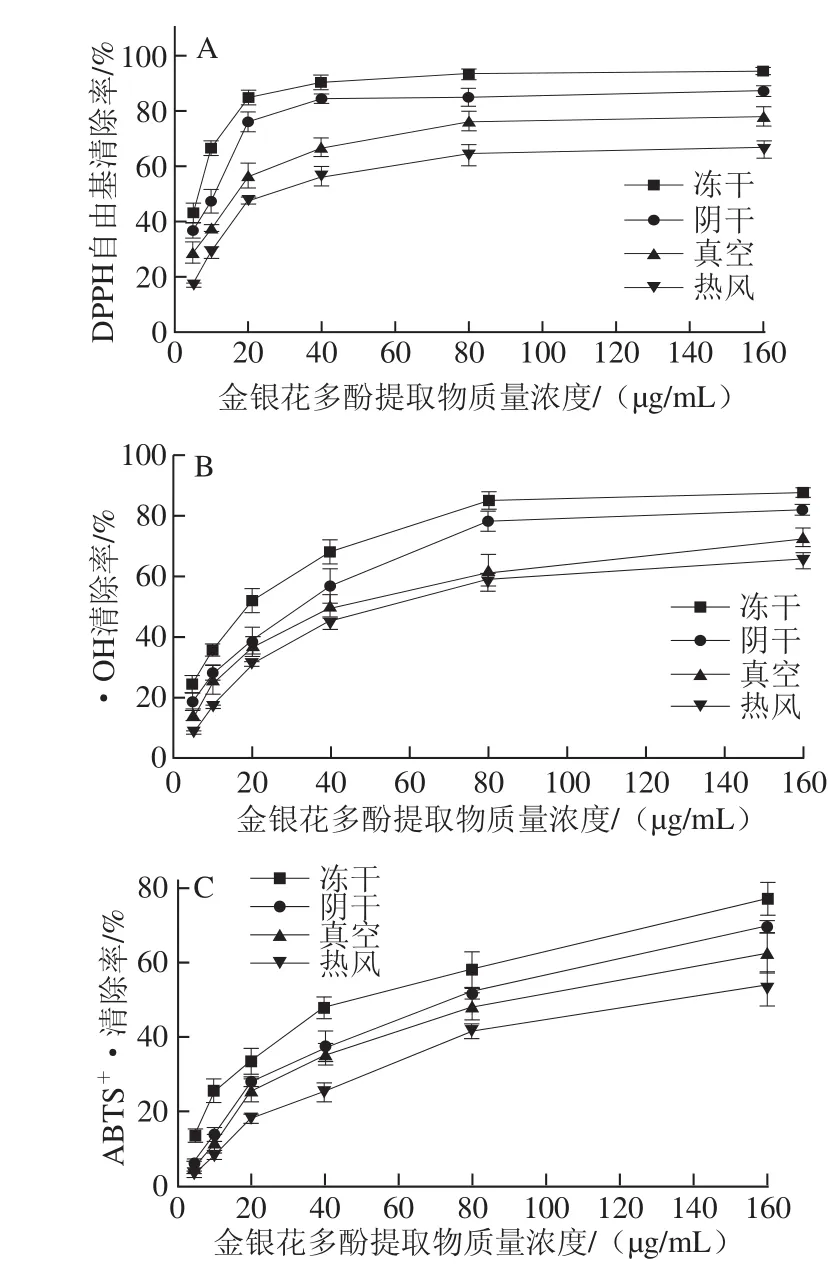
图3 干燥方式对金银花多酚提取物清除DPPH自由基(A)、·OH(BB)及AABBTTSS+·(C)能力的影响Fig.3 Effects of drying methods on the scavenging capacity of polyphenols extracted from Lonicera japonica against DPPH(A),hydroxyl(B)and ABTS(C)radicals
DPPH法、•OH法和ABTS法是评价化合物潜在抗氧化能力的常用方法。由图3A可知,4 种干燥方式处理的金银花多酚提取物对DPPH自由基的清除能力均随着其质量浓度的增加而逐渐增大;冻干、阴干、真空及热风干燥对DPPH自由基清除率的IC50值分别为5.43、8.44、17.31、34.99 μg/mL(表2),表明金银花多酚提取物具有较强的DPPH自由基清除能力,其中冻干及阴干处理样品对DPPH自由基作用差别较小。由图3B可知,不同干燥方式对•OH清除率的IC50值分别为17.64(冻干)、27.70(阴干)、43.19(真空)、58.27(热风)μg/mL(表2),干燥方式显著影响了金银花多酚提取物对•OH的清除能力(P<0.05),但不同干燥方式下金银花多酚提取物对•OH的清除能力均随着质量浓度的增加而增大,总体趋势与其对DPPH自由基的清除能力相似。由图3C可知,在实验质量浓度范围内(5~160 μg/mL),随着4 种干燥方式处理样品质量浓度的增加,其对ABTS+·的清除能力明显增大,其中冻干处理样品对ABTS+·的清除能力最强,其对ABTS+·的清除率由13.61% (5 μg/mL)上升到77.09%(160 μg/mL),但与金银花多酚提取物清除DPPH自由基和•OH的能力相比,金银花多酚提取物清除ABTS+·的能力较弱(清除率≤77.09%)。
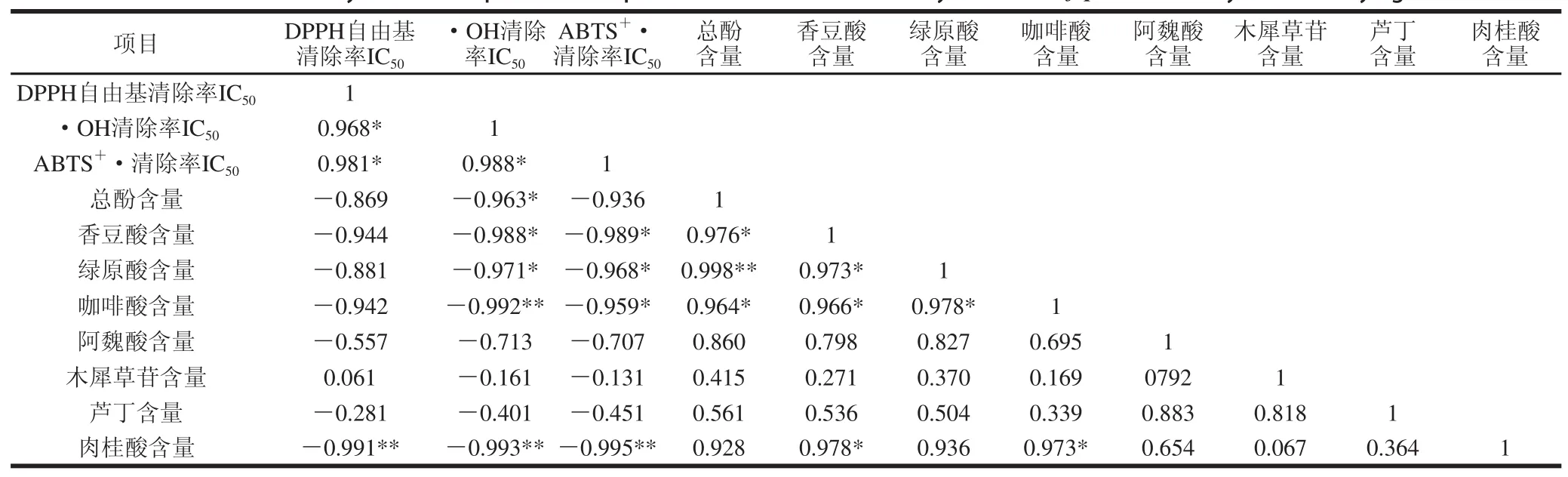
表 3 不同干燥处理金银花多酚类组分及抗氧化活性的相关性分析Table 3 Correlation analysis between phenolic compounds and antioxidant activity of Lonicera japoniiccaa dried by different drying methods
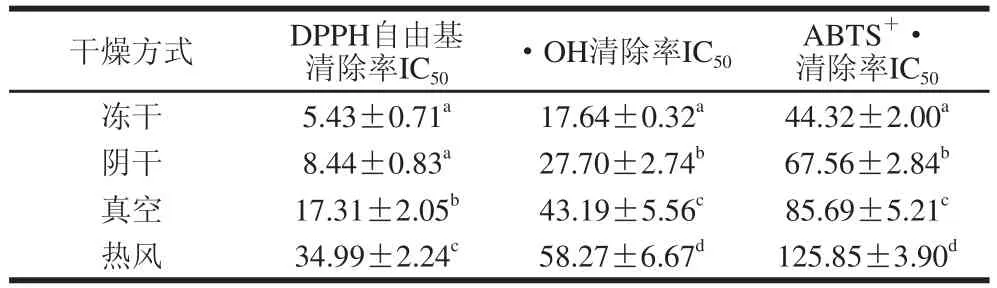
表2 不同干燥方式金银花抗氧化活性的IICC5500值Table 22 IICC5500 ooff Lonicera japonniiccaa dried by different drying methods for free radical scavenging activityyμg/mL
综合3 种抗氧化能力评价情况来看,不同干燥方式对金银花多酚提取物抗氧活性影响显著(P<0.05),且冻干>阴干>真空>热风。
2.4相关性分析
不同干燥方式处理后金银花多酚类组分及抗氧化活性的相关性分析见表3。其中多酚类组分的抗氧化能力均以IC50表示,其值越低表示其抗氧化能力越强。总酚含量与•OH清除率成显著负相关(P<0.05);•OH和ABTS+•清除率与香豆酸、绿原酸及咖啡酸含量成显著或极显著负相关(P<0.05或P<0.01);而肉桂酸含量与DPPH自由基、•OH和ABTS+•清除率成极显著负相关(P<0.01),但金银花多酚类组分对这3 种自由基的清除能力与木犀草苷及芦丁两种黄酮类化合物含量的相关性不显著(P>0.05)。相关性分析结果与前期研究结论一致[29-30],表明金银花的抗氧化活性主要与绿原酸、肉桂酸等酚酸类组分有关。
3 结 论
不同干燥方式对金银花总酚含量影响显著(P<0.05),其中经真空冷冻干燥处理的金银花中总酚含量最高,达到37.74 mg/g,其次为自然阴干和真空干燥,热风干燥的样品中总酚含量最低。经高效液相色谱分析发现,不同干燥方式对金银花中绿原酸、咖啡酸等酚酸类组分含量影响较大,而对芦丁及木犀草苷两种黄酮类组分含量影响较小。体外抗氧化结果表明,真空冷冻干燥金银花多酚提取物的DPPH自由基、•OH及ABTS+•清除能力均为最强,其次是自然阴干和真空干燥,最后是热风干燥。相关性分析显示,金银花的抗氧化活性与其含有的酚酸类组分含量显著相关(P<0.05)。
综上所述,真空冷冻干燥处理对金银花总酚及多酚类组分损失最小,抗氧化能力最强,优于其他3 种干燥方法,较适于工业生产较高品质及高抗氧化活性的金银花产品。
参考文献:
[1]RAHMAN A,KANG S C.In vitro control of food-borne and food spoilage bacteria by essential oil and ethanol extracts of Lonicera japonica Thunb.[J].Food Chemistry,2009,116(3):670-675.DOI:10.1016/j.foodchem.2009.03.014.
[2]CHEN W C,LIOU S S,TZENG T F,et al.Wound repair and antiinflammatory potential of Lonicera japonica in excision woundinduced rats[J].BMC Complementary and Alternative Medicine,2012,12:226.DOI:10.1186/1472-6882-12-226.
[3]SHANG X F,PAN H,LI M X,et al.Lonicera japonica Thunb.:ethnopharmacology,phytochemistry and pharmacology of an important traditional Chinese medicine[J].Journal of Ethnopharmacology,2011,138(1):1-21.DOI:10.1016/j.jep.2011.08.016.
[4]郝英超.金银花褐变过程酚类物质代谢机理研究[D].洛阳:河南科技大学,2013:15.
[5]罗磊,周燕燕,朱文学,等.金银花多酚氧化酶特异性与抑制剂动力学研究[J].农业机械学报,2014,4 5(7):202-208.DOI:10.6041/j.issn.1000-1298.2014.07.032.
[6]PARK H S,PARK K I,LEE D H,et al.Polyphenolic extract isolated from Korean Lonicera japonica Thunb.induce G2/M cell cycle arrest and apoptosis in HepG2 cells:involvements of PI3K/Akt and MAPKs[J].Food Chemistry and Toxicology,2012,50(7):2407-2416.DOI:10.1016/j.fct.2012.04.034.
[7 ]LEE E J,KIM J S,KIM H P,et al.Phenolic constituents from the flower buds of Lonicera japonica and their 5-lipoxygenase inhibitory activities[J].Food Chemistry,2010,120(1):134-139.DOI:10.1016/j.foodchem.2009.09.088.
[8]SEO O N,KIM G S,PARK S,et al.Determination of polyphenol components of Lonicera japonica Thunb.using liquid chromatography-tandem mass spectrometry:contribution tothe overall antioxidant activity[J].Food Chemistry,2012,134(1):572-577.DOI:10.1016/j.foodchem.2012.02.124.
[9]XIONG J H,LI S C,WANG W J,et al.Screening and identification of the antibacterial bioactive compounds from Lonicera japonica Thunb.leaves[J].Food Chemistry,2013,138( 1):327-333.DOI:10.1016/j.foodchem.2012.10.127.
[10]FAN L,LIN C H,DUAN W J,et al.Rapid and quantitative determination of 10 major active components in Lonicera japonica Thunb.by ultrahigh pressure extraction-HPLC/DAD[J].High Pressure Research,2015,35(1):57-68.DOI:10.1080/08957959.2014.1001384.
[11]霍文杰,李卫民,高英.干燥方法对金银花中绿原酸、木犀草苷及总黄酮含量的影响[J].广州中医药大学学报,2013,30(5):737-741.
[12]刘云宏,朱文学,刘建学.金银花真空干燥工艺优化[J].食品科学,2011,32(10):75-78.
[13]孙洁,王晓,周洁,等.变温干燥对良种金银花活性成分含量的影响[J].中华中医药杂志,2014,29(10):3302-3305.
[14]刘云宏,苗帅,罗磊,等.基于威布尔分布函数的金银花气调干燥实验研究[J].食品科学,2014,35(21):31-35.DOI:10.7506/spkx1002-6630-201421007.
[15]陈德经.干燥方法对金银花质量的影响[J].食品科学,2006,27(11):277-279.
[16]彭菊艳,龚月桦,王俊儒,等.不同干燥技术对金银花药用品质的影响[J].西北植物学报,2006,26(10):2044-2050.DOI:10.3321/j.issn:1000-4025.2006.10.014.
[17]YUAN Y,SONG L P,LI G M,et al.Genetic variation and metabolic pathway intricacy govern the active compound content and quality of the Chinese medicinal plant Lonicera japonica Thunb.[J].BMC Genomics,2012,13:195.DOI:10.1186/1471-2164-13-195.
[18]LI H B,WONG C C,CHENG K W,et al.Antioxidant properties in vitro and total phenolic contents in methanol extracts from medicinal plants[J].LWT-Food Science and Technology,2008,41(3):385-390.DOI:10.1016/j.lwt.2007.03.011.
[19]游玉明,陈泽雄,张美霞,等.HPLC-DAD法同时测定金银花中7种多酚类物质[J].食品工业科技,2014,35(16):57-60; 67.DOI:10.13386/j.issn1002-0306.2014.16.003.
[20]ZIMMER A R,LEONARDI B,MIRON D,et al.Antioxidant and antiinflammatory properties of Capsicum baccatum:from traditional use to scientific approach[J].Journal of Ethnopharmacology,2012,139(1):228-233.DOI:10.1016/j.jep.2011.11.005.
[21]董银萍,李拖平.山楂果胶的抗氧化活性[J].食品科学,2014,35(3):29-32.DOI:10.7506/spkx1002-6630-201403006.
[22]ZHANG Y J,WANG D M,YANG L N,et al.Purification and characterization of flavonoids from the leaves of Zanthoxylum bungeanum and correlation between their structure and antioxidant activity[J].PLoS ONE,2014,9(8):e105725.DOI:10.1371/journal.pone.0105725.
[23]熊建华,李世传,罗秋水,等.金银花叶多酚氧化酶的酶学特性[J].中国食品学报,2012,12(11):59-63.
[24]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010:28-29.
[25]ZHENG W,WANG S Y.Oxygen radical absorbing capacity of phenolics in blueberries,cranberries,chokeberries,and lingonberries[J].Journal of Agricultural and Food Chemistry,2003,51(2):502-509.DOI:10.1021/jf020728u.
[26]侯爽爽,罗磊.金银花热风干燥过程中颜色的劣变机理[J].农产品加工·学刊,2010(10):63-65.DOI:10.3969/j.issn.1671-9646(X).2010.10.019.
[27]杨丹,郝再彬,胡淑田,等.光照对芦丁稳定性及抑菌活性的影响[J].应用与环境生物学报,2011,17(2):223-226.
[28]王英,张玉刚,戴洪义,等.苹果果皮中类黄酮的超声波辅助提取及稳定性研究[J].食品科学,2011,32(16):178-181.
[29]关炳峰,谭军,周志娣.金银花提取物的抗氧化作用与其绿原酸含量的相关性研究[J].食品工业科技,2007,28(10):127-129.DOI:10.3969/j.issn.1002-0306.2007.10.037.
[30]罗磊,郭晓园.金银花提取液抗氧化活性研究[J].食品科学,2009,30(21):63-65.
Effects of Drying Methods on Polyphenol Compounds and Antioxidant Activities of Lonicera japonica Flower
ZOU Rong,YOU Yuming,CHEN Zexiong,HU Kai,RAN Lie
(College of Forestry and Life Science,Chongqing University of Arts and Sciences,Chongqing 402160,China)
Abstract:The aim of the present study was to evaluate the effects of four drying methods including hot air drying,shade drying,vacuum drying and vacuum freeze drying on polyphenol compounds and antioxidant activity of Lonicera japonica flower.The contents of total phenols and individual phenolic compounds were determined by Folin-Ciocalteu and high performance liquid chromatography(HPLC),respectively.In addition,the free radical scavenging activities of polyphenols extracted from Lonicera japonica flower against 1,1-diphenyl-2-picrylhydrazyl(DPPH),hydroxyl and 2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonate acid)diammonium salt(ABTS)radicals were determined.The results showed that the contents of total phenols and individual phenolic compounds were affected by four drying methods,especially by vacuum freeze drying.The antioxidant activities of polyphenols extracted from Lonicera japonica flower were also significantly affected by four drying methods(P < 0.05).The IC50of vacuum freeze dried Lonicera japonica for scavenging capacity against DPPH,hydroxyl and ABTS radicals were 5.43,17.64 and 44.32 μg/mL,respectively.It was clearly indicated that the IC50of hot air dried,shade dried and vacuum dried Lonicera japonica was higher than that of vacuum freeze dried sample.Correlation analysis exhibited a high relationship between phenolic acid and antioxidant activity(P < 0.05).Based on these results,vacuum freeze drying is the most suitable method for retaining phenolic compounds and antioxidant activities in Lonicera japonica.
Key words:Lonicera japonica; drying methods; polyphenols; antioxidant activity
中图分类号:TS201.4
文献标志码:A
文章编号:1002-6630(2016)05-0078-06
DOI:10.7506/spkx1002-6630-201605015 10.7506/spkx1002-6630-201605015.http://www.spkx.net.cn
作者简介:邹容(1964—),女,高级实验师,硕士,研究方向为食品质量与安全。E-mail:yfan4103@163.com
基金项目:重庆市教委科技项目(KJ1401101);重庆市科学技术基金项目(cstc2013jcyjA20019);
收稿日期:2015-05-05
