水体溶氧影响陆生植物喜旱莲子草(Alternantheraphiloxeroides)和牛鞭草(Hemarthriaaltissima)对完全水淹的耐受力
2016-04-14张小萍
杜 珲,张小萍,*,曾 波
1 三峡库区生态环境教育部重点实验室, 重庆 400715 2 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715 3 西南大学生命科学学院, 重庆 400715
水体溶氧影响陆生植物喜旱莲子草(Alternantheraphiloxeroides)和牛鞭草(Hemarthriaaltissima)对完全水淹的耐受力
杜 珲1,2,3,张小萍1,2,3,*,曾 波1,2,3
1 三峡库区生态环境教育部重点实验室, 重庆 400715 2 重庆市三峡库区植物生态与资源重点实验室, 重庆 400715 3 西南大学生命科学学院, 重庆 400715
溶氧是水环境中一个重要的环境因子,为了探讨水中的溶氧含量水平是否会对陆生植物的耐淹能力造成影响,研究了陆生植物喜旱莲子草(Alternantheraphiloxeroides)和牛鞭草(Hemarthriaaltissima)在遭受不同溶氧含量水体完全淹没后的生长表现、存活情况和非结构碳水化合物的变化。实验结果表明:(1)水体中的溶氧含量显著影响了处于完全水淹环境中的喜旱莲子草和牛鞭草的存活。受高溶氧水体完全水淹的喜旱莲子草和牛鞭草主茎的完好程度和存活叶的数量均显著高于遭受低溶氧水体完全水淹的喜旱莲子草和牛鞭草,喜旱莲子草和牛鞭草在高溶氧水体完全水淹后的生物量比低溶氧水体完全水淹后要高;(2)水体中的溶氧含量显著影响了处于完全水淹环境中的喜旱莲子草和牛鞭草的生长,受高溶氧水体完全水淹的喜旱莲子草主茎伸长生长和不定根生长显著强于受低溶氧水体完全水淹的喜旱莲子草,在不定根的生长上牛鞭草也具有同样的表现。(3)高溶氧水环境有利于减小被完全淹没的喜旱莲子草和牛鞭草的碳水化合物消耗,两种植物在受高溶氧完全水淹后体内具有的非结构性碳水化合物含量均比受低溶氧完全水淹后高。(4)喜旱莲子草比牛鞭草能更好地耐受完全水淹,当处于低溶氧完全水淹时表现得更为明显,本研究表明入侵物种喜旱莲子草比本地物种牛鞭草具有更强的环境适应能力和水淹耐受能力。
溶氧;陆生植物;喜旱莲子草;牛鞭草;完全水淹;耐淹能力
由于降雨、洪汛发生以及水库调度等原因,栖息于低洼地域、河湖和水库岸边地带的陆生植物常常会遭受水淹[1- 3]。因降雨、洪汛的强度不同或水位上升的幅度不同,陆生植物可能被部分淹没甚至是完全淹没。当陆生植物被完全淹没时,植物与空气隔绝而不能直接从空气中获得氧气。
氧气在水中的溶解度不高,因此,与空气相比,水中的氧气含量很低,比如在25℃氧饱和的水体中,氧的浓度也只有空气中氧浓度的1/33。另外,氧气在水中的扩散速率远低于其在空气中的扩散速率(氧气在空气中的扩散系数是0.201 cm2/s,在水中的扩散系数为2.1×10-5cm2/s)[4-5]。因此,在水体环境中,氧气常常会成为生物生长和存活的限制性因子[6-7]。对陆生植物而言,即使是氧饱和的水环境,与陆地环境相比其氧浓度也是很低的,氧气供应是严重不足的[8]。
水生植物(特别是沉水植物)因长期生活于水环境中,具有与水环境相适应的组织和结构:有细长且薄的叶片,茎和叶表皮角质层一般较薄或者甚至不存在,表皮细胞不发达,茎皮层的薄壁组织具有发达的细胞间隙[9]。这些组织特征会显著地降低水中的氧扩散进入植物组织内部的阻力,氧气可以通过扩散的方式进入水生植物体内,使水生植物比较容易地获得水环境中的氧[10-11]。由于淹没于水中的水生植物通过茎叶组织直接从水体中获得氧气是其获得氧气的非常重要的方式,因此,水体中氧含量高低对水生植物的生长和生存有明显的影响。陆生植物长期生存于陆地环境中,主要是通过气孔从空气中获得氧气。为了适应陆生环境,其茎和叶表面常具有蜡质,并且有发达的角质层和致密的表皮细胞层[9]。当陆生植物处于完全水淹环境中时,这些结构极大地增加了水中的氧通过茎和叶的表面扩散进入植物体内的困难[9]。那么,陆生植物是否能感受到水中溶氧的变化呢?水中的溶氧变化是否会影响其在水下的生存状态呢?到目前为止,水体中氧含量的高低对完全水淹的陆生植物的水淹耐受是否有影响目前还研究不多,知之甚少。
三峡水库是我国修建的规模最大的水库,也是世界上的大型水库。水库修建后,形成了水位落差最高达30 m的库岸消落区,水库蓄水时消落区被淹没,退水后消落区出露成为陆地[12]。为此,典型的水生植物(如沉水植物或只能在土壤积水的环境中才能很好生长的植物)难以适应三峡水库消落区环境并在此环境中生长,只有既能耐受三峡水库的蓄水水淹,同时又能在陆地环境中生长的陆生植物才能在三峡水库消落区长期栖居生长。
本研究,以在三峡水库消落区中生长的两种典型的陆生植物喜旱莲子草(Alternantheraphiloxeroides)和牛鞭草(Hemarthriaaltissima)(前者为双子叶植物,后者为单子叶植物)为研究对象,研究水体溶氧含量是否会影响完全水淹环境中陆生植物的水淹耐受。喜旱莲子草是在三峡库区有广泛分布的外来入侵植物[13],牛鞭草是生长于三峡库区的本地植物[14]。本研究不仅可以深化人们对陆生植物耐受完全水淹的认识,同时也有助于人们去剖析入侵植物的逆境适应能力与本地植物的差异。
1 实验方法
1.1 研究材料
在本研究中,我们以喜旱莲子草(Alternantheraphiloxeroides)和牛鞭草(Hemarthriaaltissima)为实验材料来研究水体溶氧对陆生植物耐受完全水淹的影响。喜旱莲子草为苋科、莲子草属植物,是多年生宿根草本植物,繁殖迅速,蔓延速度快。该物种已被列入国家环保总局2003年公布的“中国第一批外来入侵生物名单”[15]。
牛鞭草为禾本科牛鞭草属多年生草本植物,主要进行营养繁殖,也具有有性生殖能力。牛鞭草具有生长期长、生长速度快、再生能力强的特点,并且具有较强的适应性和抗逆性[16],有良好的水土保持作用,也是常见的饲用植物[17]。
1.2 研究方法
2013年6月在位于三峡库区重庆北碚段野外的自然环境中,分别在自然生长的喜旱莲子草和牛鞭草的克隆种群中选择健康、大小和长势一致的植株,剪取具有完整顶梢的主茎作为扦插苗(带有叶,各扦插苗的长度一致)。把获得的喜旱莲子草和牛鞭草扦插苗带回西南大学三峡库区生态环境教育部重点实验室实验基地,栽植于直径为17 cm的塑料花盆中,用混合均匀的黄壤和腐殖土(比例为1∶1)作为栽培用土进行种植。将所有植株置于实验基地内的旷地上培养,培养期间所有植株接受自然光照、定期浇水保证植株具有正常的水分供应,并定期进行除草、防止虫害等常规管理。为了确保植物在水淹前的生长状态一致,在植株培养期间,随时去除植株主茎上的侧芽使植株不发生分枝,保证用于实验的植株只有主茎而无分枝。
2013年8月随机选取培养的生长良好、健壮的喜旱莲子草和牛鞭草各45株,将每个物种的45株植株随机分成3组:15株用于高溶氧含量水淹处理,15株用于低溶氧含量水淹处理,15株用于无光未水淹对照处理。将接受高溶氧水淹处理的15株喜旱莲子草(即15盆)和15株牛鞭草(即15盆)放置于清洗干净的、池底无任何杂物和泥土的水池中,将接受低溶氧水淹处理的15株喜旱莲子草和15株牛鞭草放置于另一个相邻的清洗干净的、池底无任何杂物和泥土的水池中。水池为钢筋混凝土修建的水池。分别在两个水池中注入静置3 d后的自来水,使每个水池中的所有植株完全被淹没在水中,水淹深度为2 m,在整个实验处理期间使所有植株保持处于被完全淹没状态而不出露水面。为避免在水淹处理期间植株水下光合作用产生的碳水化合物对植株的水淹耐受表现产生干扰,同时也避免水下光合作用释放的氧气影响设定的水环境溶氧水平,在本实验中水池均保持黑暗无光状态,使所有接受高溶氧水淹和低溶氧水淹处理的植株处于黑暗环境中。黑暗环境是通过在水池上架设高2 m的钢架,采用黑色遮阴网覆盖的方式实现。为了能够很好地反映水体溶氧对完全淹没的陆生植物的水淹耐受是否有影响,在本实验中,设置了高溶氧水淹和低溶氧水淹,水体中的氧含量分别为(6.73±0.03) mg/L和(0.69±0.05) mg/L。水体高溶氧水平的维持通过使用通气管通入水池中曝气实现,水体低溶氧水平的维持则是通过在水池中通入预先制备的低溶氧自来水(溶氧含量约为0.03 mg/L)来调节实现。将15株(即15盆)未水淹对照处理放置于完全黑暗的实验室内,在实验期间定期浇水保证植株具有正常的水分供应,并定期进行除草、防止虫害等常规管理。
水淹处理时间是30 d,水淹期间使用HYDROLab多参数水质测定仪定期测定水池中水体的溶氧、水温、pH等指标。在整个实验处理期间,两种不同溶氧水平水淹处理的水环境中除了溶氧含量有差异外,水温、水体pH、水体浑浊度均没有显著差异(表1)。
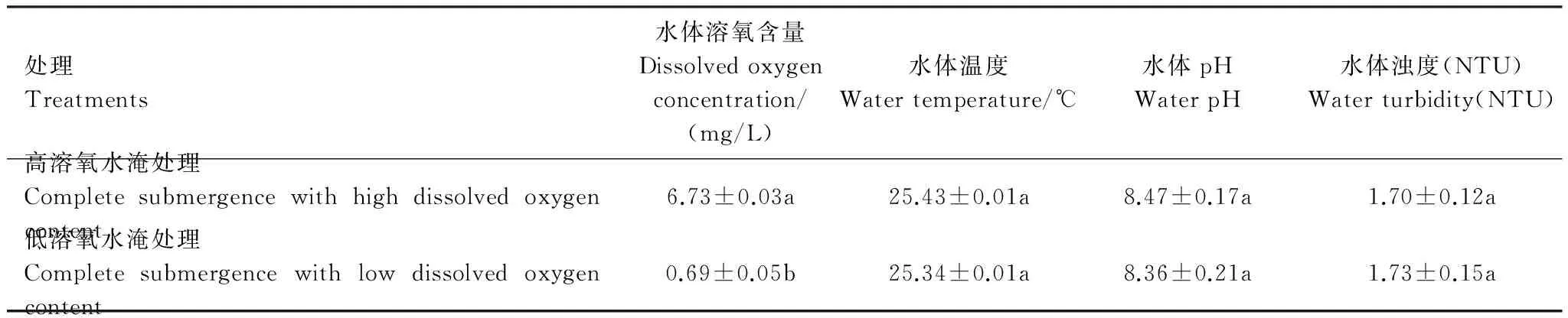
表1 两种不同溶氧含量完全水淹处理的水体环境条件
某环境条件在不同溶氧水淹处理之间不具有差异(P>0.05)或具有差异(P<0.05)分别用相同或不同的小写字母表示
1.3 指标测定
水淹处理开始前,测定喜旱莲子草和牛鞭草每株植株的主茎长、叶片数量。水淹处理结束后,记录喜旱莲子草和牛鞭草主茎完好无损的植株的株数,测定和统计喜旱莲子草和牛鞭草每株植株的存活主茎段长、存活叶的数量,主茎上产生的不定根的总长度。测定结束后,用自来水洗净植株存活主茎段、叶、以及地下部分,在60 ℃下烘72 h至恒重后,测定各部分的生物量。将烘干的植株主茎、叶和地下部分粉碎后,分别测定其非结构性碳水化合物的含量,通过计算得出整株的碳水化合物含量。非结构性碳水化合物含量的测定采用蒽酮硫酸法[18]。
1.4 数据分析
同一植物的不同溶氧含量水平水淹处理的影响采用单因素方差分析进行检测,如果方差不满足齐性则进行数据转换后再进行方差分析。
2 结果
2.1 具有完整主茎的植株比例
在完全淹没的水环境中,植物会表现出组织结构腐烂死亡的现象,腐烂的程度与植物的水淹耐受能力、水淹时间长短有一定关系。植物在因水淹而发生腐烂和死亡时,通常最先发生于幼嫩的组织和结构中,然后逐渐出现在成熟的组织和结构中。在本研究中发现,在经历高溶氧含量的完全水淹后,喜旱莲子草和牛鞭草两个物种植株的主茎都没有萎蔫、腐烂或死亡,具有完整主茎的植株的比例均为100%。而经历低溶氧含量的完全水淹后,喜旱莲子草和牛鞭草植株主茎的顶端都出现了不同程度的腐烂和死亡,低溶氧完全水淹后喜旱莲子草具有完整主茎的植株比例为33.34%,而牛鞭草所有的植株的主茎顶端都因死亡而受损,主茎完好无损的植株比例为0(表2)。
表2 不同溶氧含量完全水淹处理后具有完整主茎的喜旱莲子草和牛鞭草植株的比例
Table 2 The percentage ofA.philoxeroidesandH.altissimaplants with intact stems after being submerged completely in water with different dissolved oxygen contents

处理Treatments喜旱莲子草/%A.philoxeroides牛鞭草/%H.altissima高溶氧水淹处理Completesubmergencewithhighdissolvedoxygencontent100100低溶氧水淹处理Completesubmergencewithlowdissolvedoxygencontent33.340
2.2 水淹后植株的主茎存活长

图1 不同溶氧含量完全水淹处理前后喜旱莲子草和牛鞭草植株的主茎存活长度Fig.1 Living stem length of A. philoxeroides and H. altissima plants before and after complete submergence with different dissolved oxygen contents(Mean±SE)不同小写字母表示同一物种在不同类型水淹处理差异显著(P<0.05),图中数据为平均值±标准误(n=15)
实验结果表明,喜旱莲子草在高溶氧含量的完全水淹处理后,所有植株的主茎均完好无死亡现象,甚至在水淹期间植株的主茎还发生了显著的伸长,喜旱莲子草在高溶氧含量水淹处理后的主茎的长度显著的大于未水淹对照组处理(P<0.05)。在经历低溶氧含量完全水淹后,一部分喜旱莲子草植株的主茎顶端会因水淹而死亡(表2),导致水淹结束后植株的存活主茎段的长度显著的小于未水淹对照处理和高溶氧水淹处理(图1)。牛鞭草在经历高溶氧含量的完全水淹处理后,植株的主茎完好无死亡受损现象,没有伸长现象,水淹结束后牛鞭草植株的主茎长度显著的小于未水淹对照处理(P<0.05)。在低溶氧含量完全水淹处理中,牛鞭草植株的主茎发生明显的死亡,水淹结束后植株的存活主茎段长度显著的小于未水淹对照处理和高溶氧水淹处理(P<0.05)(图1)。
2.3 叶留存情况
在实验中发现,无论是在高溶氧含量还是在低溶氧含量的完全水淹处理下,经历完全水淹的喜旱莲子草和牛鞭草植株的叶均有掉落(图2)。经历低溶氧完全水淹的喜旱莲子草和牛鞭草植株在水淹结束后其具有的叶数量要显著的少于经历高溶氧完全水淹的植株(P<0.05),而且牛鞭草在经历低溶氧含量完全水淹后植株的叶全部掉落(图2)。在高溶氧含量完全水淹处理后,无论是喜旱莲子草和牛鞭草植株都还有一定数量的叶留存,存留的叶片数显著的少于未水淹对照处理(P<0.05)(图2)。
2.4 不定根发生
实验中发现,遭受水淹的喜旱莲子草具有强烈的产生不定根的能力,但是在不同溶氧含量的水环境中,喜旱莲子草的不定根的发生强度存在显著差异。在本实验中,受高溶氧含量完全水淹的喜旱莲子草的主茎上发生了大量的不定根,不定根的总长度显著的大于受低溶氧含量完全水淹的喜旱莲子草(P<0.05)。与喜旱莲子草相比,遭受水淹的牛鞭草产生的不定根则较少。受高溶氧含量完全水淹的牛鞭草主茎上产生了少量的不定根,而受低溶氧含量完全水淹的牛鞭草植株没有产生不定根(图3)。
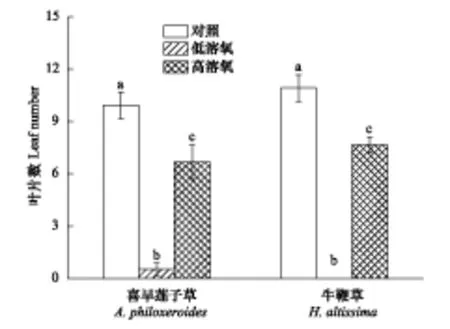
图2 不同溶氧含量完全水淹处理前后喜旱莲子草和牛鞭草具有的叶数量Fig.2 Living leaf number of A. philoxeroides and H. altissima before and after complete submergence with different dissolved oxygen contents(Mean±SE)
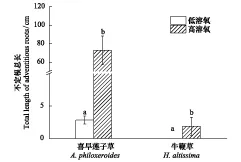
图3 不同溶氧含量完全水淹后喜旱莲子草和牛鞭草产生的不定根长度 Fig.3 Total length of adventitious roots produced in A. philoxeroides and H. altissima plants subjected to complete submergence with different dissolved oxygen contents(Mean±SE)
2.5 植株生物量
实验结果表明,喜旱莲子草经历低溶氧含量的完全水淹后,植株存活部分的生物量(不包括死亡腐烂部分和掉落叶)显著的低于未水淹的对照处理(P<0.05)。与未水淹对照相比,低溶氧含量水淹处理的喜旱莲子草的生物量降低了33%。在高溶氧含量水淹处理后喜旱莲子草的生物量和未水淹对照处理之间并没有显著的差异(P>0.05)。
与喜旱莲子草不同,低溶氧含量完全水淹对牛鞭草的胁迫和不利影响更为明显,牛鞭草经历低溶氧含量的完全水淹后,植株存活部分的生物量显著的低于未水淹的对照处理和高溶氧含量水淹处理(P<0.05)。与未水淹对照相比,低溶氧水淹处理的牛鞭草的生物量降低了59%(图4)。
2.6 非结构性碳水化合物含量
非结构性碳水化合物是植物主要的能量来源,在本研究中,对喜旱莲子草和牛鞭草在不同溶氧含量完全水淹后的全植株非结构性碳水化合物含量进行了检测。研究表明,经历高溶氧含量和经历低溶氧含量完全水淹后的喜旱莲子草植株的可溶性糖含量均显著的高于未水淹对照处理的喜旱莲子草植株(P<0.05)(图 5)。相比之下,经历低溶氧含量完全水淹后的牛鞭草植株的可溶性糖含量显著的小于未水淹对照处理和高溶氧含量水淹处理(P<0.05)。
牛鞭草在经受高溶氧含量完全水淹后植株体内的淀粉含量显著大于经受低溶氧含量完全水淹后的植株体内的淀粉含量(P<0.05),而喜旱莲子草体内的淀粉含量在不同溶氧水平处理下无显著差异(图6)。

图4 不同溶氧含量完全水淹处理后喜旱莲子草和牛鞭草植株的生物量Fig.4 The total plant biomass of A. philoxeroide and H. altissima subjected to complete submergence with different dissolved oxygen contents(Mean±SE)
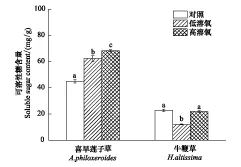
图5 不同溶氧含量完全水淹处理后喜旱莲子草和牛鞭草植株的可溶性糖含量Fig.5 Soluble sugar content of A. philoxeroides and H. altissima plant subjected to complete submergence with different dissolved oxygen contents(Mean±SE)(n=5)
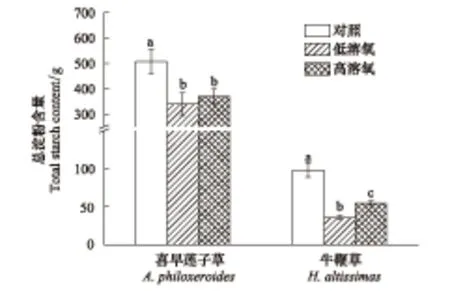
图6 不同溶氧含量完全水淹处理后喜旱莲子草和牛鞭草植株的总淀粉含量Fig.6 Total starch content of A. philoxeroides and H. altissima plant subjected to complete submergence with different dissolved oxygen contents(Mean±SE)
3 讨论
对众多的植物特别是陆生植物而言,水淹是一种严重的环境胁迫,对其生长和生存影响很大[4-6, 19-20]。由于氧气在水中的浓度低,扩散速率低,导致水体中的氧含量显著低于空气中的氧含量,而氧气含量的多少又决定着植物体采用的呼吸代谢方式[21],所以氧气常易成为影响处于水环境中的植物的生长和生存的限制因子[22]。经过长期的进化,水生植物的组织和结构(比如较薄的角质层,发达的通气组织)已经能很好地适应水下的低氧环境。而对陆生植物而言,由于其长期生长于氧气充足的陆生环境中,即使是在氧饱和的水环境中,对陆生植物来说,氧气供应都是不足的。并且陆生植物的茎和叶的结构特点又会增加水中氧气扩散到陆生植物体内的困难。那么,陆生植物是否能感受到水中溶氧的变化呢?在本研究中发现,不管是喜旱莲子草还是牛鞭草,在经历高溶氧含量水体水淹时,植株的主茎没有发生死亡,但在经历低溶氧含量完全水淹时,植株的主茎表现出不同程度的死亡。在本研究中还发现,与高溶氧含量水体相比,淹没于低溶氧含量水体中的喜旱莲子草和牛鞭草植株的叶死亡和掉落的程度更高。因此,本研究表明,水体中的溶氧含量显著地影响了陆生植物对完全水淹的耐受,水环境的溶氧含量的高低会显著地影响陆生植物在水下的生存状态,低溶氧含量水环境对受完全水淹的陆生植物的伤害更大。
在本研究中,遭受完全水淹的牛鞭草不管是在高溶氧还是在低溶氧含量水体中其主茎均没有表现出新的生长,仍然保持水淹前的状态。但是,淹没于低溶氧水体中的牛鞭草比淹没于高溶氧水体中的牛鞭草表现出更高程度的主茎茎段死亡和叶死亡,并且受低溶氧水体淹没的牛鞭草其体内的非结构性碳水化合物含量比受高溶氧水体淹没的牛鞭草体内的非结构性碳水化合物含量低。从此研究结果来看,具有发达的适应陆生环境的组织和结构的陆生植物在完全水淹环境中可能也具有一定的吸收水体中氧气的能力,从而其水淹耐受性会受到水体中溶氧的影响。在完全水淹时,尽管牛鞭草成熟的叶片和茎表面具有发达的角质层、较厚的表皮细胞层和蜡质,但在可能植株上的一些未成熟的叶表面还不具有这些发达的组织和结构,从而水体中的氧可扩散进入这些未成熟的叶而为植株所利用。另外,有研究表明一些植株在水淹时叶片表面会形成气膜,通过气膜增大淹没于水中的叶片与水体之间的气体界面,从而提高淹没于水中的叶片对水体中氧的吸收[23- 27]。有可能牛鞭草的成熟叶片以及茎在水淹时也具有气膜从而使水体中的氧含量多少对水淹环境中的牛鞭草会产生影响。与牛鞭草不同,在高溶氧含量水体中,被完全淹没的喜旱莲子草有显著的主茎和不定根的生长,这些在水淹环境产生的组织和结构与水淹前在陆生环境中产生的组织结构相比对氧的扩散阻力要小的多,因此,喜旱莲子草在受高溶氧完全水淹时表现出的良好的水淹耐受可能与其在水淹环境中新产生的组织结构可以很好地吸收水体中的氧有关,也可能与水淹前在陆生环境中产生的组织结构在水淹时具有气膜从而促进水环境中氧扩散进入植物体内有关。牛鞭草和喜旱莲子草的成熟叶及茎是否具有气膜以及气膜的分布和发达程度还有待进一步研究。
在研究中发现,与牛鞭草相比,喜旱莲子草表现出更强的对完全水淹的适应能力,这一方面体现在不管在高溶氧还是低溶氧水体中,喜旱莲子草都比牛鞭草具有更高的完整主茎比率和更强的新生组织结构的产生能力。在高溶氧含量和低溶氧含量的水体中,完全淹没的喜旱莲子草可以进行主茎、叶和不定根的生长(在高溶氧含量水体水淹中表现得更为明显)。研究发现不定根的形成是许多耐水淹植物对水淹的一种主要适应方式[28],不定根能够迅速取代因缺氧而窒息甚至死亡的初生根,保持根系的活力和功能[29]。然而,与喜旱莲子草相比,牛鞭草不管是在遭受高溶氧还是在低溶氧含量水体的完全水淹中,都没有表现出明显的新生组织的生长(只是在高溶氧含量水体的水淹中有少量的不定根的发生)。也就是说由于喜旱莲子草在水环境中有强烈的新生组织结构的产生能力,而在水中新产生组织和结构会更加接近水生植物的组织结构特点。所以在即使是处在相同溶氧浓度的水环境中,扩散进入喜旱莲子草体内的氧气浓度也会比牛鞭草更高。
另外,在遭受低溶氧含量完全水淹时,喜旱莲子草主茎受损的植株比例和主茎受损的长度均小于牛鞭草。并且与未水淹对照处理相比,低溶氧水淹处理后的喜旱莲子草总生物量降低了33%,而牛鞭草低溶氧处理水淹后的总生物量与未水淹对照组相比,下降了59%。也就是说喜旱莲子草在低溶氧含量完全水淹时的主茎和叶片死亡更慢,生物量损失更小。与牛鞭草相比,喜旱莲子草更能耐受水下低氧的不利环境,耐受水淹的能力很强,水淹后存活的可能性更大。喜旱莲子草和牛鞭草在完全水淹环境中的上述表现表明喜旱莲子草比牛鞭草具有更强的环境适应能力和水淹耐受力,在水淹逆境中,喜旱莲子草比牛鞭草具有更强的竞争力。
本研究表明,水体中的溶氧含量对陆生植物的水淹耐受会产生显著影响,水体具有高溶氧含量有利于受完全淹没的陆生植物抵御水淹环境,陆生植物在遭受完全水淹时的生长表现会影响其对水淹的耐受。本研究表明,不管是遭受高溶氧还是低溶氧含量的完全水淹,喜旱莲子草作为入侵植物均表现出比本地植物牛鞭草具有更强的水淹耐受能力。
[1] 施美芬, 曾波, 申建红, 类淑桐, 朱智, 刘建辉. 植物水淹适应与碳水化合物的相关性. 植物生态学报, 2010, 34(7): 855- 866.
[2] Nagai K, Hattori Y, Ashikari M. Stunt or elongate? Two opposite strategies by which rice adapts to floods. Journal of Plant Research, 2010, 123(3): 303- 309.
[3] 袁慎鸿, 曾波, 苏晓磊, 许建平. 水位节律差异对三峡水库消落区不同物候类型1年生植物物种构成的影响. 生态学报, 2014, 34(22): 6481- 6488.
[4] Bailey-Serres J, Voesenek L A C J. Flooding stress: acclimations and genetic diversity. Annual Review of Plant Biology, 2008, 59(1): 313- 339.
[5] Armstrong W, Drew M C. Root growth and metabolism under oxygen deficiency // Waisel Y, Eshel A, Kafkafi U, eds. Plant Roots: The Hidden Half. 3rd ed. New York & Basel: Marcel Dekker, 2002: 729- 761.
[6] Voesenek L A C J, Colmer T D, Pierik R, Millenaar F F, Peeters A J M. How plants cope with complete submergence. New Phytologist, 2006, 170(2): 213- 226.
[7] Vartapetian B B, Jackson M B. Plant Adaptations to Anaerobic Stress. Annals of Botany, 1997, 79(S1): 3- 20.
[8] Mommer L, Pedersen O, Visser E J W. Acclimation of a terrestrial plant to submergence facilitates gas exchange under water. Plant, Cell and Environment, 2004, 27(10): 1281- 1287.
[9] 陆时万, 徐祥生, 沈敏健. 植物学. 北京: 高等教育出版社, 1991.
[10] 成水平, 吴振斌, 夏宜琤. 水生植物的气体交换与输导代谢. 水生生物学报, 2003, 27(4): 413- 417.
[11] 廖容, 袁佳晨, 高素萍. 花叶细辛形态解剖结构对水生环境的生态适应性. 江苏农业科学, 2012, 40(5): 327- 329.
[12] Liao J X, Jiang M X, Li L F. Effects of simulated submergence on survival and recovery growth of three species in water fluctuation zone of the Three Gorges reservoir. Acta Ecologica Sinica, 2010, 30(4): 216- 220.
[13] 王强, 刘红, 袁兴中, 孙荣, 王建修. 三峡水库蓄水后澎溪河消落带植物群落格局及多样性. 重庆师范大学学报: 自然科学版, 2009, 26(4): 48- 54.
[14] 李兆佳, 熊高明, 邓龙强, 谢宗强, 樊大勇. 狗牙根与牛鞭草在三峡库区消落带水淹结束后的抗氧化酶活力. 生态学报, 2013, 33(11): 3362- 3369.
[15] 翁伯琦, 林嵩, 王义祥. 空心莲子草在我国的适应性及入侵机制. 生态学报, 2006, 26(7): 2373- 2381.
[16] 徐胜, 张新全, 吴彦奇, 干有民, 毛凯. 牛鞭草研究与应用概况. 中国草地, 2001, 23(4): 53- 58.
[17] 王海锋. 不同季节长期水淹对几种陆生植物的存活、生长和恢复生长的影响[D]. 重庆: 西南大学, 2008.
[18] 张志良, 瞿伟菁. 植物生理学实验指导. 3版. 北京: 高等教育出版社, 2003.
[19] Perata P, Armstrong W, Voesenek L A C J. Plants and flooding stress. New Phytologist, 2011, 190(2): 269- 273.
[20] Mommer L, Pons T L, Visser E J W. Photosynthetic consequences of phenotypic plasticity in response to submergence: rumex palustris as a case study. Journal of Experimental Botany, 2006, 57(2): 283- 290.
[21] Irfan M, Hayat S, Hayat Q, Afroz S, Ahmad A. Physiological and biochemical changes in plants under waterlogging. Protoplasma, 2010, 241(1/4): 3- 7.
[22] 王文泉, 张福锁. 高等植物厌氧适应的生理及分子机制. 植物生理学通讯, 2001, 37(1): 63- 70.
[23] Pedersen O, Rich S M, Colmer T D. Surviving floods: leaf gas films improve O2and CO2exchange, root aeration, and growth of completely submerged rice. The Plant Journal, 2009, 58(1): 147- 156.
[24] Winkel A, Colmer T D, Ismail A M, Pedersen O. Internal aeration of paddy field rice (Oryzasativa) during complete submergence-importance of light and floodwater O2. New Phytologist, 2013, 197(4): 1193- 1203.
[25] Verboven P, Pedersen O, Ho Q T, Nicolai B M, Colmer T D. The mechanism of improved aeration due to gas films on leaves of submerged rice. Plant, Cell & Environment, 2014, 37(10): 2433- 2452.
[26] Winkel A, Colmer T D, Pedersen O. Leaf gas films ofSpartinaanglicaenhance rhizome and root oxygen during tidal submergence. Plant, Cell & Environment, 2011, 34(12): 2083- 2092.
[27] Winkel A, Pedersen O, Ella E, Ismail A M, Colmer T D. Gas film retention and underwater photosynthesis during field submergence of four contrasting rice genotypes. Journal of Experimental Botany, 2014, 65(12): 3225- 3233.
[28] Iwanaga F, Yamamoto F. Effects of flooding depth on growth, morphology and photosynthesis inAlnusjaponicaspecies. New Forests, 2008, 35(1): 1- 4.
[29] Sauter M, Steffens B. Biogenesis of adventitious roots and their involvement in the adaptation to oxygen limitations // van Dongen J T, Licausi F, eds. Low-Oxygen Stress in Plants. Vienna: Springer, 2014: 299- 312.
Dissolved oxygen in water affects the tolerance of two terrestrial plants,AlternantheraphiloxeroidesandHemarthriaaltissima, to complete submergence
DU Hui1,2,3, ZHANG Xiaoping1,2,3,*, ZENG Bo1,2,3
1KeyLaboratoryofEco-environmentsinThreeGorgesReservoirRegion(MinistryofEducation),Chongqing400715,China2ChongqingKeyLaboratoryofPlantEcologyandResourcesResearchinThreeGorgesReservoirRegion,Chongqing400715,China3CollegeofLifeScience,SouthwestUniversity,Chongqing400715,China
Flooding is detrimental to terrestrial plants, usually reducing growth and survival rate. The negative impact of flooding on terrestrial plants is mainly attributed to the low oxygen content in water environment, which may result in energy crisis for terrestrial plants. Slow diffusion and relatively low solubility of oxygen in water lead to low oxygen content in water. Terrestrial plants live in the aerial environment with plenty of oxygen and have a suit of adaptations to such environment. To date, few studies have investigated whether the growth and survival of terrestrial plants, when completely submerged, are affected by the content of dissolved oxygen in water. In this study, usingAlternantheraphiloxeroidesandHemarthriaaltissimaas model organisms (an invasive and a native terrestrial plant species, respectively, in the Three Gorges reservoir area), we examined the growth, survival, and non-structural carbohydrates of these plants when subjected to complete submergence with high (6.73 mg/L) and low level of dissolved oxygen (0.69 mg/L) in water. The following results were found in this study: (1) The level of dissolved oxygen in water had a significant influence on the survival ofA.philoxeroidesandH.altissimasubjected to complete submergence. After the 30-day submergence treatment, the number of plants with undamaged stems, the number of surviving leaves, and the total plant biomass were higher inA.philoxeroidesandH.altissimasubmerged in water with high dissolved oxygen content than in plants submerged in water with low dissolved oxygen content. (2) The level of dissolved oxygen in water affected the growth of completely submergedA.philoxeroidesandH.altissima. Thus,A.philoxeroidessubmerged in water with high dissolved oxygen content showed pronounced stem elongation and adventitious roots formation compared to plants submerged in water with low dissolved oxygen content. Similarly,H.altissimaproduced more adventitious roots when submerged in water with high dissolved oxygen content. (3) High dissolved oxygen content in water reduced the carbohydrate consumption in completely submergedA.philoxeroidesandH.altissima. Plants from both species had higher content of non-structural carbohydrates when completely submerged for 30 days in water with high dissolved oxygen content than in water with low dissolved oxygen content. (4)A.philoxeroideswas more tolerant to complete submergence thanH.altissima, which was more apparent when the plants were submerged in water with high dissolved oxygen content. Our study showed that, compared to the native speciesH.altissima, the invasive speciesA.philoxeroidesis better adapted to unfavorable environmental conditions and exhibits higher submergence tolerance.
dissolved oxygen; terrestrial plants;Alternantheraphiloxeroides;Hemarthriaaltissima; complete submergence; submergence tolerance
国家自然科学基金资助项目(31400480,31370443,31070474);国务院三峡办三峡后续工作库区生态与生物多样性保护专项项目(5000002013BB5200001, 5000002013BB5200002)
2015- 10- 21;
2016- 05- 04
10.5846/stxb201510212125
*通讯作者Corresponding author.E-mail: zxpimmun@swu.edu.cn
杜珲,张小萍,曾波.水体溶氧影响陆生植物喜旱莲子草(Alternantheraphiloxeroides)和牛鞭草(Hemarthriaaltissima)对完全水淹的耐受力.生态学报,2016,36(23):7562- 7569.
Du H, Zhang X P, Zeng B.Dissolved oxygen in water affects the tolerance of two terrestrial plants,AlternantheraphiloxeroidesandHemarthriaaltissima, to complete submergence.Acta Ecologica Sinica,2016,36(23):7562- 7569.
