两种Fe3O4核壳式纳米粒子的制备及处理含Pb(Ⅱ)废水应用
2016-04-14诸慧刘路路刘旭朱伊娜李晔
诸慧,刘路路,刘旭,朱伊娜,李晔
(武汉理工大学资源与环境工程学院环境工程系,湖北武汉430070)
两种Fe3O4核壳式纳米粒子的制备及处理含Pb(Ⅱ)废水应用
诸慧,刘路路,刘旭,朱伊娜,李晔
(武汉理工大学资源与环境工程学院环境工程系,湖北武汉430070)
利用共沉淀法,经过表面修饰,分别包覆传统的和可生物降解的螯合剂得到多层核壳式结构的磁性纳米复合粒子-Fe3O4@SiO2@NH3@EDTA和Fe3O4@SiO2@NH3@NTA,并通过XRD衍射、红外光谱分析等手段对复合粒子进行表征。结果表明:成功制得了Fe3O4复合粒子,粒子粒径约为12nm。同时利用复合粒子为吸附剂处理重金属溶液,分别研究不同时间、pH值、重金属溶液初始浓度对吸附效果的影响,对两种粒子进行了综合评价。
磁性纳米复合粒子;可降解螯合剂;吸附重金属;综合评价
0 引言
水体的重金属污染是环境污染的一个突出问题,由于重金属在水中不能被生物降解,沉积在土壤与底泥后经食物链积累传递,对环境与生物造成不良影响。现有的用于治理超标重金属的技术方法尚存在各种各样的弊端。因此,研究新方法对水体中的重金属污染进行去除、回收利用成为一项迫在眉睫的工作。近年来,人们研究利用磁性纳米粒子易吸附分离的特点来解决重金属污染问题[1]。磁性复合材料一方面由于其分子层的可调控性可以实现功能多样化,另一方面作为磁性材料可在外加磁场下实现快速有效的分离。对磁性粒子进行表面修饰[2],引入活性反应基团以达到选择性吸附重金属的目的,反应完后选择适当解吸剂可多次回收利用,节约成本。目前广泛应用于包覆磁性纳米粒子的螯合剂属于氨基羧酸类螯合剂(Aminopolycar-Boxylate Chelating Agents,简称APCAs),其几乎能与所有金属离子形成稳定螯合物,适用范围广[3]。其中四乙酸二钠(EDTA)应用普遍,但生物降解性差,其形成的络合物降解性更差,若长期滞留会对环境造成危害,本身造成二次污染,已被欧盟列为禁用物质[4]。为替代传统的APCAs,环境友好型螯合剂逐渐受到青睐[4]。其中氨基三乙酸(NTA)是一种生物可降解的天然氨基羧酸类螯合剂,生物降解性很强,在河流中两周分解率可达82%~88%,细菌分解的最终产物为CO2和NH3[5],绿色环保。
本研究采用工艺成熟、操作简单的共沉淀法制备了Fe3O4,在其表面包覆二氧化硅层,进行氨基功能化,最后引入螯合剂,制备出三层核壳式结构复合粒子。研究吸附条件(重金属溶液初始浓度、吸附时间、pH值)对Fe3O4复合粒子吸附Pb(Ⅱ)效果的影响,并对两种不同类型的螯合剂吸附特性进行对比,做出综合评价分析,为Pb(Ⅱ)的去除研究以及工程实际应用提供一些参考。
1 试验部分
1.1 试剂与仪器
FeCl3·6H2O、氨水(25%)、氢氧化钠、正硅酸四乙酯(TEOS)、乙醇、硅酸钠、3-氨丙基三乙氧基硅烷(APTES)、Pb(NO3)2,国药集团化学试剂有限公司;FeCl2·4H2O、氨基三乙酸(NTA),阿拉丁化学试剂有限公司。以上试剂均为分析纯或化学纯。
D/MAX-RB型转靶X射线衍射仪,日本理学公司;IS-10型红外光谱仪,美国Nicolet公司。
1.2 三层核壳式Fe3O4复合粒子的制备
1.2.1 Fe3O4内核的制备
称取6.95g FeCl3·6H2O和3.83g FeCl2· 4H2O溶于50mL超纯水中,快速搅拌下加入20mL摩尔浓度为1.5mol/L的氢氧化钠水溶液,室温下搅拌3h。在外加磁场的辅助下收集反应得到的黑色产物,用超纯水和乙醇清洗6次,配置成无水乙醇的悬浮液保存[6]。
1.2.2 Fe3O4@SiO2材料的制备
取磁性Fe3O4纳米颗粒5.89g置于盐酸中,酸洗粒子,超声震荡20min,去除表面氧化物,分离出颗粒后再分散于120mL乙醇和40mL超纯水的混合溶液中,在超声环境中用硅酸钠预处理。
加入氨水(25%)3mL,再加TEOS,持续搅拌反应。反应结束后分离、清洗产物,室温真空干燥12h,得到干燥的Fe3O4@SiO2磁性颗粒。
1.2.3 Fe3O4磁性纳米粒子表面功能化
(1)磁性Fe3O4粉体表面羟基活化。取3.12g纳米Fe3O4粉体,加入50mL超纯水后超声分散10min,60℃水浴加热,机械搅拌,N2保护下反应,加入一定量的稀盐酸将pH调节到4,然后每隔0.5h测定一次pH,及时补加稀盐酸使反应体系的pH维持在4,直到pH值不再变化。
(2)APTES表面修饰。活化后的纳米颗粒加入6mL硅烷化试剂,N2保护,60℃水浴加热,机械搅拌反应,反应完毕后清洗至无油状悬浮物,80℃真空干燥,称重。
1.2.4 引入螯合剂
称取2.01g纳米磁性粒子加入到20mL超纯水中,超声分散10min,转入250mL三口烧瓶中,50~80℃之间搅拌1h,然后加入20gEDTA,在上述温度条件下搅拌2h,冷却洗涤后离心分离,真空干燥,研细得到复合粒子。把螯合剂换成NTA再重复上述步骤得到NTA包覆的纳米颗粒。
1.3 吸附试验
研究pH、重金属溶液初始浓度、吸附时间对吸附效果的影响。
配置一定浓度的Pb(NO3)2溶液,各取50mL于6个250mL锥形瓶中,每个锥形瓶加入0.2g纳米粒子,放置摇床恒温振荡,相应时间后取出。利用磁铁分离磁性颗粒,取上清液,进行吸光度分析,测定剩余金属离子浓度。pH变量依次为2、3、4、5、6、7;初始浓度变量依次为10、15、20、25、30、35mg/L;吸附时间变量依次为0.5、1、1.5、2、2.5、3h。
计算其去除率Q和吸附量L:

式中:C0、Ct、Ce分别为初始、吸附后和吸附平衡时的质量浓度;V为溶液体积;m为纳米粒子质量。
2 结果与讨论
2.1 XRD衍射图谱分析
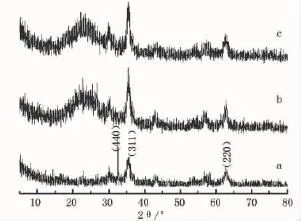
图1 Fe3O4、Fe3O4@SiO2、Fe3O4@SiO2@NH3纳米粒子XRD
通过与Fe3O4标准PDF卡片(PDF85-1436)对比,图1中a的(220)、(440)、(311)特征衍射峰与立方相Fe3O4标准衍射峰出锋位置吻合[7],锋型窄且尖锐,说明结晶完整,结晶度较好。根据Scherrer公式[8],计算Fe3O4晶体尺寸为12nm。包覆SiO2和修饰氨基后的XRD图谱(图1的b和c),仍呈现出Fe3O4特征峰,但可以看出在2θ=22°附近出现特征峰,证明已成功包覆SiO2[9]。对于图1c,修饰氨基后衍射峰向大角移动,但相应峰型没有变化。图2和图3分别为引入NTA和EDTA螯合后的图谱,产物衍射峰变得相对尖锐,强度相应增大[10]。

图2 Fe3O4@SiO2@NH3@NTA纳米粒子XRD

图3 Fe3O4@SiO2@NH3@EDTA纳米粒子XRD
2.2 红外测试结果分析
图4和图5为两种粒子红外光谱。图5中谱线为吸附金属前的Fe3O4/NTA复合粒子吸收谱,在1097cm-1处出现强吸收峰,是由于Si-O-Si的晶格振动和Si键伸缩振动形成[11]。1631cm-1处是NTA缔合态羧酸的C=O基的振动特征吸收峰[12]。红外分析证明了螯合基团在粒子表面的存在。图4谱线中1627cm-1为EDTA特征吸收峰,也证明了复合粒子成功制得Fe3O4/EDTA。图6和图7为吸附金属后红外光谱,比较图5和图7,Fe3O4/NTA在3433cm-1处吸收峰迁移到3439cm-1处,Fe3O4/EDTA在3395cm-1处吸收峰迁移到3424cm-1处,这是由于铅离子吸附在粒子表面所致[13]。

图4 Fe3O4@SiO2@NH3@EDTA纳米粒子红外光谱
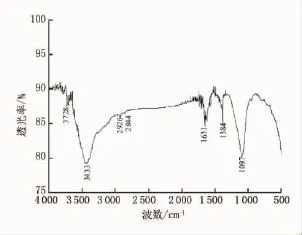
图5Fe3O4@SiO2@NH3@NTA纳米粒子红外光谱
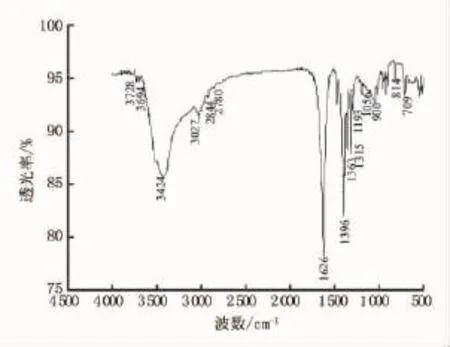
图6 吸附Pb(Ⅱ)后Fe3O4@SiO2@NH3@EDTA粒子红外光谱

图7 吸附Pb(Ⅱ)后Fe3O4@SiO2@NH3@NTA粒子红外光谱
2.3 吸附研究
2.3.1 pH对去除性能的影响[14-15]
在Pb(Ⅱ)质量浓度为20mg/L,粒子投加量为0.2g条件下,分别考察了pH为2~7时两种复合粒子对Pb(Ⅱ)吸附去除率的影响,结果见表1。R1为Fe3O4/NTA对Pb(Ⅱ)吸附去除率,R2为Fe3O4/ ETA对Pb(Ⅱ)吸附去除率。从表1可以看出,Fe3O4/EDTA整体去除率低于Fe3O4/NTA复合粒子。
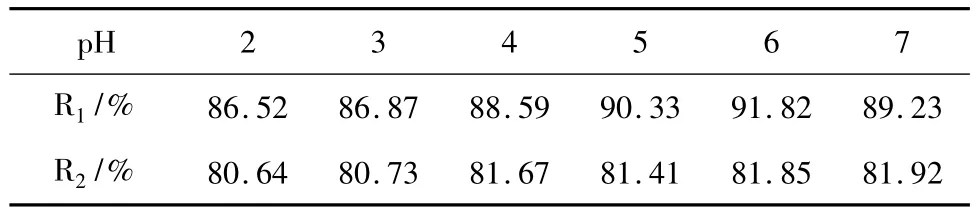
表1 不同pH时两种粒子对Pb(Ⅱ)去除率%
2.3.2 吸附时间对去除性能的影响
在Pb(Ⅱ)质量浓度为20mg/L,pH为4,溶液体积50ml,吸附时间分别为0.5~3h时,考察吸附时间对Pb(Ⅱ)去除的影响,结果如图8所示。
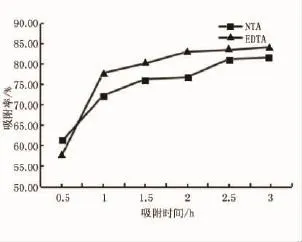
图8 吸附时间对PB(Ⅱ)去除性能的影响

图9 初始浓度对Pb(Ⅱ)去除性能的影响
从图8可以看出,对于Fe3O4/NTA,随着吸附时间增加,去除率缓慢上升,2.5h后吸附基本可达平衡,吸附效率较高,有利于投入具体生产应用。对于Fe3O4/EDTA,曲线变化趋势与Fe3O4/NTA基本一致,在2h左右达到平衡。
2.3.3 重金属溶液初始浓度对去除性能的影响
在pH为4,复合粒子投加量为0.2g,溶液体积为50mL,Pb(Ⅱ)质量浓度分别为10~35mg/L时,考察金属溶液浓度对去除效果的影响,结果如图9所示。对于Fe3O4/NTA,随着初始浓度增加,去除率上升,在初始浓度大于25mg/L去除率进入平缓期,略有下降,30mg/L以后有明显下降。对于Fe3O4/ EDTA,去除率刚开始随初始浓度上升迅速增加,25mg/L时达到最大去除率,初始浓度继续增大,去除率又迅速下降,变化明显。以上都说明复合粒子对金属的吸附存在一个饱和吸附值。
3 两种纳米复合材料的比较
3.1 纳米粒子吸附Pb(Ⅱ)的对比
配置不同初始浓度的Pb(Ⅱ)溶液,分别量取10组20mL放置在各个锥形瓶中,称取一定量制备的两种不同类型的纳米复合粒子加入锥形瓶,放置摇床恒温震荡,3h后将其取出,磁铁分离磁性颗粒,得到上清液进行测试。加入铅离子溶液浓度分别为1、4、10、20、40mg/L,测试两种复合粒子对Pb(Ⅱ)的去除率、饱和吸附量,结果见图10、图11。
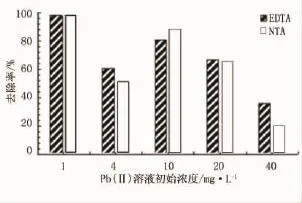
图10 两种粒子对Pb(Ⅱ)去除率对比
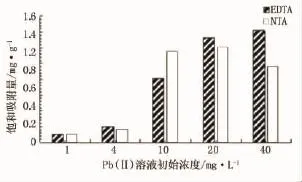
图11 两种粒子对Pb(Ⅱ)饱和吸附量对比
结合图10和图11可以看出,重金属溶液初始浓度很低时,两者的吸附率都很高,随着浓度的增加,Fe3O4/NTA的吸附率明显高于Fe3O4/EDTA,但此时两者的饱和吸附量都达到最大值。
重金属浓度比较高时两者吸附率都较低,Fe3O4/NTA的饱和吸附量在高浓度的Pb(Ⅱ)废水中明显降低,Fe3O4/EDTA的饱和吸附量始终随着浓度的增加而增加。可以推测,Fe3O4/EDTA适用于处理低浓度Pb(Ⅱ)废水,Fe3O4/NTA适用于处理中高浓度Pb(Ⅱ)废水。
3.2 经济成本分析
以饱和吸附量计算,Fe3O4/NTA为1.83mg/g,Fe3O4/EDTA为2.59mg/g,比较两种螯合剂吸附重金属的经济效益(见表2)。整体来说,NTA的处理成本比EDTA高,但是NTA的后续可生物降解性,使得其环保效益远高于EDTA。

表2 两种复合粒子经济成本比较
4 结论与展望
通过XRD衍射、红外光谱等的表征结果,证实制备了具有多层核壳式结构的Fe3O4/NTA和Fe3O4/EDTA磁性纳米复合粒子,晶粒粒径在12~20nm,具有良好的磁性。
Pb(Ⅱ)的初始质量浓度为20mg/L,复合粒子投加量为0.2g,pH<4.45时Pb(Ⅱ)的去除主要为吸附作用,pH>4.45时开始出现沉淀。吸附率刚开始随着pH的上升而增加,之后逐渐不变。
对于Fe3O4/NTA,随着Pb(Ⅱ)溶液初始质量浓度增加,去除率上升。对于Fe3O4/EDTA,去除率刚开始随初始浓度上升迅速增加,25mg/L达到最大去除率,初始浓度继续增大,去除率又迅速下降。
NTA吸附重金属的成本比EDTA略高,但是生物降解性好,对环境污染小。
[1]Zhang Y W,Xu L,Zhao L,et al.Radiation synthesis and Cr((VI) removal of cellulose microsphere adsorbent[J].Carbohydrate Polymers,2012,88(3):931-938.
[2]Tan Lisha,Sun Mingyang,Hu Yunjun,et al.Preparation of functionalized Fe3O4nanoparticles and removal of heavy metai in water[J].Progress in Chemistry,2013,25(12):2148-2155.
[3]Bucheli-Witschelm,Egli T.Environmental fate and microbial degra-dation of aminopolycarboxylic acids[J].FEMS Microbiology Reviews,2001(25):69-106.
[4]Nowack B,Van Briesen J M.Biogeochemistry of chelating agents[M].American Chemical Society:2005.
[5]Wang N,Zhu L,Wang D,et al.Sono-assisted preparation of highly-efficient peroxidase-like Fe3O4magnetic nanoparticles for catalytic removal of organic pollutants with H2O2[J].Ultrasonics Sonochemistry,2010,17(3):526-533.
[6]Wenger K,Kayser A,Gupta s k,et al.Comparison of NTA and elemental sulfur as potential soil amendmenta in phytoremediation[J].Soil and Sediment Contamination,2002,11(5):655-672.
[7]Knott M.Toxic tannery sludge made as safe as houses[J].New Scientist,1996,149(20):17-22.
[8]Andre's Guerrero-Marti'nez,Jorge Pe'rez-Juste,and Luis M.Liz-Marza'n.Recent Progress on Silica Coating of Nanoparticles and Related Nanomaterials[J].Adv Mater,2010(22):1182-1195.
[9]Liu H,Guo H,Li p,Wei Y,et al.The transformation of ferrihydrite in the presence of trace Fe(Ⅱ):The effect of the anionic media[J].Journal of Solid State Chemistry,2008,181(10):2666-2671.
[10]Fengwei Zhang,Zongzhen Zhu,Zhengping Dong,et al.Magnetically recoverable facile nanomaterials:Synthesis,characterization and application in remediation of heavy metals[J].Microchemical Journal,2011(98):328-333.
[11]Fei Ge,Meng-Meng Li,Hui Ye.Effective removal of heavy metal ions Cd2+,Zn2+,Pb2+,Cu2+from aqueous solution by polymermodified magnetic nanoparticles[J].Journal of Hazardous Materials,2012(211/212):366-372.
[12]Peng X,Xu F,Zhang W,et al.Chmielewská[J].Colloids Surf A,2014(443):27-36.
[13]Liu H,Guo H,Li P,Wei Y,et al.The transformation of ferrihydrite in the presence of trace Fe(Ⅱ):The effects of the anionic media[J].Journal of Solid State Chemistry,2008,181(10):2666-2671.
[14]Liu H,Wei Y,Li P,Zhang Y F,et al.Catalytic synthesis of nanosized hematite particles in solution[J].Materials Chemistry and Physics,2007,102(2):1-6.
[15]Liang Xuefeng,Xu Yingming,Tan Xin,et al.Heavy metal adsorbents mercapto and amino functionalized palygorskite,Preparation and characterization[J].Colloids and Surfaces A:Physicochem Eng Aspects,2013(426):98-105.
Preparation of two kinds multi-layer core-shell structure magnetic nanoparticle Fe3O4and application to process sewage with Pb(Ⅱ)
A new multi-layer core-shell structure magnetic nanoparticle Fe3O4@SiO2@NH3@EDTA and Fe3O4@SiO2@NH3@NTA,was synthesized by the coprecipitation method,surface modification and coating on traditional and degrable chelating agent respectively.They are characterized by X-ray structural analysis and infrared spectrum analysis.The XRD diffraction patterns and infrared spectrum show that these nanocomposites have good core-shelled structure as well as reactive function groups.Size of microcrystal range from 12~20nm.Meanwhile,it studied the adsorption effect by using composite particles as adsorbent to process solution of heavy mental and make a comprehensive evaluation of these two particles.It sets different initial concentration of heavy metal,pH,reaction time as variables.It makes a comparison of their adsorption properties.
magnetic nanoparticle composities;biodegrable chelating agent;biosorption of heavy mental;comprehensive evaluation
X703.1
B
1674-8069(2016)06-005-05
2016-08-20;
2016-09-13
诸慧(1995-),女,江苏南京人,本科,从事纳米材料吸附重金属废水研究。E-mail:zhuhuizh1995@163.com
武汉理工大学2015年自主创新项目(2015-ZH-B1-09)
