EDTA络合滴定法测定选铁尾矿中CaF2含量
2016-04-11杨春林陈潮炎
杨春林 陈潮炎
(1 北京矿冶研究总院,北京 102628; 2 金属矿产资源评价与分析检测北京市重点实验室,北京 102628)
EDTA络合滴定法测定选铁尾矿中CaF2含量
杨春林1,2陈潮炎1,2
(1 北京矿冶研究总院,北京 102628; 2 金属矿产资源评价与分析检测北京市重点实验室,北京 102628)
采用EDTA络合滴定法测定选铁尾矿中的氟化钙含量。选用稀乙酸浸取试样中的碳酸钙,分离过滤氟化钙,用锆-二甲酚橙褪色分光光度法测定浸取液中的氟含量,折算为在稀乙酸中微溶的氟化钙的量;同时沉淀部分用氯化铝溶液在沸水浴中溶解浸取氟化钙,以三乙醇胺掩蔽干扰离子,在KOH介质中,以钙指示剂为指示剂,用EDTA标准滴定溶液测定沉淀中氟化钙的量,两者之和为试样中氟化钙的含量。用此法对试样进行11次平行测定,相对标准偏差(RSD)小于1.0%。在选铁尾矿试样中加入萤石标准物质进行加标回收实验,加标回收率在99%~102%。方法流程短,操作简单。精密度和加标回收率均能满足要求。
氟化钙;EDTA;络合滴定法;选铁尾矿
0 前言
氟化钙(CaF2)又名萤石,具有广泛的工业用途。其产品常用于航天、冶金、电子、机械和原子能等多个领域。也是工业上氟的主要来源。是一种重要的战略储备资源[1]。我国萤石储备量巨大,是主要的生产和出口国之一[2]。伴随优质萤石矿产资源的日渐枯竭,从低频萤石矿或生产冶金辅料中精选氟化钙成为当今的主要趋势。本文从选铁尾矿中回收利用低品位氟化钙,探索低品位氟化钙的检测方法。在生产选矿中具有重要的指导意义。
1 实验部分
1.1 主要设备与试剂
722S型分光光度计(上海分析仪器总厂)。
乙酸溶液(1+9);盐酸(分析纯);盐酸(1+1);三氯化铝溶液(80 g/L,不含结晶水);氯化镁溶液(2 g/L);三乙醇胺(1+2);氢氧化钾溶液(200 g/L),储存于塑料瓶中;二甲酚橙溶液(2 g/L)。
钙试剂:称取0.2 g钙试剂(C21H13O7N2SNa),与20 g硫酸钾,在研钵中磨细、混匀,装入磨口瓶中保存。
锆-盐酸溶液:称取0.100 g碱式氯化锆于烧杯中,加入50 mL盐酸,用水移入1 000 mL容量瓶,稀释至刻度,混匀。
EDTA标准滴定溶液(0.010 mol/L):称取3.9 g乙二胺四乙酸二钠(C10H14N2O8Na2·2H2O,简称EDTA),于400 mL烧杯中,加入200 mL水,用氢氧化钾溶液调节pH值为5~5.5,溶解完全后转移至1 000 mL容量瓶中,以水定容并摇匀。
钙标准溶液(0.010 mol/L)标定:称取1.000 8 g碳酸钙(基准试剂,预先在105~110 ℃干燥2 h,并在干燥器中冷却至室温)于250 mL烧杯中,盖上表面皿,缓慢加入25 mL盐酸(1+1),待碳酸钙溶解后,加100 mL水,微热驱尽二氧化碳,冷却至室温。将溶液移入1 000 mL容量瓶中,用水稀释至刻度,混匀。此溶液相当于含氟化钙0.780 8 mg/mL。
氟标准溶液(10.0 μg/mL):移取2.00 mL浓度为500 μg/mL的氟标准储备溶液(购于国家标准物质中心)至100 mL塑料容量瓶中,以水定容,摇匀。
萤石标准物质BH0121-5W(ω(CaF2)=98.30%),萤石标准物质BH0121-2W(ω(CaF2)=78.33%)
实验室所用试剂除特殊说明外均为分析纯;实验室用水为二次去离子水。
1.2 实验方法
1.2.1 方法选择
测定选铁尾矿中的氟化钙采用国家标准方法[3]结果偏高,主要原因为混酸(硼酸+硫酸+盐酸)把试样中的可溶性硅酸钙溶解下来,当成氟化钙进行滴定,经实验先采用稀乙酸浸取试样中的碳酸钙,分离过滤氟化钙,AlCl3溶液浸取沉淀,置换出氟化钙中的钙,再用EDTA进行络合滴定。此法可以避免可溶性硅酸钙中钙的溶解。此法适用于10%以上的氟化钙的测定[4]。
其反应式如下:
6CaF2+2AlCl3Ca3(AlF6)2+3CaCl2
Ca3(AlF6)2+6AlCl34(AlCl3·AlF3)+3CaCl2
Ca2++H2Y2-CaY2-+2H+
1.2.2 试样的处理
称取0.25 g样品(精确至0.000 1 g)于100 mL烧杯中,加10 mL乙酸溶液(1+9),盖上表面皿,室温放置30~40 min,用11 cm慢速滤纸过滤于100 mL容量瓶A中,以水洗杯壁及滤纸各3~5次,定容混匀。采用分光光度法测定滤液中F含量换算为CaF2含量[5]。将沉淀连同滤纸移入原烧杯中。加入20 mL三氯化铝溶液(80 g/L,不含结晶水),用玻璃棒打开滤纸,将滤纸捣碎,盖上表皿,在电热板上加热煮沸5~10 min,再放入沸水浴加热2 h,不定时摇动,并补加水,以保持溶液体积为20 mL。将溶液用12.5 cm快速滤纸过滤于250 mL的容量瓶B中,以水洗杯壁及滤纸各3~5次,常温后定容,摇匀备用。采用EDTA络合滴定法测定沉淀中的CaF2。
1.2.3 校准曲线
CaF2在稀乙酸中略能溶解,其溶解量与其浓度、体积有关,因此测定条件应该严格控制。经分析10个不同含量梯度的试样,平均约有0.2%~0.5%的CaF2被溶解,因此需加以矫正。本文实验采用锆-二甲酚橙褪色分光光度法测定氟量进行换算矫正。
于一组50 mL容量瓶中,各加入10.00 mL锆-盐酸溶液(方法中每次使用的锆-盐酸溶液必须取自同一试剂瓶中),分别加入0.00、1.00、2.00、3.00、4.00、5.00 mL氟标准溶液,加2.0 mL二甲酚橙溶液,以水稀释至刻度,混匀,放置10 min。另取一50 mL容量瓶,加入10 mL盐酸,2.0 mL二甲酚橙溶液,以水稀释至刻度,混匀。以此溶液为参比,将显色液和参比液移入1 cm吸收皿,于分光光度计550 nm处测量吸光度。以吸光度(A)作纵坐标,氟量(ρF)为横坐标,绘制校准曲线。从校准曲线上查取显色液中的氟量。显色液中由于氟与锆生成稳定的络合物,使锆-二甲酚橙的色泽减褪。又由于氟与锆生成逐级络合物,氟量与吸光度的校准曲线呈下降稍弯状曲线。回归方程为A=-0.013ρF+1.521 9,R2=0.999 6。氟的量在0.04~1.33μg/mL范围内具有较好的线性关系。
1.2.4 试样的测定
于50 mL容量瓶中加入5.00 mL容量瓶A中的滤液,依次加入10 mL锆-盐酸溶液,2 mL二甲酚橙溶液,以水稀释至刻度,混匀,静置10 min待用。于另一50 mL容量瓶中加0.5 mL乙酸,加10 mL盐酸,2.0 mL二甲酚橙溶液,以水稀释至刻度,混匀。以此溶液为参比。将显色液和参比液移入1 cm吸收皿中,在波长550 nm处,用分光光度计测量其吸光度。根据校准曲线,计算得到氟量,折算成CaF2的量。随同实验做空白实验。
用50 mL大肚移液管分取50 mL容量瓶B中的滤液于300 mL锥形瓶中(根据样品中氟化钙的含量调整分取量),用洗瓶冲洗锥形瓶口,使体积不超过100 mL。加4 mL氯化镁溶液(2 g/L),加5 mL三乙醇胺(1+2),加约0.08~0.10 g钙指示剂。加入氢氧化钾溶液(200 g/L)使溶液呈酒红色再过量3~5 mL。用EDTA标准溶液滴定,蓝色为终点。
式中
F——EDTA标准滴定溶液对CaF2的滴定系数,g/mL;V——滴定分取溶液所用EDTA标准溶液体积,mL;V0——滴定分取随同试样空白溶液所消耗EDTA标准滴定溶液的体积,mL;
m——分取滴定试液中所含试样量,g;
r——除碳酸钙的滤液中微溶的CaF2的量,%。
2 结果与讨论
2.1 浸取酸度实验
选取两个选铁尾矿样品Yp-3、Yp-4和萤石标准物质BH0121-5W,考察了乙酸(1+9)加入量对CaF2含量测定的影响,结果见表1。由表1可知,当乙酸加入量少时,测定标准值偏低。加入较多时,测定标准值偏高,加入10 mL时,测定值与标准给定值对照较好。故选择加入10 mL乙酸(1+9)进行实验。

表1 乙酸用量实验Table 1 Tests of acetic acid amount /%
2.2 AlCl3浓度实验
实验考察了AlCl3的浓度对CaF2测定结果的影响,见表2。由表2可知,加入20 mL不同浓度的AlCl3溶液,当用40 g/L的AlCl3溶液时,测定标准萤石样品结果偏低,当用80 g/L的AlCl3溶液时测定结果稳定,与标准值吻合。故实验采用AlCl3的浓度为80 g/L(不含结晶水)。
2.3 AlCl3用量实验
实验考察了AlCl3(80 g/L)的用量对CaF2测定结果的影响,见表3。由表3可见,当用10 mL溶液时,测定标准萤石样品结果明显偏低,当用20 mL溶液时测定结果稳定,与标准值吻合。故实验采用加入20 mL AlCl3(80 g/L)。
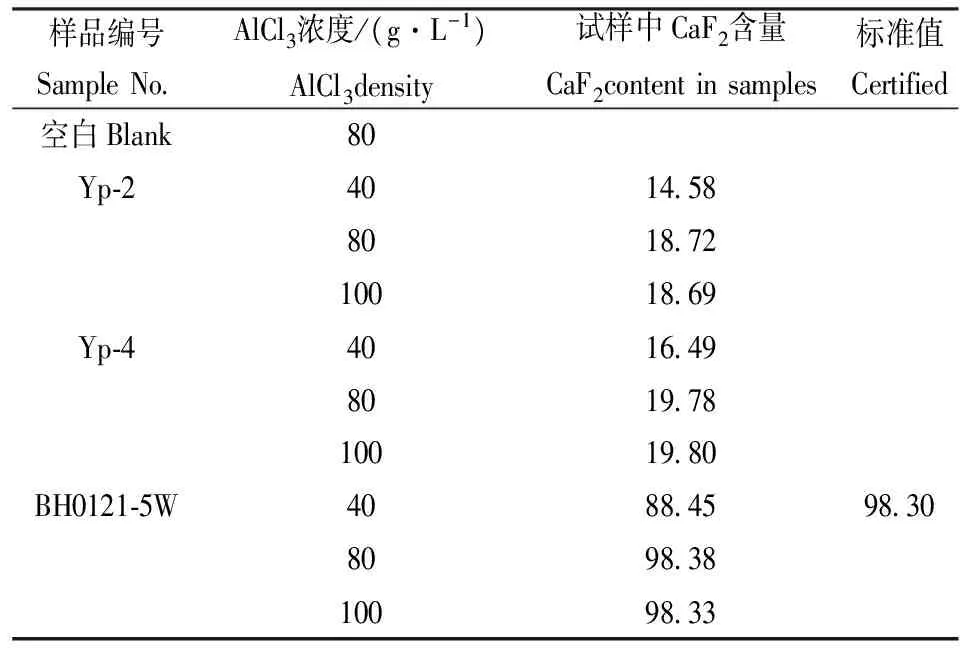
表2 AlCl3浓度实验Table 2 Tests of AlCl3 concentrations /%
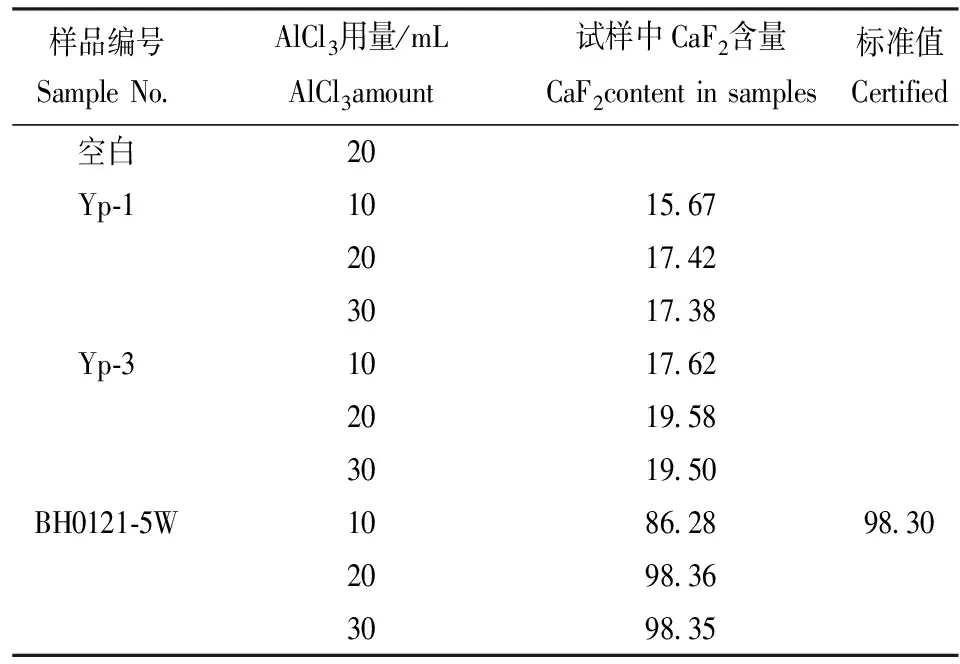
表3 AlCl3用量实验Table 3 Tests of AlCl3 amount /%
2.4 AlCl3浸取时间
实验考察了AlCl3浸取时间对CaF2测定结果的影响,见表4。由表4可见,当用浸取时间为1 h时,测定标准萤石样品结果明显偏低,当用2 h时测定结果稳定,与标准值吻合。故实验采用加入20 mL AlCl3(80 g/L)在沸水浴中浸取2 h。

表4 AlCl3浸取时间Table 4 Tests of AlCl3 leaching time /%
2.5 指示剂对比
分别选取钙指示剂和钙黄绿素混合指示剂,按照选定的方法对试样Yp-2、Yp-3及标准物质BH0121-5W的CaF2含量进行测定。结果表明,使用钙黄绿素混合指示剂终点的绿色荧光消失瞬间较难观察到,即使在黑色背景下观察,往往荧光消失后已经滴定过量较多(以标准物质为例)。须依靠经验同时需与标准样品终点颜色对照着观察,受环境采光度和人员经验影响较大。而钙指示剂终点变化清晰敏锐,故实验选用钙指示剂。
2.6 共存离子干扰实验
选铁尾矿中主要成分为铁,含量约为10%,SiO2含量约为40%,CaO含量约为30%,还有约4%的Al2O3,采用稀乙酸浸取选铁尾矿样品时,稀乙酸只能浸取CaCO3、CaO,而SiO2和Al2O3、Fe2O3则留在沉淀中。同时用AlCl3做浸取液浸取沉淀时,AlCl3不与SiO2、Fe2O3反应,因此不干扰测定。
因此,可能存在干扰的是乙酸浸取液中的Ca2+对测定F的干扰。取4份5.00 mL Yp-1乙酸浸取液于50 mL容量瓶中,分别加入4.00、8.00、10.00、12.00 mL Ca2+(1.00 mg/mL)的标准溶液(12.00 mL Ca2+标准溶液相当于试样中含有48%的Ca2+)进行测定,结果表明:4份溶液的吸光度保持不变。选铁尾矿中的CaO含量小于40%,由实验可知乙酸浸取液中的Ca2+未对F的测定造成干扰。
2.7 加标回收实验
选定3个试样进行加标回收实验。每个样品分别称取两份,每份0.100 0 g。在其中1份中加入0.020 0 g萤石标准物质BH0121-5W,另一份加入0.040 0 g萤石标准物质BH0121-2W,按照选定的实验方法进行加标回收实验,其中测定值为0.100 0 g试样测得的CaF2总量,加标量为相应称样量下的标准萤石物质中CaF2含量,测得总量为试样和萤石标准样品混合后测得的CaF2总量[6],结果见表5。

表5 CaF2的回收率实验Table 5 Recovery tests of the method /mg
2.8 精密度实验
选取四个选铁尾矿产品,按照选定的实验方法对试样中的CaF2成分分别进行11次平行测定。得到11个测定值,计算其平均值及标准偏差,结果见表6。相对标准偏差为0.36%~0.68%。
2.9 标准样品分析
选用滴定法对标准样品进行测试得到结果见表7。结果与认定值基本一致。
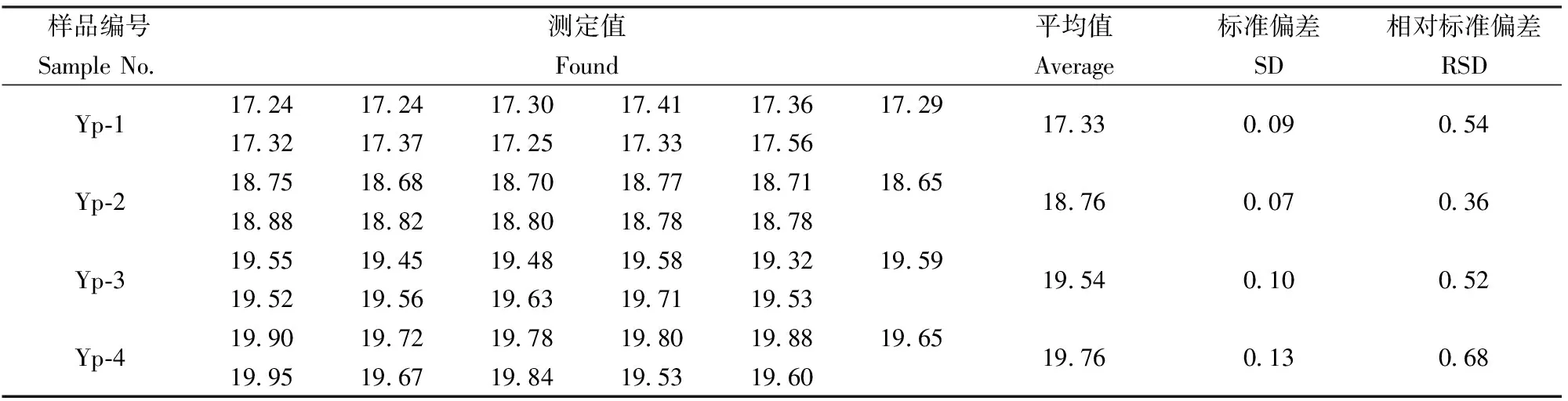
表6 方法精密度实验结果Table 6 Precision tests of the method (n=11) /%

表7 测定CaF2标准样品Table 7 Analytical results of CaF2 in calcium fluoride standard samples /%
3 结语
在实际测试工作中,用本方法测试的某国家项目的原矿产品结果与印度测试单位的测定结果对接很好。因此应用本法可以满足高低各种品位的CaF2含量的测试需求,准确度和精密度都能达到要求,适用于选矿中使用。
[1] 邹灏,张寿庭,方乙,等.中国萤石矿的研究现状及展望[J].国土资源科技管理(ScientificandTechnologicalManagementofLandandResources),2012,29(5):35-42.[2] 罗朝艳,吴伯增,陈建华.湖南某低品位萤石矿浮选工艺研究[J].矿产保护与利用(ConservationandUtilizationofMineralResources),2013,1(1):39-42.
[3] 中国国家标准化管理委员会.GB/T 5195.1—2006 萤石 氟化钙含量的测定[S].北京:中国标准出版社,2010.
[4] 北京矿冶研究总院分析室编.矿石及有色金属分析手册[M].北京:冶金工业出版社,2004:265-269.
[5] 中国国家标准化管理委员会.GB/T 5195.2—2006 萤石 氟化钙含量的测定[S].北京:中国标准出版社,2010.
[6] 年季强,张良芬,朱春要,等.EDTA络合滴定法测定钢渣面脱氧剂中氧化钙和氟化钙[J].冶金分析(MetallurgicalAnalysis),2014,34(6):20-27.
Determination of Calcium Fluoride in Iron Tailingsby EDTA Complexometry
YANG Chunlin1,2, CHEN Chaoyan1,2
(1.BeijingGeneralResearchInstituteofMiningandMetallurgy,Beijing102628,China;2.BeijingKeyLaboratoryforEvaluationandTestingofMetallicMineralResources,Beijing102628,China)
EDTA complexometry was used for the determination of calcium fluoride (CaF2) contents in iron tailings. The samples were pretreated by dilute acetic acid to leach calcium carbonate. The contents of CaF2consist of two parts. On one hand, fluoride contents were determined by zirconium-xylenol orange fading spectrophotometry after CaF2was filtrated. According to these values, the concentrations of CaF2were obtained. On the other hand, CaF2of the precipitation was leaching by aluminium chloride solution in a boiling water bath. Choosing calcium indicator as an indicator, EDTA standard titration solution was used to determine the amount of precipitation of CaF2in KOH medium. Therefore, the final CaF2contents were calculated by the above-mentioned two values. The relative standard deviation (RSD,n=11) was less than 1.0% with the recovery of 99%~102%. The proposed method is simple, rapid, and the precision and recovery can meet the requirements of the determination of CaF2in iron tailings samples.
calcium fluoride; EDTA; complexometry; iron tailings
2015-11-04
2016-02-23
北京市科技创新基地培育与发展专项(Z151100001615044)资助
杨春林,女,工程师,主要从事地矿和冶金样品的无机元素分析研究。E-mail:greensky085@sina.com
10.3969/j.issn.2095-1035.2016.02.006
O655.2
A
2095-1035(2016)02-0020-05
