实验动物国家标准中大小鼠微生物检测项目的考量
2016-04-09向志光张丽芳
向志光,佟 巍,张丽芳,孔 琪,魏 强
(中国医学科学院医学实验动物研究所,北京 100021)
实验动物国家标准中大小鼠微生物检测项目的考量
向志光,佟巍,张丽芳,孔琪,魏强
(中国医学科学院医学实验动物研究所,北京100021)
【摘要】本文对我国现行实验动物微生物国家标准中小鼠和大鼠涉及的微生物进行了回顾性分析,考量病原微生物的感染谱,病原对实验动物自身的危害,病原对科学研究的影响水平以及国内外病原微生物的流行情况,以期为我国实验动物国家标准的修订提供一些参考。
【关键词】实验动物国家标准, SPF
1我国实验动物国家标准设立的背景与意义
生命科学研究中使用的实验动物是人类疾病研究的替难者。为得到可靠的实验数据,实验动物自身的质量需要得到有效的控制。因此,实验动物的质量保障研究一直是实验动物科学的研究重点。
国外实验动物学科发展较早,其实验动物产业较早开始市场化发展,市场竞争机制促使企业提高实验动物产品质量。为了提高自身实验动物的质量,各企业均制定了各自企业的实验动物质量控制标准。国外并没有一个国家针对实验动物制定国家标准。但是一些实验动物的社会组织,比如美国的实验动物学会、欧洲的FELASA组织,他们对实验动物的质量控制提出了建议或指南[1],对实验动物繁育和使用机构的实验动物的使用具有一定的指导意义。
我国的实验动物学科和实验动物产业起步较晚。在我国实验动物行业发展的早期,实验动物自身的质量,特别是微生物质量没有保障,这一状况严重的阻碍了我国实验动物行业的健康发展,也使得实验动物科学对整个生命科学研究的支撑作用打了折扣。为了提高实验动物本身的质量,我国在1994年以国家标准的形式为实验动物的生产和使用单位提出了实验动物质量控制的要求。在过去的20多年间,我国的实验动物国家标准的制定与实施,无疑为我国实验动物质量提高起到积极促进作用,同时也使得我国的实验动物的质量保障研究得到长足发展。
实验动物的质量标准在国家标准层面上不应该是一成不变的。随着实验动物科学的发展,我国的实验动物国家标准也经历了多次修订。我国实验动物国家标准的变化也反映了我国实验动物科学与产业的进步。应该明确的是,我国的实验动物国家标准从其起草制定开始,其目的就是为了提高我国实验动物的质量,更好的为我国的生命科学研究服务。国家标准一方面可以对实验动物生产机构的产品提出质量要求,包括实验动物的稳定性以及安全性,保障使用者的利益;同时我国的实验动物国家标准也是指导实验动物生产和使用机构科学使用和管理实验动物的规范性指南。
2实验动物国家标准中动物微生物携带状态的等级划分
目前,我国的实验动物国家标准在微生物和寄生虫的控制方面将动物进行了分级。目前的国家标准分为普通级、清洁级、无特定病原体级以及无菌级。对于无菌动物的定义比较好理解,在这种动物体内和体外不应存在任何微生物和寄生虫。但是对于其他3个级别的定义在现行的国家标准中仍有待商榷。
按照现行的国家标准,普通级实验动物区别于野生动物的地方在于排除了人兽共患病原体和动物烈性传染性病原体。而清洁级增加排除对动物危害大的病原体和对科学研究干扰大的病原体。在这两个等级中人兽共患病原体必须排除,应该说所有应用于科学研究的动物都需要对人兽共患病原体加以控制。随后的两个概念动物烈性传染性病原体和对动物危害大的病原体,这两个概念如何理解,涉及的病原体如何区分?现行的国家标准中大鼠和小鼠不包括普通级动物,而对于犬和猴又没有清洁级动物这个类别,同时使用四个级别的动物包括了豚鼠、地鼠和兔。对于一些对动物危害大的病原体,在哪类科学研究中可以作为实验材料的实验动物携带呢?而对科学研究干扰大的病原体,这个概念出现在了清洁级动物和SPF级动物的排除范围,这些概念该如何界定?
这里需要界定两个概念。第一,病原体对动物的危害。动物的烈性传染病对动物的危害可想而知,不仅对动物个体本身存在影响,更是对动物群体产生影响。所有的实验动物均应排除,而其他的病原体,作为微生物和寄生虫,都是感染性的,只是烈性程度可能在一定条件下存在差异。但是对于实验动物的影响会存在差异,有些病原体的感染虽不会引起动物的大量死亡,但会对动物的基本生命体征产生影响,这些病原体在应用于科学研究的实验动物中也需要排除。在一定的历史阶段,由于我国的实验动物学科和产业发展的水平的限制,我们可能无法要求排除这些病原体,但是随着科学的进步,所有对科学研究产生影响的病原体均应该得到有效控制。第二个概念是对科学实验动物干扰。在排除了对大部分科学研究都有危害的病原体后,剩余的干扰动物实验的病原体就有了危害程度上和危害倾向性上的差异。某些病原体对于动物的影响是有组织、器官或是系统倾向性的,因此在研究这些系统的生命现象时,这类病原就需要排除;而有些病原体,仅仅对某些品系的动物有影响,比如免疫缺陷的动物,或是基因修饰的动物,某些病原在其他品系动物呈现潜伏感染不致病的,在这些动物中就成为了致病因素。因此这些病原在特殊条件下就需要排除。
这里就有了另外一个概念,排除特定病原体的动物(SPF)。实际上目前国家标准中的普通级动物和清洁级动物也是排除了特定微生物的动物,也可以成为SPF动物,只是特定微生物的选择有一定局限性。而目前国家标准中的SPF级动物选择排除的病原体项目也仅仅是增加了几个检测项目。在排除病原体项目的选择上目前我们的国家标准是单一的,但是随着科学的发展,这种单一标准似乎存在一些问题:列入国家标准的一些病原对某类实验干扰不大,排除这些病原无疑增加了生产和使用成本;更多的是,我们有些研究需要排除一些病原,但是这些病原体又没有列入我们的国家标准中。因此对于SPF的定义在国家标准中不应该是特定的,应该给予使用者一定的选择性。这种选择的标准可以有两个,一个是动物品系的要求,例如对于免疫缺陷动物,需要排除更多的条件致病微生物;第二个是使用的需求,对于不同的实验目的,有选择的排除病原项目。因此,对于SPF的定义,我们的国家标准应该给出选择性的指导意见。
对于我们的国家标准,业界存在两种声音,一种认为我们的国家标准应该仅仅设定那些严重干扰动物实验的病原,或者是降低标准;另一种认为我们国家标准的病原覆盖范围还不完善,应该增加国外普查的病原,或者可以认为是提高标准。实际上这两种意见可以统一起来。对于人兽共患病原体、对动物危害严重的病原体、对大多数实验有严重干扰的病原体,所有应用于科学研究的实验动物中必须排除。排除上述3类病原体的出发点在于保障从业人员的自身健康;保证实验动物的健康,防止疫病,维护实验动物福利;为了科学研究的准确性,提供实验动物质量。排除这类病原体应该是实验动物质量的最低要求,因此作为国家标准,应该是强制执行的标准。对于特殊品系的动物,以及有特殊应用的动物,应该单独制定排除病原范围,这类动物不应该再执行单一的标准,SPF动物的定义应该多元化。
3我国国家标准排除病原项目与国际实验动物机构排除项目的区别
国外并没有对实验动物的质量以国家标准的形式进行约束。国外不同的实验动物生产机构各自执行企业标准,以实验动物自身的质量应对市场竞争。近年来,我国的实验动物产业得到较好的发展,北京、上海、广东等地有一些实验动物生产机构形成了较大规模,各企业自身也制定了企业标准,也以实验动物自身的质量参与市场竞争。但目前我国的实验动物行业的大环境仍存在诸多问题,仍需要行政部门的监管。我国的实验动物国家标准与国际组织的推荐性的标准以及企业标准有什么不同呢?
目前国际上重要的实验动物生产机构Charles River公司对小鼠可排除20种病毒、15种细菌,大鼠可排除14种病毒、16种细菌。Taconic公司啮齿动物可排除21种细菌、23种病毒及16种寄生虫。而Jackson Laboratory小鼠排除的病原涵盖18种病毒、16种细菌和8种寄生虫。这些病原检测项目表明了生产企业的技术能力,是企业核心竞争力的体现。
一些国外企业检测的病原体如奇异变形杆菌(Proteusspp),产酸克雷伯杆菌(Klebsiellaoxytoca),牛棒状杆菌(Corynebacteriumbovis),CAR杆菌(Cilia-associated respiratory bacillus),肝螺杆菌(Helicobacterhepaticus),胆螺杆菌(Helicobacterbilis);病毒如小鼠轮状病毒(mouse rotavirus), K病毒(K virus),小鼠巨细胞病毒(mouse cytomegalovirus),小鼠胸腺病毒(mouse thymic virus ),小鼠诺如病毒(murine norovirus),小鼠微小病毒(mouse parvovirus)等,我国现行国家标准中并没有涉及,但列入这些企业标准中的病原并非必须排除。某些病原体对于动物的影响目前仍未确认。以小鼠诺如病毒MNV为例,MNV被这些机构列入了检测项目, MNV在欧美国家的动物种群中检出率比较高,MNV又对某些免疫缺陷动物有影响,出于多方面原因,MNV被这些企业列为排查目标微生物,也被FELASA组织作为推荐检测病原[1]。但是MNV对于免疫功能完全的动物没有明显影响,我们的实验研究发现正常途径动物难以感染该病毒(未发表数据)。我检测实验室对大群的实验动物血清学抽样检测未能发现MNV抗体的存在,只在一些研究机构的动物样品中发现了MNV抗体阳性,分析原因也多出于动物的国际交流[2]。因此,笔者个人认为MNV目前没有必要列入我国的国家标准进行强制要求。
我国的实验动物国家标准一方面规定了实验动物的国家规范,实际上还是企业和诸多检测单位参考的标准,因此,不仅要考虑病原的危害性,同时还要参考我国国内该病原的流行情况,有些病原虽然对动物有一定危害,然而感染频率较低,如果列入强制标准,无疑会增加社会经济负担。因此各实验动物生产和使用单位对于此类病原可考虑自身情况,安排监控,可不再作为国家标准要求的检测项目。
4目前我国实验动物国家标准中小鼠、大鼠排除病原项目的回顾性考量
是否把某一病原体纳入实验动物健康监测范围,需要考量的因素有很多,包括:病原的感染范围,该病原是否主要感染啮齿动物,是否也感染人类;病原的传播途径,判定病原的易感性;病原对于动物的损害,是否存在大范围流行性感染的可能;感染的临床症状,是否引起动物疾病;对于动物代谢、免疫或生理过程的影响水平;动物感染该病原对于科学研究的影响。
表1部分列入我国现行国家标准中的病原回顾性分析
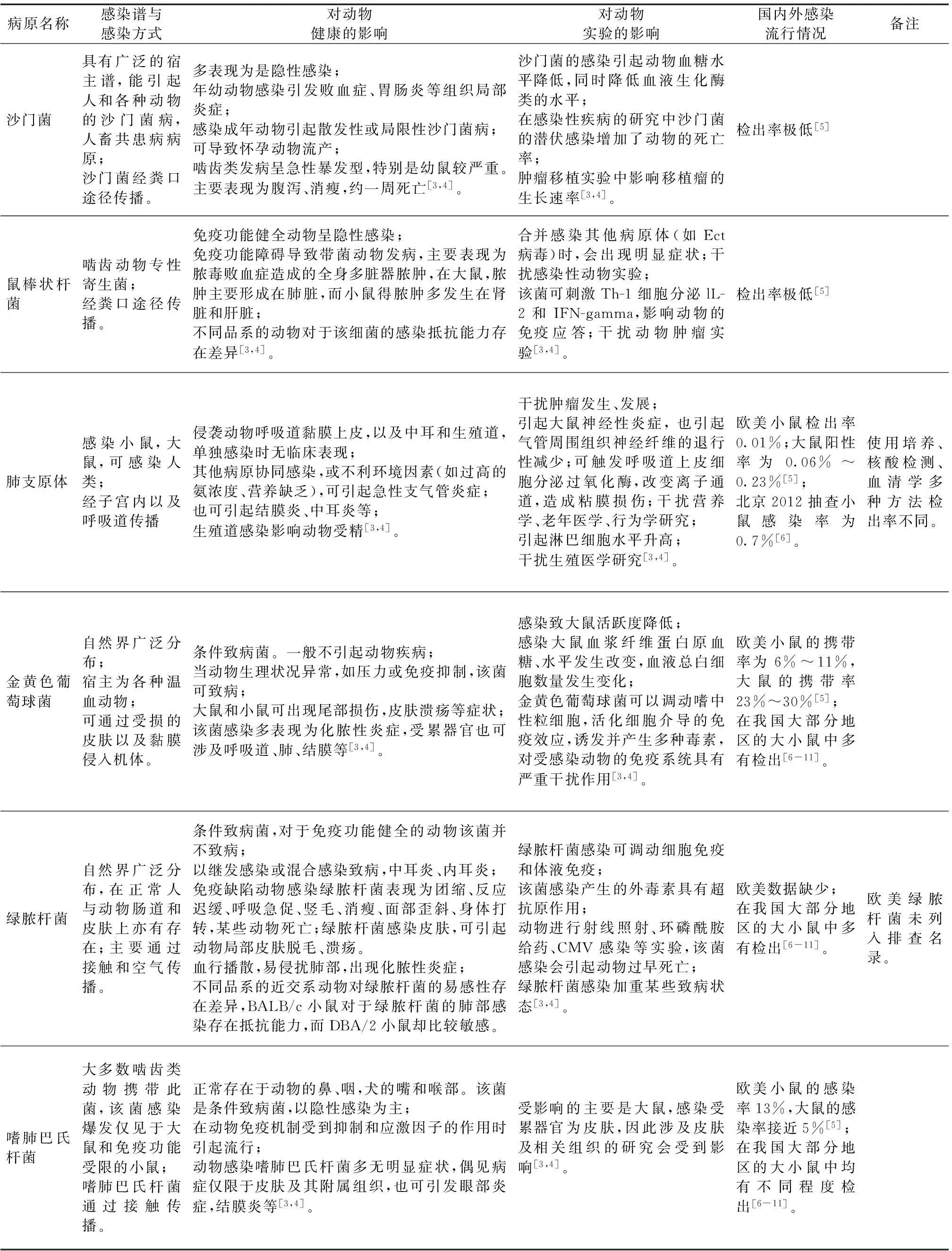
病原名称感染谱与感染方式对动物健康的影响对动物实验的影响国内外感染流行情况备注沙门菌具有广泛的宿主谱,能引起人和各种动物的沙门菌病,人畜共患病病原;沙门菌经粪口途径传播。多表现为是隐性感染;年幼动物感染引发败血症、胃肠炎等组织局部炎症;感染成年动物引起散发性或局限性沙门菌病;可导致怀孕动物流产;啮齿类发病呈急性暴发型,特别是幼鼠较严重。主要表现为腹泻、消瘦,约一周死亡[3,4]。沙门菌的感染引起动物血糖水平降低,同时降低血液生化酶类的水平;在感染性疾病的研究中沙门菌的潜伏感染增加了动物的死亡率;肿瘤移植实验中影响移植瘤的生长速率[3,4]。检出率极低[5]鼠棒状杆菌啮齿动物专性寄生菌;经粪口途径传播。免疫功能健全动物呈隐性感染;免疫功能障碍导致带菌动物发病,主要表现为脓毒败血症造成的全身多脏器脓肿,在大鼠,脓肿主要形成在肺脏,而小鼠得脓肿多发生在肾脏和肝脏;不同品系的动物对于该细菌的感染抵抗能力存在差异[3,4]。合并感染其他病原体(如Ect病毒)时,会出现明显症状;干扰感染性动物实验;该菌可刺激Th-1细胞分泌lL-2和IFN-gamma,影响动物的免疫应答;干扰动物肿瘤实验[3,4]。检出率极低[5]肺支原体感染小鼠,大鼠,可感染人类;经子宫内以及呼吸道传播侵袭动物呼吸道黏膜上皮,以及中耳和生殖道,单独感染时无临床表现;其他病原协同感染,或不利环境因素(如过高的氨浓度、营养缺乏),可引起急性支气管炎症;也可引起结膜炎、中耳炎等;生殖道感染影响动物受精[3,4]。干扰肿瘤发生、发展;引起大鼠神经性炎症,也引起气管周围组织神经纤维的退行性减少;可触发呼吸道上皮细胞分泌过氧化酶,改变离子通道,造成粘膜损伤;干扰营养学、老年医学、行为学研究;引起淋巴细胞水平升高;干扰生殖医学研究[3,4]。欧美小鼠检出率0.01%;大鼠阳性率为0.06%~0.23%[5];北京2012抽查小鼠感染率为0.7%[6]。使用培养、核酸检测、血清学多种方法检出率不同。金黄色葡萄球菌自然界广泛分布;宿主为各种温血动物;可通过受损的皮肤以及黏膜侵入机体。条件致病菌。一般不引起动物疾病;当动物生理状况异常,如压力或免疫抑制,该菌可致病;大鼠和小鼠可出现尾部损伤,皮肤溃疡等症状;该菌感染多表现为化脓性炎症,受累器官也可涉及呼吸道、肺、结膜等[3,4]。感染致大鼠活跃度降低;感染大鼠血浆纤维蛋白原血糖、水平发生改变,血液总白细胞数量发生变化;金黄色葡萄球菌可以调动嗜中性粒细胞,活化细胞介导的免疫效应,诱发并产生多种毒素,对受感染动物的免疫系统具有严重干扰作用[3,4]。欧美小鼠的携带率为6%~11%,大鼠的携带率23%~30%[5];在我国大部分地区的大小鼠中多有检出[6-11]。绿脓杆菌自然界广泛分布,在正常人与动物肠道和皮肤上亦有存在;主要通过接触和空气传播。条件致病菌,对于免疫功能健全的动物该菌并不致病;以继发感染或混合感染致病,中耳炎、内耳炎;免疫缺陷动物感染绿脓杆菌表现为团缩、反应迟缓、呼吸急促、竖毛、消瘦、面部歪斜、身体打转,某些动物死亡;绿脓杆菌感染皮肤,可引起动物局部皮肤脱毛、溃疡。血行播散,易侵扰肺部,出现化脓性炎症;不同品系的近交系动物对绿脓杆菌的易感性存在差异,BALB/c小鼠对于绿脓杆菌的肺部感染存在抵抗能力,而DBA/2小鼠却比较敏感。绿脓杆菌感染可调动细胞免疫和体液免疫;该菌感染产生的外毒素具有超抗原作用;动物进行射线照射、环磷酰胺给药、CMV感染等实验,该菌感染会引起动物过早死亡;绿脓杆菌感染加重某些致病状态[3,4]。欧美数据缺少;在我国大部分地区的大小鼠中多有检出[6-11]。欧美绿脓杆菌未列入排查名录。嗜肺巴氏杆菌大多数啮齿类动物携带此菌,该菌感染爆发仅见于大鼠和免疫功能受限的小鼠;嗜肺巴氏杆菌通过接触传播。正常存在于动物的鼻、咽,犬的嘴和喉部。该菌是条件致病菌,以隐性感染为主;在动物免疫机制受到抑制和应激因子的作用时引起流行;动物感染嗜肺巴氏杆菌多无明显症状,偶见病症仅限于皮肤及其附属组织,也可引发眼部炎症,结膜炎等[3,4]。受影响的主要是大鼠,感染受累器官为皮肤,因此涉及皮肤及相关组织的研究会受到影响[3,4]。欧美小鼠的感染率13%,大鼠的感染率接近5%[5];在我国大部分地区的大小鼠中均有不同程度检出[6-11]。
表1列出的病原体有些属于人兽共患的病原体,例如沙门氏菌、淋巴细胞脉络丛脑膜炎病毒、汉坦病毒。这些病原体目前在大鼠和小鼠的调查中感染率并不高,但是由于它们具有感染从业人员的风险,因此必须列为实验动物排查的病原。有些病原体属于动物的烈性病原体,如Ect鼠痘病毒,这样的病原体也需要在动物种群中做适当监控。
大部分病原体对于免疫功能健全的动物并没有明显致病作用,但是对于科学研究的干扰程度存在差异。泰泽病原体目前在实验动物中仍有一定检出率,而且对于实验研究的干扰较为显著;肺支原体情况类似,动物感染有一定检出率,对多种研究产生干扰;类似情况也包括小鼠肝炎病毒和仙台病毒。而某些病原对于科学研究的影响是局限性的,如嗜肺巴氏杆菌主要影响大鼠,感染受累器官为皮肤,因此涉及皮肤及相关组织的研究会受到影响。
有些病原体属于条件致病菌,例如金黄色葡萄球菌、绿脓杆菌等。这些病原体在自然环境中广泛存在,因此实验动物设施在控制这些病原时较为困难,而且动物携带这些病原体多无明显症状,且对于科学研究的干扰是有限的。因此这类病原体可以作为环境监控的指标,对于实验动物质量要求严格的实验设施可以将此类病原体列入监控范围。
仍有许多新发现的病原体,比如啮齿类动物的细小病毒,这类病原体包含很多种,它们是否需要列入实验动物质量控制的范围仍需要更多的研究以及数据支持。
如果某病原属于人兽共患病原,并且啮齿类动物容易携带,这样的病原应该例行检测;如果该病原对于动物的健康有严重影响,会造成动物的疫病,那么这样的病原也应该检测;而有些病原对于大多数研究存在证据充分的干扰风险,这样的病原也应该纳入到国家标准中对所有动物进行监测。某些病原体可能仅对某一类型的研究存在干扰风险,或是仅对某一种类或是品系的动物有影响,或者仅是一种条件致病的病原,这样的病原可以在特定的条件下选择性的进行检测。
国家标准不同于企业标准,列入国家标准中的病原体也应不同于各个设施自行制定的实验动物质控计划中的病原列表。实验动物由于不同于普通的动物,因此也不能仅仅排查动物疫病,只符合动物检疫的要求。我国实验动物国家标准的意义在于最终提高我国实验动物这一特殊商品的质量,并以此提升我国的实验动物产业发展,提高我国科研水平。我国的国家标准还具有引导性,很多机构将国家标准作为各自单位的质量控制标准,而且许多科研人员对于实验动物了认识不多,对于SPF等级的动物的认识也是不全面的。因此设定我国实验动物国家标准既要考虑强制性要求,同时也要做好推荐性指导。
参考文献:
[1]FELASA working group on revision of guidelines for health monitoring of rodents and rabbits, Mähler Convenor M, Berard M, Feinstein R, et al. FELASA recommendations for the health monitoring of mouse, rat, hamster, guinea pig and rabbit colonies in breeding and experimental units [J]. Lab Anim,2014, 48(3): 178-192.
[2]Xiang Z, Tian S, Tong W, et al. MNV primarily surveillance by a recombination VP1-derived ELISA in Beijing area in China [J]. J Immunol Methods, 2014, 408: 70-77.
[3]National Research Council. Infectious diseases of mice and rats: a report of the Institute of Laboratory Animal Resources Committee on Infectious Diseases of Mice and Rats [M]. National Academy Press, Washington, D.C.1991.
[4]Baker DG. Natural pathogens of laboratory mice, rats, and rabbits and their effects on research [J]. Clinl Microbiol Rev, 1998, 11(2): 231-266.
[5]Pritchett-Corning KR, Cosentino J, Clifford CB. Contemporary prevalence of infectious agents in laboratory mice and rats [J]. Lab Animals ,2009, 43: 165-173.
[6]魏杰, 林建伟, 付瑞, 等. 2009 -2013年北京地区实验动物质量抽检结果分析 [J]. 实验动物科学, 2014 ,31(2): 1-6.
[7]葛文平, 张旭, 高翔, 等. 我国商业化SPF级小鼠病原体污染分析 [J]. 中国比较医学杂志, 2012, 12(3): 65-68.
[8]王吉, 卫礼, 巩薇, 等. 2003-2007 年我国实验小鼠病毒抗体检测结果与分析[J]. 实验动物与比较医学, 2008, 28(6): 394-396.
[9]刘忠华, 黄韧, 刘香梅, 等. 广东省部分地区啮齿类实验动物汉坦病毒血清学调查 [J]. 中华流行病学杂志, 2007, 28(11): 1059
[10]覃迪, 蔡亮, 湛志飞, 等. 湖南省2006-2010年实验动物微生物质量监测结果分析 [J]. 中国比较医学杂志, 2012, 22(3): 69-73.
[11]戴德芳, 张 红, 刘运芝, 等. 湖南省2004-2006年实验动物病毒学质量监测结果分析 [J]. 实验动物与比较医学, 2007, 27(1): 57-59.
〔修回日期〕2015-12-26
A current consideration of the microbes listed in theNationalStandardofLaboratoryAnimalsfor mice and rats
XIANG Zhi-guang, TONG Wei, ZHANG Li-fang,KONG Qi,WEI Qiang Institute of Laboratory Animals, CAMS/PUMC
【Abstract】In this paper, some items about the microbes listed in the current National Standard of Laboratory Animals were reviewed, including their host spectrum, impact of infection on the animals, their interference on research works and their epidemiology in laboratory animals. This paper may provide some clues for the update of our National Standard of Laboratory Animals.
【Key words】National Standard of Laboratory Animals; SPF; Microbes; Infection
doi:10.3969.j.issn.1671-7856. 2016.02.007
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2016) 02-0033-07
[作者简介]向志光(1980-),男,副研究员,研究方向:实验动物质量控制。[通讯作者]魏强,研究员,E-mail: weiqiang0430@cnilas.org。
“实验动物国家标准论坛”专题
