定量体积排除色谱测定高分子双水相系统的组成和分子量分布
2016-04-08赵梓良薛彦虎姬相玲薄淑琴刘勇刚
赵梓良, 李 琦, 薛彦虎, 姬相玲, 薄淑琴, 刘勇刚
(1. 中国科学院长春应用化学研究所, 高分子物理与化学国家重点实验室, 长春 130022;
2. 中国科学院大学, 北京 100049)
定量体积排除色谱测定高分子双水相系统的组成和分子量分布
赵梓良1,2, 李琦1, 薛彦虎1, 姬相玲1, 薄淑琴1, 刘勇刚1
(1. 中国科学院长春应用化学研究所, 高分子物理与化学国家重点实验室, 长春 130022;
2. 中国科学院大学, 北京 100049)
摘要利用定量体积排除色谱研究葡聚糖-聚乙二醇双水相系统相分离后上下两相中2种高分子组分的含量、分子量和分子量分布. 由定量体积排除色谱法得到的两相组成(即系线端点)与用浊点滴定法得到的浊点曲线几乎完全重合, 二者仅在靠近临界点的聚乙二醇富集相有一定偏差. 同时, 利用体积排除色谱测得两相中葡聚糖和聚乙二醇的分子量和分子量分布. 结果表明, 由系线端点得到的体系两相共存线与浊点曲线的偏差是由于相分离过程中, 不同分子量的高分子组分在两相的非均匀分配造成的. 聚乙二醇分子量分布较窄, 发生相分离后, 在两相的分子量和分子量分布相差不大. 而葡聚糖分子量分布较宽, 在相分离后两相中的分子量和分子量分布具有较大差异, 即葡聚糖组分在葡聚糖富集相中的分子量显著高于其在聚乙二醇富集相中的分子量. 随着葡聚糖-聚乙二醇体系初始浓度的增加, 两相中葡聚糖的分子量差异变大. 定量体积排除色谱可以准确得到高分子双水相系统的相平衡数据及两相中2组分的分子量和分子量分布信息, 其结果不仅为深入理解葡聚糖-聚乙二醇-水三元溶液的相平衡提供基础, 而且为双水相系统在萃取分离中的应用提供理论指导.
关键词体积排除色谱; 双水相系统; 相分离; 葡聚糖; 聚乙二醇
刘勇刚, 男, 博士, 副研究员, 主要从事高分子溶液和生物膜物理研究. E-mail: yonggang@ciac.ac.cn
当一种水溶性高分子与另一种高分子或盐的混合水溶液的浓度超过某一临界值时, 会由均相溶液自发形成互不相溶的两相体系, 即双水相系统[1]. 与水-有机溶剂体系相比, 由2种高分子(如葡聚糖与聚乙二醇)组成的双水相系统具有温和的水环境、极低的界面张力及不破坏蛋白质的生物活性等特性, 因此被广泛用于各种生物样品(如蛋白质、酶、核酸和病毒等)的萃取分离和纯化[2]. 被分离物质在两相中的分配系数不仅取决于其本身的物理化学性质, 而且与体系的相平衡密切相关. 因此研究高分子双水相系统的相分离参数, 建立其与样品分离效率的关系, 对于高分子双水相系统在萃取分离中的应用具有重要的指导意义. 同时也将为理解高分子-高分子-水三元溶液的相平衡提供数据基础.
浊点曲线、两相共存线、相分离临界点是描述相分离高分子溶液相图的常用参数[3,4]. 对于分子量分布较窄的高分子样品, 由浊点滴定法得到的浊点曲线是体系的两相共存线的很好近似(单分散高分子样品的浊点曲线与两相共存线重合). 位于两相区的高分子混合溶液, 相分离后的上下两相具有不同的组成和密度. 在无限接近相分离临界点处, 两相具有非常相似的组成和密度, 因此可用等体积法来确定体系的临界点[4]. 在相图上连接两相组成的直线称为系线, 可以由多种方法得到. 对于高分子双水相系统, 通常需要同时测定两相的2个物理量如折光指数和旋光度[5], 利用这2个物理量与2种高分子组成之间的不同线性关系推算出两相的组成. 测定两相的傅里叶红外光谱或激光共聚焦拉曼光谱, 利用化学计量学方法也可得到双水相系统的组成[6,7], 但实验耗时较长且误差较大. 最近, 我们提出仅用两相密度推算其高分子组成的方法, 可以快速得到体系的系线[8]. 密度法假定系线端点与浊点曲线重合, 但这一点并非总能满足, 尤其对于具有较宽分子量分布的准三元体系[9]. 值得指出的是, 上述方法都只能得到两相中2种高分子的含量, 而无法提供不同分子量的高分子组分在两相的分配信息. 体积排除色谱法利用高分子保留峰面积与进样量之间的定量关系, 可以得到相分离两相中2种高分子组分的含量[10], 同时, 还可以给出两相中2种高分子的分子量及分子量分布, 有助于深入理解双水相系统的相平衡规律.
本文利用定量体积排除色谱法测定了一系列不同初始浓度的葡聚糖-聚乙二醇双水相系统相分离后两相的物质组成和2种高分子组分的分子量及分子量分布. 将体系系线与浊点滴定法得到的浊点曲线进行对比, 讨论了二者存在差异的原因.
1实验部分
1.1试剂与仪器
来源于肠系膜明串珠菌的葡聚糖(分子量为4×105~5×105)和聚乙二醇(分子量为8×103)购自Sigma-Aldrich公司, 使用前采用真空除水至恒重. 聚乙二醇(PEG)和聚氧化乙烯(PEO)标样均购自英国Polymer Laboratories公司. 其它试剂均为分析纯. 所有溶液均由Sartorious水净化系统制备的超纯水(电阻率为18.2 MΩ·cm)配制.
体积排除色谱(SEC)系统由美国Waters公司的515型往复泵、717plus型自动进样器和2414型示差检测器组成, 其中色谱柱为英国Polymer Laboratories公司的1根PL aquagel-OH 8 μm保护柱(50×7.5 mm)和2根PL aquagel-OH MIXED-H 8μm色谱柱(300×7.5 mm)组成. 流动相为质量分数为0.02%的叠氮化钠水溶液, 并经0.22 μm滤膜过滤, 测试时流动相流速为1.0 mL/min. 高分子溶液进样前经0.45 μm滤膜过滤, 进样量为100 μL. 溶液密度用奥地利Anton Paar公司的DMA4500型密度计测定.
1.2实验过程
1.2.1高分子溶液的相分离利用浊点滴定法获取高分子双水相系统在(25±1) ℃下的浊点曲线和相分离临界点[5,8]. 首先分别配置质量分数为10%~20%的葡聚糖和聚乙二醇母液. 向10 mL样品瓶中加入其中一种高分子母液, 并用超纯水稀释至合适浓度后, 逐滴加入另一种高分子母液, 混合均匀后将溶液静置片刻, 用肉眼判断是否出现浑浊. 溶液滴加与混合交替进行, 直至溶液刚好出现浑浊并无法恢复至澄清状态, 计算滴定终点2种高分子组分的含量, 从而得到葡聚糖-聚乙二醇双水相系统的浊点曲线. 在体系的相分离临界点, 上下两相具有几乎相同的组成和体积. 在可密闭的10 mL量筒中, 使用2种高分子母液配制初始浓度在两相区且具有不同葡聚糖与聚乙二醇质量分数比wd/wp的高分子混合溶液, 向体系中分次加入适量水并混合均匀, 记录每次重新相分离后上下两相的体积, 直至体系最终变为澄清. 找到趋近浊点曲线且相分离后得到的两相具有相等体积所对应的初始高分子组成, 即为体系的相分离临界点. 用分液漏斗配置与相分离临界点具有相同高分子质量分数比、且溶液初始浓度超过相分离临界点的一系列葡聚糖-聚乙二醇混合溶液, 在(25±1) ℃下放置数天至体系完全相分离, 分别取出相分离后的上下两相, 用于密度及体积排除色谱测试.
1.2.2体积排除色谱体积排除色谱的示差检测器常数用已知浓度的氯化钠溶液标定. 分别配制一系列浓度为0.1~10 mg/mL的葡聚糖与聚乙二醇的标准溶液, 用于体积排除色谱测试, 建立葡聚糖和聚乙二醇的色谱峰面积与进样量之间的定量关系.
葡聚糖-聚乙二醇体系相分离得到的葡聚糖富集相和聚乙二醇富集相的质量分数可达0.1或更高, 需要稀释10~100倍方可用于体积排除色谱测试. 从每个组分色谱峰的面积可计算出相应的高分子组分浓度. 由相分离得到的葡聚糖富集相和聚乙二醇富集相的高分子组分含量可以由稀释比计算得到, 由此得到某一初始高分子浓度时葡聚糖-聚乙二醇体系的系线. 相图上的高分子浓度以质量分数表示, 而体积排除色谱中的高分子浓度用质量体积浓度表示, 两者通过测得的高分子溶液密度进行换算.
测定一系列不同分子量的窄分布PEG/PEO标样的峰值保留体积, 建立PEG/PEO分子量与保留体积之间的校准曲线, 计算得到聚乙二醇的分子量和分子量分布. 而葡聚糖的分子量和分子量分布需要利用普适校准方可得到[11~13]. 普适校准得到的葡聚糖分子量校准曲线经体积排除色谱与激光光散射检测器联用的结果验证.
2结果与讨论
2.1浊点曲线和临界点

Fig.1 Cloud point curve of the aqueous solution of dextran and PEG at (25±1) ℃ obtained by titration The homogeneous solution in the left vial has a composition in the one-phase region, the right one shows phase separation in the two-phase region. Au nanoparticles are dispersed in water and added to the mixed solution to enhance the color contrast.
通过浊点滴定法可以得到葡聚糖-聚乙二醇双水相系统的相图, 如图1所示. 浊点曲线将体系分为2个区域, 曲线下方为一相区(如图1插图中左侧样品瓶中溶液所示), 曲线上方为两相区(如图1插图中右侧样品瓶中溶液所示). 图2(A)给出了具有不同葡聚糖与聚乙二醇质量分数比(wd/wp)的高分子混合溶液, 在稀释过程中体系相分离后葡聚糖富集相的体积分数φd随与浊点曲线归一化距离w/wcl-1的变化关系. 在非常接近浊点曲线的两相区, 葡聚糖富集相的体积分数φd随着wd/wp的增加而单调增大, 与φd=0.5对应的wd/wp为1.23[图2(B)]. 固定此高分子比例在浊点曲线附近研究一系列不同浓度葡聚糖-聚乙二醇混合溶液的相行为, 确定体系相分离的临界点wcr=0.0811± 0.0002, 在相图上为(wd,cr,wp,cr)=(0.0447, 0.0364). 这一结果与之前对这一体系得到的结果非常接近[8], 相图的细微差别是由于不同批次的高分子样品在分子量和分子量分布上的差异造成的[14].

Fig.2 Volume fraction(φd) of the dextran-rich phase as a function of the normalized distance from the cloud point(w/wcl-1) for polymer solutions of different mass ratios(wd/wp) between dextran and PEG(A) and dependence of the volume fraction φd on the mass ratio wd/wp at w/wcl=1.01(B)
2.2定量体积排除色谱法测定双水相系统的系线
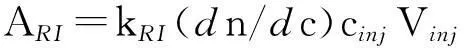
(1)式中: kRI为示差检测仪器常数;dn/dc为折光指数增量; Vinj为进样体积.
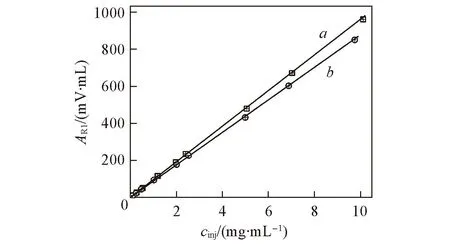
Fig.3 Dependence of the RI peak area(ARI) as a function of polymer concentration(cinj) of the solutions injected into the SEC columns for dextran(a) and PEG(b)
图3给出了葡聚糖和聚乙二醇溶液的示差检测响应峰面积ARI与进样浓度cinj之间的关系. 可以看出, 在测试的进样浓度(0.1~10 mg/mL)范围内, 2种高分子样品的峰面积与进样浓度之间呈良好的线性关系. 从拟合得到的直线斜率可以计算出葡聚糖和聚乙二醇在水中的折光指数增量, 分别为0.149和0.136 mL/g, 与文献[17]报道的数值一致, 表明葡聚糖和聚乙二醇样品都从色谱柱中完全淋洗出来.
利用图3建立的样品峰面积与进样浓度之间的校准关系, 测定未知浓度样品的体积排除色谱谱图, 即可计算出待测样品中的高分子含量. 具有不同初始浓度的葡聚糖-聚乙二醇体系相分离后得到的葡聚糖富集相和聚乙二醇富集相, 用水稀释后进行体积排除色谱实验, 从而得到两相中的葡聚糖和聚乙二醇组分的含量. 高分子的初始浓度用与临界点的归一化距离ε≡c/ccr-1表示, 其中c≡wρ,ρ是高分子溶液的密度, 高分子溶液在临界点的浓度ccr=0.0828 g/mL. 本文中,wd/wp= 1.23,c= 0.0836~0.381 g/mL,ε= 0.01~3.6.
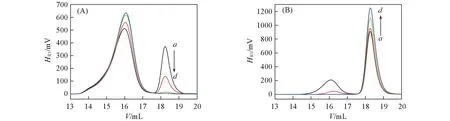
Fig.4 SEC chromatograms of the coexisting dextran-rich(A) and PEG-rich phases(B) at ε= 0.030(a), 0.200(b), 0.982(c) and 2.087(d) with wd/wp=1.23

Fig.5 Phase diagram of the ternary dextran- PEG-water systemThe cloud point curve(same data as in Fig.1) is shown as a solid curve. The compositions of the initial solutions(with mass ratio wd/wp=1.23) for which SEC measurements after phase separation are performed are indicated by black crosses. The end points of the respective tie lines(dashed lines) consist of red crosses indicating the compositions of the dextran-rich phases and green crosses indicating the compositions of the PEG-rich phases. The midpoints(blue circles) of the tie lines were extrapolated to determine the critical point.
图4分别给出了初始高分子归一化浓度ε= 0.030, 0.200, 0.982, 2.087的葡聚糖-聚乙二醇混合溶液相分离后得到的葡聚糖富集相和聚乙二醇富集相用水稀释后样品的体积排除色谱图. 可以看到, 在距离临界点较近时, 在葡聚糖富集相和聚乙二醇富集相都包含2个峰, 与其中葡聚糖和聚乙二醇组分相对应. 从每个组分色谱峰的面积即可计算出相应高分子组分的浓度. 随着初始高分子溶液浓度的增加, 在葡聚糖富集相中葡聚糖含量越来越多, 而聚乙二醇含量越来越少; 与此同时, 在聚乙二醇富集相中聚乙二醇含量增加, 而葡聚糖含量降低. 在距离临界点较远时(ε>1), 2种高分子在各自贫相中的含量趋近于0.
用定量体积排除色谱方法最终得到的葡聚糖富集相和聚乙二醇富集相的组分含量(即系线的2个端点)如图5所示. 初始高分子溶液的组成以及浊点曲线也同时给出. 除了在靠近临界点的聚乙二醇富集相有少许偏差外(这是由于高分子在两相的分子量分级造成的), 系线端点与浊点曲线几乎完全重合. 各个不同初始浓度的高分子溶液组成在相图上都位于相应的系线上, 证明了所得结果的准确性. 此外, 从葡聚糖富集相和聚乙二醇富集相的密度推算出高分子组分的含量[8]也与图5的数据几乎完全一致. 用密度法测定高分子双水相系统的系线简便易行, 但是需要假定系线端点与浊点曲线重合. 对于分子量分布较宽的体系, 两者可能不能完全重合, 得到的系线会有偏差[9]. 而定量体积排除色谱法虽然耗时较多, 但是无需浊点曲线的辅助, 即可独立得到精确的系线数据, 可为研究相分离机理提供可靠数据. 必须指出的是, 利用仅配备示差检测器的体积排除色谱测定高分子双水相系统的系线, 2种高分子组分必须有较大的尺寸差别, 才能在体积排除色谱谱图上分离. 如果2种高分子组分在谱图上有较大的重叠, 必须配备2个浓度检测器(如示差检测器和旋光度检测器, 对2种高分子有不同响应常数), 才能使谱图上2个高分子组分的贡献分离, 方可确定其含量[18~20].
值得指出的是, 体系的相分离临界点也可由图5中各条系线的中点外推到与浊点曲线的交点得到, 与前述由等体积法得到的结果一致.
2.3高分子组分的分子量及分子量分布
定量体积排除色谱法除了能给出高分子各组分含量外, 利用建立的葡聚糖和聚乙二醇的分子量校准曲线, 还可以获得2种高分子组分的分子量和分子量分布. 表1和表2列出了葡聚糖和聚乙二醇在两相中的重均分子量Mw、数均分子量Mn和分子量分布宽度指数Mw/Mn.
由表1可以看出, 葡聚糖原样具有较高的分子量和较宽的分子量分布:Mw=380000,Mw/Mn=2.19. 葡聚糖在相分离后得到两相中的分子量和分子量分布差异很大. 对于离临界点最近的相分离两相(归一化高分子浓度ε=0.01), 在葡聚糖富集相中的葡聚糖组分的Mw=454000,Mw/Mn=2.35, 而在聚乙二醇富集相中的葡聚糖组分的Mw=249000,Mw/Mn=1.63. 与原样相比, 前者的平均分子量较高, 分子量分布略宽; 而后者的平均分子量较低, 分子量分布较窄. 这是因为相分离后高分子量的葡聚糖更加倾向于留在葡聚糖富集相中, 而低分子量的葡聚糖更易进入聚乙二醇富集相中. 换言之, 葡聚糖-聚乙二醇双水相系统在相分离时, 分子量分布较宽的葡聚糖会发生分子量分级现象, 与高分子相分离的Flory-Huggins平均场理论的预测结果一致[3,4]. 随着初始高分子溶液浓度的增大, 葡聚糖分子量分级的效果愈加显著, 导致聚乙二醇富集相中葡聚糖组分的含量越来越少(图5), 分子量越来越小(表1). 在ε=0.73时, 聚乙二醇富集相中葡聚糖的Mw已经低至82000. 而在初始高分子浓度更高(ε>0.73)时, 聚乙二醇富集相中的葡聚糖含量很少, 几乎难以检测出来. 随着初始高分子溶液浓度的增大, 在葡聚糖富集相中的葡聚糖组分的分子量和分子量分布逐渐趋向于与原样一致, 这是因为此时绝大多数的葡聚糖都留在葡聚糖富集相中. 由表2可以看出, 聚乙二醇原样的分子量较低, 分子量分布较窄:Mw=8450,Mw/Mn=1.11. 聚乙二醇在相分离得到两相中的分子量和分子量分布相差不大, 且与原样的分子量和分子量分布都很接近. Tromp等[18~20]的研究结果表明, 2种宽分子量分布的高分子组成的双水相系统在相分离时, 2种高分子都会有一定的分子量分级. 我们没有观察到聚乙二醇在两相有明显的分子量分级, 是由于其较窄的分子量分布.
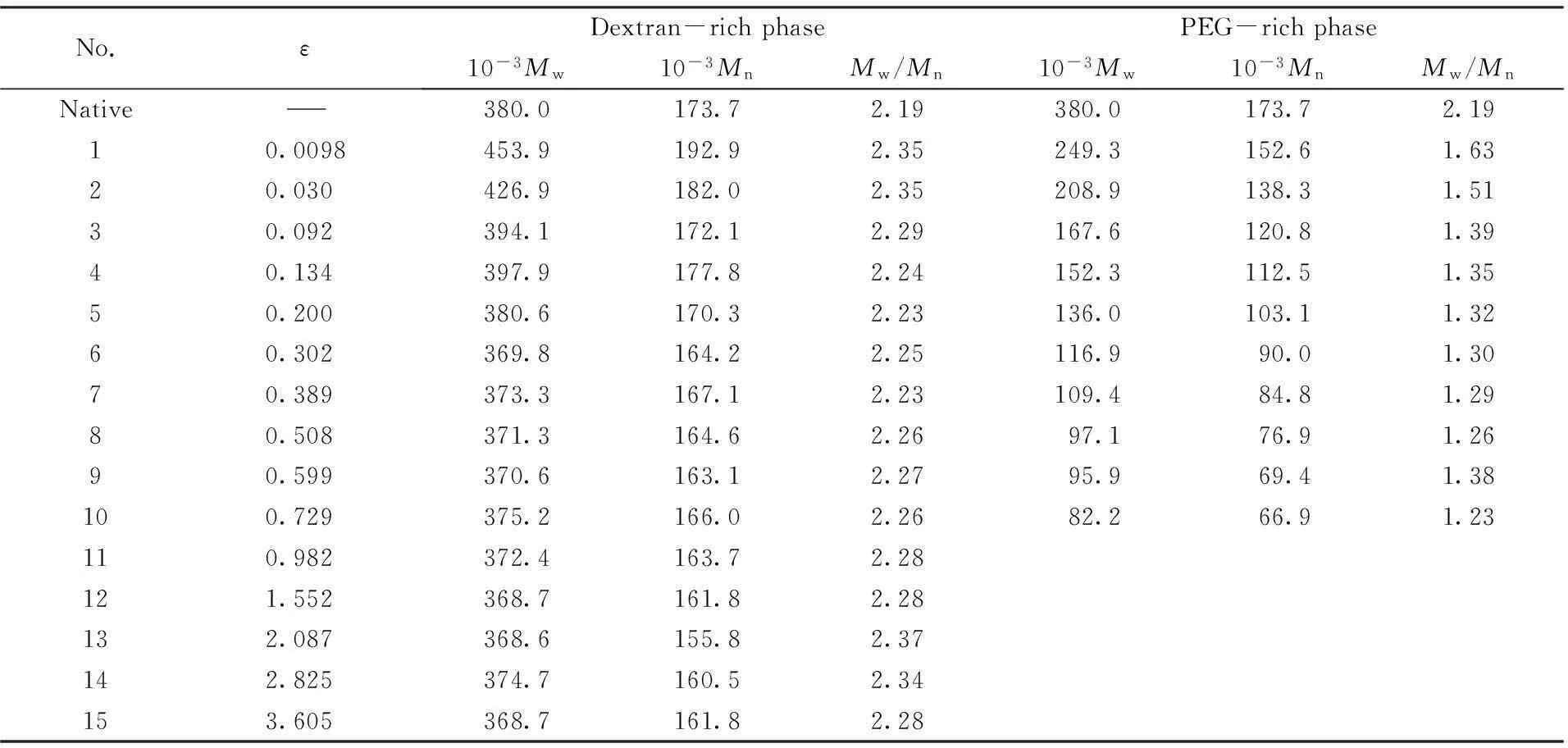
Table 1 Molecular weight of dextran in dextran-rich and PEG-rich phases

Table 2 Molecular weight of PEG in dextran-rich and PEG-rich phases
在靠近临界点的聚乙二醇富集相, 与浊点曲线相比, 系线端点明显向高浓度区域偏离. 这是因为聚乙二醇富集相中的葡聚糖组分分子量较原样低很多, 与分子量较高的原样相比, 相分离必须发生在高分子浓度较高的区域. 与此类似的是, 在靠近临界点的葡聚糖富集相中的葡聚糖组分分子量较原样高, 与分子量较低的原样相比, 只需要较低的高分子浓度就可以发生相分离. 不过因为葡聚糖富集相中葡聚糖组分的分子量与原样相差不大, 所以在相图上并没有明显表现出来.
3结论
利用定量体积排除色谱法测定了由具有较宽分子量分布的葡聚糖和较窄分布的聚乙二醇组成的双水相系统的组成和分子量. 由定量体积排除色谱法测得的两相共存线与用浊点滴定法得到的浊点曲线几乎完全重合, 二者仅在靠近临界点的聚乙二醇富集相有一定偏差. 这是由于在相分离过程中不同分子量的高分子组分在两相的非均匀分配造成的. 窄分布的聚乙二醇在两相的分子量和分子量分布相差不大. 而宽分布的葡聚糖在两相中的分子量和分子量分布具有较大差异, 即葡聚糖组分在葡聚糖富集相中的分子量显著高于其在聚乙二醇富集相中的分子量. 随着葡聚糖-聚乙二醇体系浓度的增加, 两相中葡聚糖的分子量差异变大.
参考文献
[1]Albertsson P. Å.,PartitionofCellParticlesandMacromolecules:SeparationandPurificationofBiomolecules,CellOrganelles,Membranes,andCellsinAqueousPolymerTwo-phaseSystemsandTheirUseinBiochemicalAnalysisandBiotechnology, 3rdEd., Wiley, New York, 1986
[2]Walter H., Brooks D. E., Fisher D.,PartitioninginAqueousTwo-phaseSystems:Theory,Methods,Uses,andApplicationstoBiotechnology, Academic Press, Orlando, 1985
[3]Flory P. J.,PrinciplesofPolymerChemistry, Cornell University Press, Ithaca, 1953
[4]Koningsveld R., Stockmayer W. H., Nies E.,PolymerPhaseDiagrams, Oxford University Press, New York, 2001
[5]Hatti-Kaul R.,MethodsinBiotechnology,Vol. 11,AqueousTwo-phaseSystems:MethodsandProtocols, Humana Press, Totowa, 2000
[6]Pudney P. D. A., Hancewicz T. M., Cunningham D. G., Gray C.,FoodHydrocolloids, 2003, 17, 345—353
[7]Loret C., Schumm S., Pudney P. D. A., Frith W. J., Fryer P. J.,FoodHydrocolloids, 2005, 19, 557—565
[8]Liu Y. G., Lipowsky R., Dimova R.,Langmuir, 2012, 28, 3831—3839
[9]Kang C. H., Sandler S. I.,Macromolecules, 1988, 21, 3088—3095
[10]Connemann M., Gaube J., Leffrang U., Muller S., Pfennig A.,J.Chem.Eng.Data, 1991, 36, 446—448
[11]Bailey F. E., Kucera J. L., ImhofL. G.,J.Polym.Sci., 1958, 32, 517—518
[12]Senti F. R., Hellman N. N., Ludwig N. H., Babcock G. E., Tobin R., Glass C. A., Lamberts B. L.J.Polym.Sci., 1955, 17, 527—546
[13]Ioan C. E., Aberle T., Burchard W.,Macromolecules, 2000, 33, 5730—5739
[14]Helfrich M. R., Mangeney-Slavin L. K., Long M. S., Djoko Y., Keating C. D.,J.Am.Chem.Soc., 2002, 124, 13374—13375
[15]Yan X. H., Cheng R. S.,ActaPolymericaSinica, 1989, (6), 647—654(严晓虎, 程镕时. 高分子学报, 1989, (6), 647—654)
[16]Liu C. G., Xie H. F., Zheng Y., Cheng R. S.,ActaPolymericaSinica, 2008, (11), 1031—1036(刘承果, 谢鸿峰, 郑云, 程镕时. 高分子学报, 2008, (11), 1031—1036)
[17]Michielsen S.,InPolymerHandbook, Ed.: Brandrup J., Immergut E. H., Grulke E. A., Abe A., Bloch D. R., John Wiley & Sons, New York, 2003
[18]van Heukelum A., Barkema G. T., Edelman M. W., van der Linden E., Hoog E. H. A., Tromp R. H.,Macromolecules, 2003, 36, 6662—6667
[19]Edelman M. W., van der Linden E., Tromp R. H.,Macromolecules, 2003, 36, 7783—7790
[20]Edelman M. W., Tromp R. H., van der Linden E.,Phys.Rev.E, 2003, 67, 021404
Composition and Molecular Weight Determination of Aqueous Two-phase
System by Quantitative Size Exclusion Chromatography†
ZHAO Ziliang1,2, LI Qi1, XUE Yanhu1, JI Xiangling1*, BO Shuqin1, LIU Yonggang1*
(1.StateKeyLaboratoryofPolymerPhysicsandChemistry,ChangchunInstituteofAppliedChemistry,
ChineseAcademyofSciences,Changchun130022,China;
2.UniversityofChineseAcademyofSciences,Beijing100049,China)
AbstractQuantitative size exclusion chromatography(SEC) was exploited to study the composition, molecular weight and molecular weight distribution of aqueous two-phase system of dextran and poly(ethylene glycol)(PEG) following phase separation. Tie lines constructed by SEC method were compared with the cloud point curve of the system obtained by titration. An excellent agreement was found between the tie line end points and the cloud point, except for the data points of the PEG-rich phases close to the critical point. The molecular weight and molecular weight distribution of the two polymer species in two co-existing phases obtained by SEC indicate that the mismatch is caused by the uneven distribution of macromolecular components between two phases upon phase separation. Having a broad molecular weight distribution, dextran in the two phases show prominent molecular mass difference. The molecular weight of dextran in the dextran-rich phase is significantly higher than that in the PEG-rich phase. As the initial polymer concentration of the system increases, the molecular weight difference of dextran in the two phases becomes more significant. However, we have not observed such a trend for PEG because of its narrow molecular weight distribution. Accurate data on the phase diagram and molecular weight of two polymer components in the co-existing phases can be obtained using quantitative SEC. The above results will not only help to understand the phase diagram of dextran-PEG-water ternary system, but also provide guidance to its application in extraction and separation of biological materials.
KeywordsSize exclusion chromatography; Aqueous two-phase system; Phase separation; Dextran; Poly(ethylene glycol)
(Ed.: D, Z)
† Supported by the National Natural Science Foundation of China(No.21274147), the Natural Science Foundation of Jilin Province, China(No.201215093) and the Partner Group Program of the Max Planck Society and the Chinese Academy of Sciences.
doi:10.7503/cjcu20150553
基金项目:国家自然科学基金(批准号: 21274147)、吉林省自然科学基金(批准号: 201215093)和中国科学院-德国马普学会伙伴小组项目资助.
收稿日期:2015-07-20. 网络出版日期: 2015-10-21.
中图分类号O631.4
文献标志码A
联系人简介:姬相玲, 女, 博士, 研究员, 博士生导师, 主要从事高分子溶液和多孔高分子材料研究. E-mail: xlji@ciac.ac.cn
