18F-FDG PET/CT在评价索拉非尼治疗131I难治性分化型甲状腺癌疗效中的应用
2016-04-08程凌霄阮茂美罗全勇陈立波
刘 敏,程凌霄,阮茂美,罗全勇,陈立波
上海交通大学附属第六人民医院核医学科,上海 200233
18F-FDG PET/CT在评价索拉非尼治疗131I难治性分化型甲状腺癌疗效中的应用
刘 敏,程凌霄,阮茂美,罗全勇,陈立波
上海交通大学附属第六人民医院核医学科,上海 200233
[摘要]背景与目的:肿瘤的疗效评价是阻碍确定肿瘤治疗最佳策略的因素之一。在淋巴瘤及其他实体肿瘤,基于正电子发射断层显像/电子计算机断层扫描(positron-emission tomography/computed tomography,PET/CT)的疗效评价的价值已经显现,尤其是对于靶向治疗(导致肿瘤活性改变而肿瘤大小可能未变)的疗效评价。通过对比实体瘤反应评价标准(Response Evaluation Criteria in Solid Tumors,RECIST 1.1)和欧洲癌症研究和治疗组织(European Organization for Research and Treatment of Cancer,EORTC)标准,研究18F-FDG PET/CT在评价索拉非尼(sorafenib)治疗131I难治性分化型甲状腺癌(radioiodine-refractory differentiated thyroid cancer,RR-DTC)疗效中的作用。方法:回顾性分析2011年—2014年索拉非尼治疗前和治疗3个月后均行18F-FDG PET/CT检查的14例RRDTC 患者(男性6例,女性8例,平均年龄55.6岁)。用Wilcoxon符号秩和检验分析靶病灶直径之和与∑SUVmax变化百分比的差异。用χ2检验比较两种标准的疗效评分有无差异。用Wilcoxon 秩和检验比较按照RECIST 1.1 或 EORTC 标准不同反应组间的无进展生存期(progression-free survival,PFS)有无差异。用Spearman 秩相关评估 PFS与形态学(RECIST 1.1)或功能学(EORTC criteria)反应分组的相关系数。结果:不同反应组间靶病灶直径之和与∑SUVmax变化百分比差异无统计学意义(Z=-0.408,P=0.683)。根据两种评价标准,14例患者中10例的评价结果是一致的(χ2=2.345,P=0.424),其余4例中,2例为SD/PMR,2例为SD/PMD。无论是按照RECIST 1.1(χ2=8.571,P=0.003)还是按照EORTC标准(χ2=8.781,P=0.003),各反应组间的PFS均有差异。PFS既与形态学评价结果相关(r=0.741,P=0.002),也与代谢学评价结果相关(r=0.816,P=0.000 4)。结论:18F-FDG PET/CT可用于RR-DTC患者索拉非尼治疗后的疗效评价。尽管71.4%的患者RECIST 1.1和 EORTC 标准结果一致,但是基于PET的代谢学评价标准在预测治疗效果方面更为准确,可能比形态学评价标准更适用于靶向治疗的疗效评估。
[关键词]18F-FDG PET/CT;RECIST 1.1;EORTC;131I难治性分化型甲状腺癌;索拉非尼
18F-FDG PET/CT imaging in the monitoring of response to sorafenib in patients with radioiodinerefractory diferentiated thyroid cancer
LIU Min, CHENG Lingxiao, RUAN Maomei, LUO Quanyong,CHEN Libo
(Department of Nuclear Medicine, Shanghai Jiao Tong University Affiliated Sixth People’s Hospital, Shanghai 200233, China)
Correspondence to:CHEN Libo E-mail:libochen888@hotmail.com
[Abstract]Background and purpose:The evaluation of treatment response is one of the most important building blocks in determining the best strategy for the management of malignant tumors.In lymphoma and several solid cancer types, PET/CT-based response evaluation has been shown to be valuable, especially in visualizing the effect of the targeted treatment, which induces tumor activity changes not necessarily followed by tumor shrinkage.This study aimed to evaluate the role of18F-FDG PET/CT in the monitoring of response to sorafenib treatment in radioiodine-refractory differentiated thyroid cancer(RR-DTC)patients; and to compare the Response Evaluation Criteria in Solid Tumors(RECIST 1.1)with the European Organization for Research and Treatment of Cancer(EORTC)criteria.Methods:This was a single-centerretrospective analysis of 14 patients with RR-DTC treated with sorafenib in the period from Dec.2011 to Dec.2014.A Wilcoxon signed-rank sum test was used to assess the differences in percentage changes between the sum of diameter and ∑SUVmax.These values of responses were statistically compared using the chi-square test(Fisher’s exact test).The differences in PFS between response categories according to either RECIST 1.1 or the EORTC criteria were evaluated using the Wilcoxon signed-rank sum test.The Spearman rank correlation coefficient was estimated between PFS and either morphologic(RECIST 1.1)or metabolic response(EORTC criteria)categories.Results:There was an agreement between the RECIST 1.1 and EORTC criteria in 10 of the 14 patients(χ2=2.345, P=0.424).The remaining 4 patients with SD included 2 patients with PMR and 2 patients with PMD.Differences in PFS among different response categories according to either RECIST 1.1(χ2=8.571, P=0.003)or EORTC criteria(χ2=8.781, P=0.003)were statistically significant.Correlations were found between PFS and either morphologic(r=0.741, P=0.002)or metabolic(r=0.816, P=0.0004)response criteria.Conclusion:18F-FDG PET/CT imaging is of value in the monitoring of response to sorafenib in patients with RR-DTC.Although RECIST 1.1 and EORTC criteria agree in 71.4% patients, PET-based metabolic response criteria seems to be more accurate in predicting therapeutic outcome and may be more suitable than morphologic response criteria for the evaluation of response to targeted therapy.
[Key words]18F-FDG PET/CT; RECIST 1.1; EORTC; Radioiodine refractory differentiated thyroid cancer; Sorafenib
分化性甲状腺癌(differentiated thyroid cancer,DTC)占甲状腺癌的80%~90%[1]。由于其惰性生物学特性和手术、放射性碘(131I)和左旋甲状腺素的有效治疗而显示出良好的预后[2-3]。然而,近5%的DTC患者仍然呈现疾病进展和远处转移,病灶失去对131I的摄取能力,即所谓的131I难治性分化型甲状腺癌(radioiodinerefractory differentiated thyroid cancer,RRDTC),此类患者的10年生存率仅为10%[4]。
近几年,晚期RR-DTC的分子靶向治疗取得了突破性的进展,我们之前已对此进行了综述报道[5]。2013年11月,美国食品药品管理局(Food and Drug Administration,FDA)根据索拉非尼(sorafenib)的多中心、双盲、安慰剂对照Ⅲ期临床研究结果,批准其用于治疗局部复发或转移、进展的RR-DTC[6]。索拉非尼是一种口服的新型靶向治疗药物,具有双重的抗肿瘤作用:既能抑制RAF(包括BRAFV600E)的丝氨酸/苏氨酸激酶活性而直接抑制肿瘤细胞的增殖,又可以抑制血管内皮生长因子受体(VGFR-2、VEGF-3)、血小板源生长因子受体β(PDGFR-β)等多种受体的酪氨酸激酶活性进而抑制新生血管的形成和切断肿瘤细胞的营养供应而达到遏制肿瘤生长的目的[7-8]。索拉非尼Ⅲ期临床研究的首要研究终点是无进展生存期(progression-free survival,PFS),后者是根据实体瘤反应评价标准(Response Evaluation Criteria in Solid Tumors,RECIST 1.1)每8周检测一次而确定。PFS的具体定义是由患者入组至第一次发生疾病进展或任何原因死亡的时间。最近,FDA又批准了乐伐他尼用于治疗局部复发或转移、进展性RR-DTC[9]。其他多种激酶抑制剂也正在进行临床试验[5]。
传统上,肿瘤的治疗反应是根据RECIST肿瘤大小变化而确定[10-11]。我们之前的研究已经证实,在评价索拉非尼治疗RR-DTC的疗效方面,RECIST 1.1与RECIST 1.0有高度的一致性,具有简化步骤和补充正电子发射断层显像(positron-emission tomography,PET)的优势[12]。然而, RECIST 存在诸多缺陷,特别是在治疗后肿瘤边界模糊的情况下。此外,靶向治疗药物是细胞稳定而非细胞毒性药物,可以使肿瘤坏死而没有明显的肿瘤大小变化[13]。尽管当前的肿瘤疗效评价标准是基于解剖学的变化,但是在没有或形态学变化很小的时候,代谢学的变化可能更能准确地进行疗效判定和预后评估[14-15]。
基于PET的疗效评价标准中,欧洲癌症研究和治疗组织(European Organization for Research and Treatment of Cancer,EORTC)标准是将治疗前选定的靶病灶随访后进行疗效判定。尽管理论上此种方法对靶向治疗的疗效评价十分合理,但是其优势还需要经过对比研究才能最终确定。据我们所知,在靶向治疗领域,尚没有将EORTC 标准与RECIST 1.1标准进行疗效判定的对比研究。本研究通过对比RECIST 1.1 和EORTC两个疗效评价标准,研究18F-FDG PET/CT在评价索拉非尼治疗RR-DTC疗效中的作用。
1 资料和方法
1.1 设计和对象
本研究为回顾性研究。研究对象纳入标准为2011年至2014年接受索拉非尼治疗3个月以上的RR-DTC患者,且在治疗前1周内和持续治疗近3个月后18F-FDG PET/CT扫描需在同一机器上进行。RR-DTC的定义为:至少1个病灶不摄碘;或者病灶摄碘,131I治疗后的16个月内出现疾病进展;或者累计131I的治疗剂量超过600 mCi[6]。所有患者在索拉非尼治疗前12个月都已证实出现了疾病进展,并且已行TSH抑制治疗(TSH< 0.1 mIU/L)。索拉非尼的服用剂量(200 mg,每天2次)和随访方案按照我们之前的报道进行[16]。本研究通过了上海交通大学附属第六人民医院伦理委员会的批准。所有患者都签订了知情同意书。
1.218F-FDG PET/CT显像
检查前患者空腹6 h以上,血糖低于8.3 mmol/L。18F-FDG(上海欣科有限公司提供)的注射剂量为4.44 MBq/kg(0.12 mCi/kg),注射后患者饮水600 mL,静卧约1 h后排尿,采用美国GE公司Discovery VCT PET/CT仪进行PET/CT扫描。
扫描范围包括颅顶至股骨中段,必要时加扫双下肢。CT扫描参数为:电压120 kV,电流220 mA;64 层;层厚为3.75 mm。采用三维模式采集进行PET扫描,1.5~2 min/床位,采集6~7个床位。PET图像采用OSEM重建,用CT扫描数据对PET图像进行衰减校正。
1.3 图像分析及评价标准
图像分析由2名经验丰富的核医学科医师进行。在索拉非尼治疗前PET/CT的图像中选取18F-FDG摄取最高者为靶病灶(累计不超过5个)。在索拉非尼治疗后近3个月的检查中针对这些病灶进行随访。采用病灶最大标准化摄取值(SUVmax)作为18F-FDG摄取定量指标,RECIST评价体系的靶病灶与EORTC评价体系的一致,分别采用所有靶病灶的直径之和及SUVmax之和(∑SUVmax)的变化百分比进行疗效评价。如果经过18F-FDG PET/CT显像监测后仍然表现为临床进展的患者,告知患者终止治疗。继续索拉非尼治疗的患者每3个月进行CT检查,产生治疗后的PFS。
按照RECIST 1.1的标准,完全缓解(complete response,CR)定义为所有靶病灶均消失;部分缓解(partial response,PR)定义为所有靶病灶的直径之和下降至少30%;疾病进展(progressive disease,PD)定义为所有靶病灶的直径之和增加至少20%并且绝对值增加至少5 mm或者出现新的病灶;CR、PR、PD之外则定义为疾病稳定(stable disease,SD)[11]。
按照E R O T C的标准,完全代谢缓解(complete metabolic response,CMR)定义为所有靶病灶的18F-FDG均消退;部分代谢缓解(partial metabolic response,PMR)定义为治疗后∑SUVmax下降至少25%;代谢进展(progressive metabolic disease,PMD)为∑SUVmax增加至少25%或者出现新的18F-FDG摄取病灶;介于PMR和PMD之间则定义为代谢稳定(stable metabolic disease,SMD)[17]。
1.4 统计学处理
使用SPSS16.0统计软件对数据进行统计分析。用Wilcoxon符号秩和检验分析靶病灶直径之和与∑SUVmax变化百分比的差异。按照2种标准分别对疗效反应进行评分。按照RECIST 1.1标准:CR-1、PR-2、SD-3、PD-4 ;按照EORTC标准:CMR-1、PMR-2、SMD-3、PMD-4 。用χ2检验比较2种评分有无差异。
由于出现新病灶,按照2种标准均定义为疾病进展。为了比较PET和CT在疗效反应评价中的差异,将因出现新病灶而评价为PD/PMD的患者排除在外,其余患者按照RECIST 1.1分组为PR和SD,比较这两组∑SUVmax变化百分比的差异。
用Wilcoxon秩和检验比较按照RECIST 1.1 或EORTC 标准不同反应组间的PFS有无差异。用Spearman秩相关评估PFS与形态学(RECIST 1.1)或功能学(EORTC criteria)反应分组的相关系数。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
根据纳排标准,共有14例患者符合要求,相关资料见表1。索拉非尼治疗前所有患者均经手术、131I和TSH抑制治疗。疾病的累及范围包括淋巴结、肺、颈部、胸膜和骨骼。

表 1 RR-DTC患者的一般情况Tab.1 Patients demographic and baseline characteristics
18F-FDG PET/CT检查的时间分别是在索拉非尼之前(5.0±3.0)d和治疗后的(90.0±12.0)d,2次的间隔时间为(96.5±8.0)d。索拉非尼治疗前和治疗近3个月平均摄取时间分别是(59.7±2.8 min和(59.2±3.3)min,2次的平均摄取时间差异无统计学意义(t=0.368,P=0.719)。随访观察时间2.8~17.6个月。所有患者均有不同程度的脱发,4名患者出现手-足皮肤反应,3例患者出现皮疹。所有患者的不良反应均可耐受,都进行了相应的临床处理,治疗过程中未减药、停药。
2.218F-FDG PET/CT 的疗效评价
根据2种评价标准,患者的治疗反应结果见表2。按照RECIST 1.1,无患者达到CR,2例达到PR,8例为SD和4例为PD;按照EORTC标准,无患者达到CMR,4例为PMR,4例为SMD,6例为PMD。14例患者中,10例(71.4%)的两种评价结果一致。评价结果不一致的4例中,2例(7、10号患者)为SD/PMR(图1),2例(1、11号患者)为SD/PMD(图2)。不同反应组间靶病灶直径之和与∑SUVmax变化百分比差异无统计学意义(Z=-0.408,P=0.683),按照2种评价标准的反应分组结果差异无统计学意义(χ2=2.345,P=0.424)。将4例因为新病灶的出现而评价为PD/PMD的患者排除在外,其余患者按照RECIST 1.1分组为PR和SD,这两组反应评价分组差异仍无统计学意义(χ2=3.551,P=0.221)。
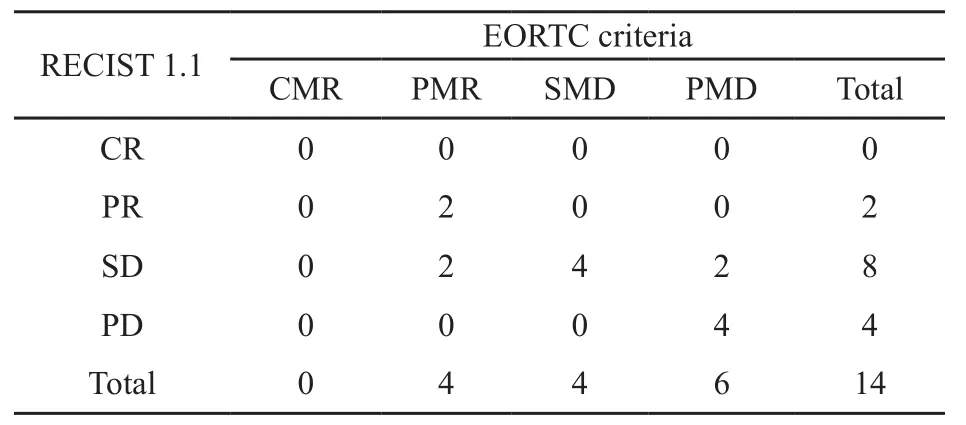
表 2 对比RECIST 1.1和EORTC标准的治疗反应分组Tab.2 Comparison of the treatment response assessments by RECIST 1.1 and EORTC criteria

图 1 2种评价标准评价不一致的SD/PMD患者Fig.1 Discrepancy of therapeutic responses(SD/PMD)in terms of RECIST 1.1 and EORTC criteria
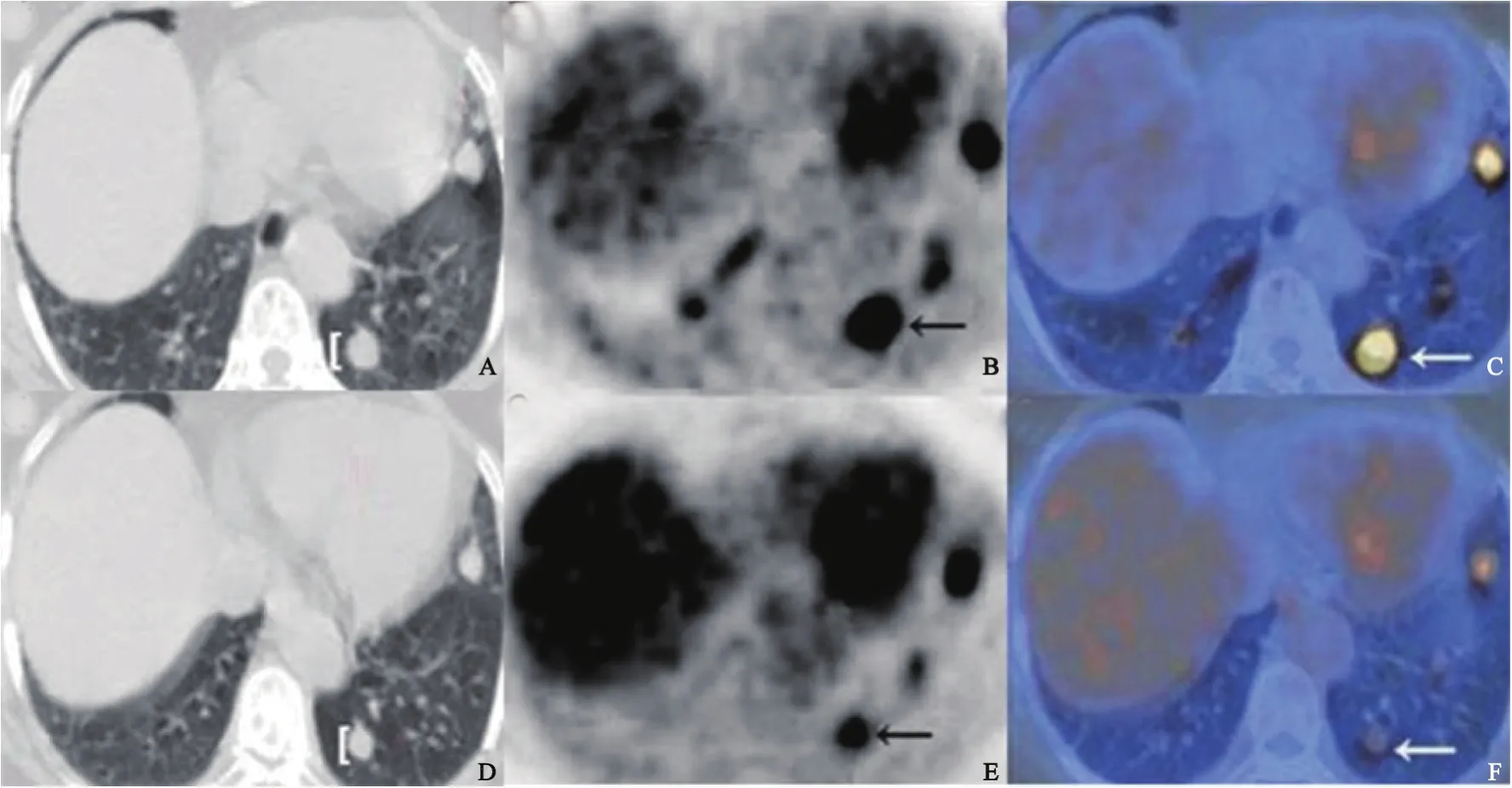
图 2 2种评价标准评价不一致的SD/PMR患者Fig.2 Discrepancy of therapeutic responses(SD/PMR)in terms of RECIST 1.1 and EORTC criteria
2.318F-FDG PET/CT的预后价值
按照RECIST 1.1 反应分组,PR、SD和PD三组的PFS中位数分别是13.55、8.05和3.20个月。按照EORTC反应分组,PMR、SMD和PMD三组的PFS中位数分别是13.55、9.55和3.35个月。无论是按照RECIST 1.1(χ2=8.571,P=0.003)还是按照EORTC标准(χ2=8.781,P=0.003),各反应组间的PFS均有差异。
PFS既与形态学评价结果相关(r=0.741,P=0.002),也与代谢学评价结果相关(r=0.816,P=0.000 4),PFS与代谢学评价结果相关性更高。1号和11号患者的评价结果是SD/PMD,他们的PFS分别是5.7和4.5个月,短于SD/SMD患者的PFS中位数(9.55个月)。而SD/PMR的患者(7和10号)PFS分别是10.4和17.6个月,明显长于SD/SMD患者的PFS中位数。
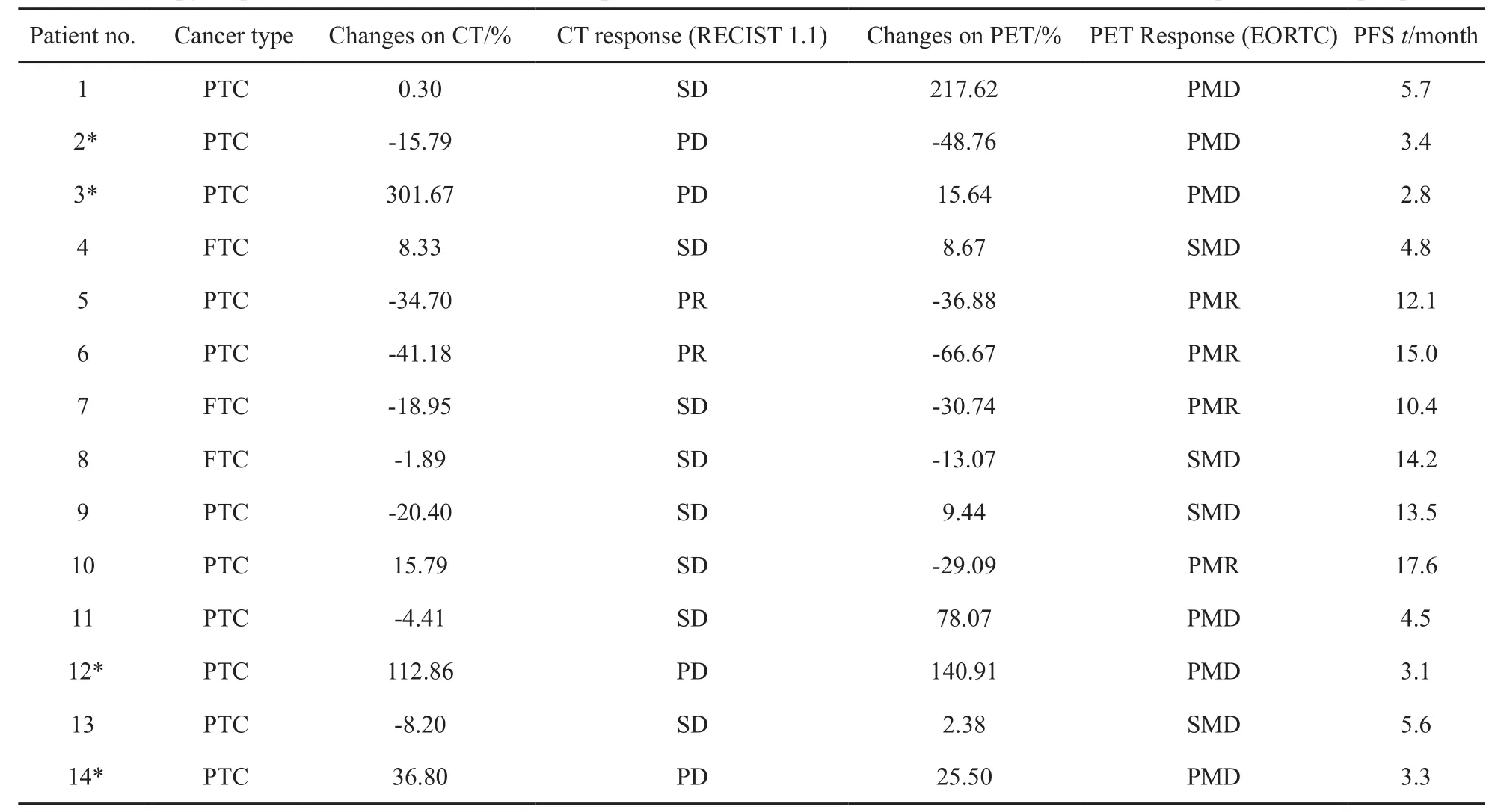
表 3 按照RECIST 1.1和EORTC标准14例RR-DTC患者的治疗反应情况(每个患者最多取5个病灶)Tab.3 Therapy response assessments of 14 RR-DTC patients based on the RECIST 1.1 and EORTC criteria(up to 5 lesions per patient)
3 讨 论
肿瘤的疗效评价标准一直是阻碍确定肿瘤治疗最佳策略的因素之一。在淋巴瘤[18-19]和其他实体瘤[20-25]疗效评价中,基于PET/CT的疗效评价标准的价值已经得到公认。在评价肿瘤靶向治疗的反应时,肿瘤大小未有明显变化而肿瘤代谢活动已改变十分常见[14-15,26-28]。本研究的目的是通过对比RECIST 1.1和EORTC 2个疗效评价标准,研究18F-FDG PET/CT在评价索拉非尼治疗RR-DTC中的作用,同时检测PFS与疗效评价结果的相关性。我们发现,在71.4%患者中,两种标准的评价结果是一致的,差异并无统计学意义。去除因为出现新病灶而被定义为PD/PMD的4例患者,其余10例的评价结果差异也没有统计学意义。PFS既与形态学评价结果相关,也与代谢学评价结果相关,且与代谢学评价结果相关性更高。在评价结果不一致的4例中,2例为SD/PMR,2例为SD/PMD。结合这4例患者的PFS,代谢学评价结果似乎更为准确。我们的研究表明,18F-FDG PET/CT对索拉非尼治疗RR-DTC的疗效评价是有价值的。尽管71.4%的患者RECIST 1.1和EORTC标准结果一致,但是基于PET的代谢学评价标准在预测治疗效果方面更为准确,可能比形态学评价标准更适合用于靶向治疗的疗效评估和预后判断。
在肿瘤的化疗领域,Ding等[24]的研究中,44例非小细胞肺癌(non-small cell lung cancer,NSCLC)患者化疗后使用了RECIST和PET实体瘤反应标准(PET response criteria in solid tumors,PERCIST)两种标准去评价,他们的研究表明PERCIST(或PET)能更敏感地发现CMR和PMD患者。在Yanagawa等[25]的研究中,51例接受辅助化疗后的局部晚期食管癌的患者,PERCIST和RECIST的疗效评价结果,前者的CR患者明显多于后者。以上2个研究均表明PET比CT能更敏感地发现治疗反应组和无效组。原因可能是肿瘤治疗后代谢学改变比形态学变化更敏感,而PET恰恰能检测出这一种变化。与肿瘤的化疗领域相比,在靶向治疗这一新型肿瘤治疗领域中使用RECIST和PET的评价标准进行疗效评价对比的研究几乎没有。
最近我们的体外研究已经证实索拉非尼或卡博替尼可以降低分化型甲状腺癌细胞的活力,并且通过抑制葡萄糖转运体的表达降低葡萄糖代谢水平[29]。这项研究为使用18F-FDG PET对RR-DTC患者的靶向治疗进行疗效评价奠定了可靠的理论基础。之前已有2个探索性研究用18F-FDG PET对RR-DTC 靶向治疗后的早期疗效进行评价,均发现FDG的早期摄取变化具有预测治疗效果的价值[14-15]。Carr等[14]发现舒尼替尼治疗7 d后不同反应组的平均SUV中位数差异有统计学意义。随后,Marotta等[15]的研究中患者索拉非尼治疗前7 d内和治疗后15 d均做了18F-FDG PET检查,发现FDG-PET能更早期地发现治疗反应组和无效组。我们的研究选择了治疗后近3个月时进行18F-FDG PET疗效评估检查,此时代谢学和形态学反应均已出现,从而使RECIST 1.1和EORTC标准进行疗效对比具备了可能,研究结果支持了之前的两项探索性研究。
尽管有71.4%的患者2种评价结果是一致的,但是28.6%的患者按照RECIST 1.1是SD,而按照EORTC标准是PMR或PMD。此外,SD/PMD患者的PFS要小于SD/SMD的患者,SD/PMR 的PFS要大于SD/SMD的患者。正如图1和图2所示,两图充分显示了PET在发现虽然是SD但是可以从索拉非尼中获益或无效的患者。而且代谢学评价结果比形态学评价结果与PFS的相关性更大些。18F-FDG PET/CT可以同时提供代谢学和形态学信息,在评价RR-DTC对索拉非尼治疗效果方面价值超出单纯进行CT形态学评估检查。
作为广泛使用的肿瘤评价标准,RECIST 1.1存在些缺陷[30]。因为肿瘤的代谢学变化与肿瘤的恶性特性密切相关,18F-FDG PET可能在评价RR-DTC的疾病分期和疗效反应方面似乎更准确[31-32]。由于PERCIST使用的是SUV用去脂体质量校正后的值SUL,使用起来更为复杂,很难获得广泛的应用[30],而EORTC标准使用的是SUV,用全身体质量校正后的SUVmax和SUVmean,更容易推广普及[17]。Jadvar等[33]已经发现转移性前列腺癌去势治疗后∑SUVmax可以用来预测患者的总体生存时间。他们的研究发现,在预测总体生存时间的单因素分析时,多个参数与之相关。然而,在校正临床相关因素后的多因素分析时,只有∑SUVmax是一个明显的独立的预后因素。我们的研究中使用的是选取最多5个靶病灶的SUVmax之和(∑SUVmax)来评估疗效。∑SUVmax较SUVmax的优势可能在于前者包括了全身多个活跃病灶,能更稳定、准确和全面地评估疗效。
本研究为回顾性研究,但是所有患者的治疗方案和PET/CT的检查方案基本一致。由于进展性的RR-DTC发病率较低,且本研究严格执行的纳入标准,尽可能做到基线和随访检查的条件齐同,最终只有14例患者入组,一定程度上存在选择偏倚,需要后续更大样本的研究予以进一步证实。
综上所述,18F-FDG PET/CT对RR-DTC索拉非尼治疗后的疗效评价是有价值的。尽管71.4%的患者RECIST 1.1 和 EORTC 标准结果一致,但是基于PET的代谢学评价标准在预测治疗效果方面更为准确,可能比形态学评价标准更适合用于靶向治疗的疗效评估。
[参考文献]
[1]ITO Y, NIKIFOROV Y E, SCHLUMBERGER M, et al.Increasing incidence of thyroid cancer:Controversies explored[J].Nat Rev Endocrinol, 2013, 9(3):178-184.
[2]AMERICAN THYROID ASSOCIATION(ATA)GUIDELINES TASKFORCE ON THYROID NODULES AND DIFFERENTIATED THYROID CANCER, COOPER D S, DOHERTY G M, et al.Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J].Thyroid, 2009, 19(11):1167-1214.
[3]SCHLUMBERGER M J.Papillary and follicular thyroid carcinoma[J].N Engl J Med, 1998, 338(5):297-306.
[4]DURANTE C, HADDY N, BAUDIN E, et al.Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma:Benefits and limits of radioiodine therapy[J].J Clin Endocrinol Metab, 2006, 91(8):2892-2899.
[5]LIU M, RUAN M, CHEN L.Update on the molecular diagnosis and targeted therapy of thyroid cancer[J].Med Oncol, 2014, 31(6):973.
[6]BROSE M S, NUTTING C M, JARZAB B, et al.Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer:a randomised, double-blind, phase 3 trial[J].Lancet, 2014, 384(9940):319-328.
[7]CARLOMAGNO F, ANAGANTI S, GUIDA T, et al.Bay 43-9006 inhibition of oncogenic ret mutants[J].J Natl Cancer Inst, 2006, 98(5):326-334.
[8]WILHELM S M, CARTER C, TANG L, et al.Bay 43-9006 exhibits broad spectrum oral antitumor activity and targets the raf/mek/erk pathway and receptor tyrosine kinases involved in tumor progression and angiogenesis[J].Cancer Res, 2004, 64(19):7099-7109.
[9]SCHLUMBERGER M, TAHARA M, WIRTH L J, et al.Lenvatinib versus placebo in radioiodine-refractory thyroid cancer[J].N Engl J Med, 2015, 372(7):621-630.
[10]THERASSE P, ARBUCK S G, EISENHAUER E A, et al.New guidelines to evaluate the response to treatment in solid tumors.European Organization for Research and Treatment of Cancer, National Cancer Institute of the United States, National Cancer Institute of Canada[J].J Natl Cancer Inst, 2000, 92(3):205-216.
[11]EISENHAUER E A, THERASSE P, BOGAERTS J, et al.New response evaluation criteria in solid tumours:Revised recist guideline(version 1.1)[J].Eur J Cancer, 2009, 45(2):228-247.
[12]RUAN M, SHEN Y, CHEN L, et al.Recist 1.1 and serum thyroglobulin measurements in the evaluation of responses to sorafenib in patients with radioactive iodine-refractory differentiated thyroid carcinoma[J].Oncol Lett, 2013, 6(2):480-486.
[13]SHEN Y, RUAN M, LUO Q, et al.Brain metastasis from follicular thyroid carcinoma:treatment with sorafenib[J].Thyroid, 2012, 22(8):856-860.
[14]CARR L L, MANKOFF D A, GOULART B H, et al.Phase Ⅱ study of daily sunitinib in FDG-PET-positive, iodinerefractory differentiated thyroid cancer and metastatic medullary carcinoma of the thyroid with functional imaging correlation[J].Clin Cancer Res, 2010, 16(21):5260-5268.
[15]MAROTTA V, RAMUNDO V, CAMERA L, et al.Sorafenib in advanced iodine-refractory differentiated thyroid cancer:Efficacy, safety and exploratory analysis of role of serum thyroglobulin and FDG-PET[J].Clin Endocrinol(Oxf), 2013, 78(5):760-767.
[16]CHEN L, SHEN Y, LUO Q, et al.Response to sorafenib at a low dose in patients with radioiodine-refractory pulmonary metastases from papillary thyroid carcinoma[J].Thyroid, 2011, 21(2):119-124.
[17]YOUNG H, BAUM R, CREMERIUS U, et al.Measurement of clinical and subclinical tumour response using[18f]-fluorodeoxyglucose and positron emission tomography:Review and 1999 EORTC recommendations.European Organization for Research and Treatment of Cancer(EORTC)pet study group[J].Eur J Cancer, 1999, 35(13):1773-1782.
[18]CHESON B D.Role of functional imaging in the management of lymphoma[J].J Clin Oncol, 2011, 29(14):1844-1854.
[19]CHESON B D, PFISTNER B, JUWEID M E, et al.Revised response criteria for malignant lymphoma[J].J Clin Oncol, 2007, 25(5):579-586.
[20]VAN DEN ABBEELE A D.The lessons of GIST--PET and PET/CT:A new paradigm for imaging[J].Oncologist, 2008, 13(Suppl 2):8-13.
[21]LORDICK F, OTT K, KRAUSE B J, et al.PET to assess early metabolic response and to guide treatment of adenocarcinoma of the oesophagogastric junction:the municon phase Ⅱ trial[J].Lancet Oncol, 2007, 8(9):797-805.
[22]SKOUGAARD K, NIELSEN D, JENSEN B V, et al.Comparison of EORTC criteria and PERCIST for PET/CT response evaluation of patients with metastatic colorectal cancer treated with irinotecan and cetuximab[J].J Nucl Med, 2013, 54(7):1026-1031.
[23]CAMACHO J C, KOKABI N, XING M, et al.PET response criteria for solid tumors predict survival at three months after intra-arterial resin-based 90 Yttrium radioembolization therapy for unresectable intrahepatic cholangiocarcinoma[J].Clin Nucl Med, 2014, 39(11):944-950.
[24]DING Q, CHENG X, YANG L, et al.PET/CT evaluation of response to chemotherapy in non-small cell lung cancer:Pet response criteria in solid tumors(PERCIST)versus response evaluation criteria in solid tumors(recist)[J].J Thorac Dis, 2014, 6(6):677-683.
[25]YANAGAWA M, TATSUMI M, MIYATA H, et al.Evaluation of response to neoadjuvant chemotherapy for esophageal cancer:PET response criteria in solid tumors versus response evaluation criteria in solid tumors[J].J Nucl Med, 2012, 53(6):872-880.
[26]MINAMIMOTO R, NAKAIGAWA N, TATEISHI U, et al.Evaluation of response to multikinase inhibitor in metastatic renal cell carcinoma by FDG PET/contrast-enhanced CT[J].Clin Nucl Med, 2010, 35(12):918-923.
[27]LEE J H, PARK J Y, KIM DO Y, et al.Prognostic value of18F-FDG PET for hepatocellular carcinoma patients treated with sorafenib[J].Liver Int, 2011, 31(8):1144-1149.
[28]CONTRACTOR K B, ABOAGYE E O.Monitoring predominantly cytostatic treatment response with18F-FDG PET[J].J Nucl Med, 2009, 50(Suppl 1):97-105.
[29]VAN GOOL M H, AUKEMA T S, SCHAAKE E E, et al.Timing of metabolic response monitoring during erlotinib treatment in non-small cell lung cancer[J].J Nucl Med, 2014, 55(7):1081-1086.
[30]WAHL R L, JACENE H, KASAMON Y, et al.From RECIST to PERCIST:Evolving Considerations for PET response criteria in solid tumors[J].J Nucl Med, 2009, 50(Suppl 1):122-150.
[31]SLOOF G W.Response monitoring of neoadjuvant therapy using CT, EUS, and FDG-PET[J].Best Pract Res Clin Gastroenterol, 2006, 20(5):941-957.
[32]JUWEID M E, CHESON B D.Positron-emission tomography and assessment of cancer therapy[J].N Engl J Med, 2006, 354(5):496-507.
[33]JADVAR H, DESAI B, JI L, et al.Baseline18F-FDG PET/CT parameters as imaging biomarkers of overall survival in castrate-resistant metastatic prostate cancer[J].J Nucl Med, 2013, 54(8):1195-1201.
收稿日期:(2015-11-30 修回日期:2015-12-28)
通信作者:陈立波 E-mail:libochen888@hotmail.com
基金项目:国家自然科学基金(81271609);上海市科技启明星(12QH1401600)。
中图分类号:R736.1
文献标志码:A
文章编号:1007-3639(2016)01-0088-09
DOI:10.3969/j.issn.1007-3969.2016.01.014
