欧拉藏羊肉成熟过程中Hsp70对细胞凋亡酶活性的影响
2016-04-07张琛1李婕1袁有云2中拉毛草3师希雄马娅俊1卢得元1
张琛1,李婕1,袁有云2,中拉毛草3,师希雄※1,马娅俊1,卢得元1
(1.甘肃农业大学,2.甘肃中天羊业有限公司,3.甘南州动物疾病预防控制中心)国家自然基金:31460433资助
欧拉藏羊肉成熟过程中Hsp70对细胞凋亡酶活性的影响
张琛1,李婕1,袁有云2,中拉毛草3,师希雄※1,马娅俊1,卢得元1
(1.甘肃农业大学,2.甘肃中天羊业有限公司,3.甘南州动物疾病预防控制中心)国家自然基金:31460433资助
为了研究欧拉藏羊肉宰后成熟过程中热休克蛋白 70(heat shock protein 70, Hsp70) 的变化和细胞凋亡酶(Caspase-3;Caspase-6;Caspase-8;Caspase-9)的活性变化及其相关性,测定了16只甘南欧拉母藏羊背最长肌肉成熟过程中 Hsp70 的表达量以及细胞凋亡酶的活性,进一步研究了 Hsp70 与细胞凋亡酶的关系。结果表明:Hsp70表达量总体呈降低的趋势,宰后0-12h Hsp70 表达量显著升高(P<0.05),12-24h Hsp70 表达量显著降低(P<0.05),之后不断下降,宰后168h 达到最小值;Hsp70的表达量与Caspase-8活力值显著正相关。证实了Hsp70 与细胞凋亡酶8之间存在显著相关性。
HSP70;细胞凋亡酶3;细胞凋亡酶6;细胞凋亡酶8;细胞凋亡酶9
藏羊(Tibetan sheep)在海拔3000m以上的高寒生态环境中成长,其洁净的环境和天然的牧草使藏羊具有广泛的市场前景[1]。但藏羊的嫩度较差,影响其食用品质,因而改善藏羊嫩度是肉品科学工作者的研究重点[2]。热休克蛋白(Heat Shock Proteins,HSPs)是指机体受到外界环境刺激时诱导发生应激反应而合成的几族蛋白质[3]。Hsp70是目前研究较多的一类热休克蛋白,具有分子伴侣、细胞保护、抗细胞凋亡、免疫等作用,大量研究表明,它能够直接抑制细胞凋亡的内在和外在路径[4-5]。但目前Hsp70在藏羊肉成熟过程中对细胞凋亡酶活性的影响研究还未见报道。
Guillemin[6]通过基因组学等分析牛肉嫩化的细胞途径时发现,在半腱肌中发现Hsp70与肉嫩度强负相关。Angelo[7]在研究蛋白组学和基因组学与母犊牛肉背最长肌嫩度的关系时发现,Hsp70含量与牛肉剪切力正相关,与肌节长度、肌原纤维小片化指数(MFI48h、MFI10d)负相关;Picard[8]报道,Hsp70是一类能特异性表达、具有抗细胞凋亡功能的热休克蛋白,其表达量的下降引起了肉剪切力值的降低。Yang[9]研究报道,用NaN3处理经过单层融合、成肌细胞融合等前处理的细胞,细胞内 Hsp70的表达量增加。
因此,本试验以16头2-4岁健康欧拉母藏羊背最长肌肉为研究对象,对其宰后成熟过程中0、24、48、72、120、168h的Hsp70表达量变化和Caspase-3、Caspase-6、Caspase-8、 Caspase-9活性进行测定,并对Hsp70表达量变化与细胞凋亡酶活性进行相关性分析,以便为藏羊肉成熟机理研究提供理论依据。
1、材料与方法
1.1 材料与试剂
试验选取2-4岁健康欧拉母藏羊16只的背最长肌作为试验材料,RIPA组织/细胞裂解液、PMSF(苯甲基磺酰氟)北京索莱宝科技有限公司(Solarbio)Sheep heat shock protein 70 ELISA kit ,美国BD公司;DC蛋白测定试剂盒美国Bio-Rad伯乐公司。
1.2 仪器与设备
TGL-16M高速台式冷冻离心机(长沙湘仪有限公司);FA2004B电子天平(上海佑科仪器有限公司);HHS(数显式)型电热恒温水浴锅(上海博讯实业有限公司医疗设备厂);iMarK全自动酶标仪(美国Bio-Rad伯乐公司)。
1.3 试验设计
将选取的藏羊背最长肌肉切割成约50g的小块,用聚氯乙烯保鲜袋包装后在0-4℃条件下成熟 0h、24h、48h、72h、120h、168h,在不同的时间点分别取样,取样后保存在-80℃冰箱中,用于Hsp70表达量及细胞凋亡酶活力的测定。
1.4 试验方法
1.4.1 Hsp70表达量的检测
1.4.1.1 蛋白样品的制备
参考Salokhe[10]的方法将保存于-80℃冰箱中的样品取出,准确称取100mg组织置于研钵中, 加入液氮迅速、充分研磨成粉状,然后将研磨的组织粉末转移到玻璃匀浆器中,加入RIPA裂解缓冲液1.0mL(含蛋白酶抑制剂),匀浆,以充分裂解组织细胞;将匀浆液移至eppendorf管中, 静置10min,12000g于4℃离心20min:将上清液移至另一EP管中按照每管200μl分装, -20℃保存备用。所有操作均在冰浴中进行。按照试剂盒说明书,将保存于4℃冰箱中的试剂盒取出,室温下放置30min后,对HSP及内参(β-actin) 进行ELISA检测。
1.4.1.2 Hsp70的定量检测
参考Yu等[11]的方法采用酶联免疫吸附测定(ELISA)分析法检测Hsp70的表达量。将提前保存于4℃冰箱的试剂盒取出,室温下放置30min后,对Hsp70进行ELISA试验检测。用酶标仪在450nm下测定吸光度(OD值),计算样品浓度。
标准曲线的绘制:在Excel工作表中,以标准品浓度为横坐标,相对应的OD值为纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样品浓度值。
1.4.2 细胞凋亡酶3活力的检测
将保存于-80℃冰箱中的肉样取出,剪碎,加入液氮研磨,称取0.09g样品粉末,加入150μL裂解缓冲液震荡,匀浆,以充分裂解组织细胞,匀浆液离心15min(10000×g,4℃),取上清液,运用Caspase-3 活性检测试剂盒和酶标仪测定其表达量及活性。
1.4.3 细胞凋亡酶8活力的检测
将保存于-80℃冰箱中的肉样取出,剪碎,加入液氮研磨,称取0.09g样品粉末,加入150μL裂解缓冲液震荡,匀浆,以充分裂解组织细胞,匀浆液离心15min(10000×g,4℃),取上清液,运用Caspase-8活性检测试剂盒和酶标仪测定其表达量及活性。
1.4.4 细胞凋亡酶6活力的检测
将保存于-80℃冰箱中的肉样取出,剪碎,加入液氮研磨,称取0.09g样品粉末,加入150μL裂解缓冲液震荡,匀浆,以充分裂解组织细胞,匀浆液离心15min(10000×g,4℃),取上清液,运用Caspase-6 活性检测试剂盒和酶标仪测定其表达量及活性。
1.3.5 细胞凋亡酶9活力的检测
将保存于-80℃冰箱中的肉样取出,剪碎,加入液氮研磨,称取0.09g样品粉末,加入150μL裂解缓冲液震荡,匀浆,以充分裂解组织细胞,匀浆液离心15min(10000×g,4℃),取上清液,运用Caspase-9 活性检测试剂盒和酶标仪测定其表达量及活性。
1.5 数据分析
用Microsoft Office Excel 2013绘制折线图,并用IBM SPSS Statistics 19.0统计分析软件进行方差分析和相关性分析,用Duncan 法进行多重比较。
2 、结果与分析
2.1 藏羊肉成熟过程中Hsp70表达量的变化

图1 Hsp70表达量的变化
从图1可以看出,在成熟7天的过程中,藏羊肉热休克蛋白70表达量总体呈现逐渐减小的趋势。Hsp70作为分子伴侣,通过结合受损的以及错误折叠的蛋白质来保护细胞内蛋白,防止不可逆损伤或聚集,最终导致组织中 Hsp70浓度下降[12]。张淼[13]等研究表明,猪背最长肌在运输应激过程中Hsp70表达量呈现下降的趋势,本实验结果与张淼的结果相近。藏羊肉在成熟过程中,Hsp70表达量出现短暂的回升,可能由于溶解抑制得以解除造成的。
2.2 藏羊肉成熟过程中细胞凋亡酶3活力的变化
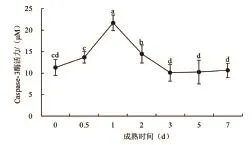
图2 细胞凋亡酶3活力变化
细胞凋亡酶3参与对细胞蛋白的降解并促使细胞凋亡,被称为凋亡效应因子或细胞凋亡效应酶。由图2可以看出,在成熟7d的过程中,藏羊肉细胞凋亡酶3活力值总趋势呈现先增大后减小,在0到0.5d细胞凋亡酶3活力值先稍有增加,0.5d后开始大幅上升,1d时达最大值,在1d到3d其活力值急剧减小,3d时达最小值,之后趋于平稳。这与孙志昶[14]得到宰后1d caspase-3活力达最高值结论基本一致。
2.3 藏羊肉成熟过程中细胞凋亡酶6活力的变化
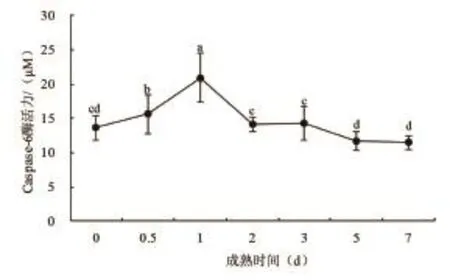
图3 细胞凋亡酶6活力的变化
由图4可以看出,藏羊肉在成熟7d的过程中,细胞凋亡酶6活性在宰后0d到1d呈明显上升趋势,1d时其活力值达最大,之后大幅下降,2d到3d趋于平稳,3d至5d有所下降,5d以后趋于平稳,第7天达到最小值。这与黄峰[15]研究的凋亡效应酶3只能在宰后早期具有活性作用结论基本一致。
2.4 藏羊肉成熟过程中细胞凋亡酶8活力的变化
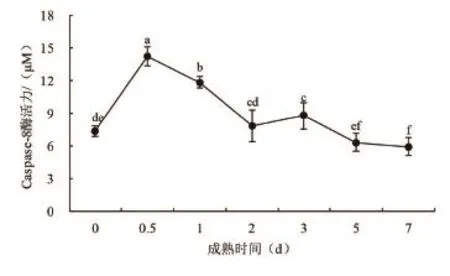
图4 细胞凋亡酶8活力的变化
由图3可以看出,在成熟7d的过程中,藏羊肉细胞凋亡酶8活力值在前0.5d大幅度上升,0.5d时达最大值。随后0.5d到2d大幅度下降,2d后有小幅度上升,从第3d开始总体呈下降趋势,宰后5d降低程度又减小,7d 达到最小值。
2.5 藏羊肉成熟过程中细胞凋亡酶9活力的变化
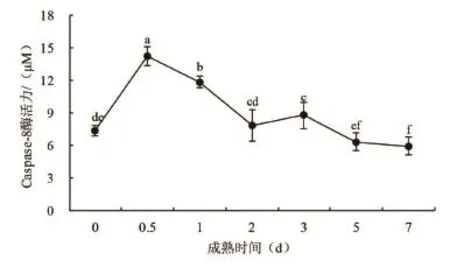
图5 细胞凋亡酶9的活力变化
由图5可以看出,在藏羊肉成熟7d的过程中,细胞凋亡酶9活性在宰后0到0.5d呈明显上升趋势,0.5d时达最高值,0.5d以后呈明显下降趋势,5d后趋于稳定。凋亡酶8、9、10只参与细胞凋亡的启动,被称为启动因子或细胞凋亡启动酶。而Caspase-8和Caspase-9活性出现最大值均在宰后0.5d,早于Caspase-3的活力最高点。这与孙志昶(2014)得到的结果存在分歧,可能与测定方法或物种有关,但具体原因还有待进一步的验证。
2.6 Hsp70表达量与Caspase-3 、Caspase-6、Caspase-8、Caspase-9活性的相关性分析

表1 HSP70表达量与Caspase-3 、Caspase-6、Caspase-8、 Caspase-9活性的相关性分析
由表1可知,在欧拉藏羊肉成熟过程中,Hsp70的表达量与Caspase-8活力值显著正相关(P<0.05),与其他酶相关性不显著。由此说明,Hsp 70对细胞凋亡酶8的活性有显著影响。
3 、结论
(1)藏羊肉在成熟过程中,藏羊肉热休克蛋白70表达量值总体呈现减小的趋势, 7d后降到最小值。
(2)藏羊肉成熟过程中细胞凋亡酶3、6、8、9的活性随成熟时间的延长呈现先增大后降低的趋势。
(3)藏羊肉成熟过程中,Hsp70的表达量与Caspase-8的活力值相关性显著(P<0.05),由此说明,Hsp70表达量对细胞凋亡酶8的活性有显著影响。
[1]王杰,王永,欧阳熙,等.藏山羊肉品质研究[J].四川草原,2002,(2):50-53.
[2]李婕,师希雄,韩玲,余群力,马君义,金现龙. 热休克蛋白对宰后成熟过程中肉品质影响的研究进展[J]. 食品工业科技,2016,37,(01):392-396.
[3]蒲力群,王逢会,霍满鹏,等.热休克蛋白的研究进展[J].延安大学学报(自然科学版), 2008, 27(1): 72-75.
[4]王宇萍,蒋建东.热休克蛋白70的结构和功能[J].中国细胞生物学报, 2010, 32(2): 305-313.
[5] Lomiwes D, Farouk M M, Wiklund E, et al. Small heat shock proteins and their role in meat tenderness: A review[J]. Meat Science, 2014, 96(1): 26-40.
[6] Guillemin N, Bonnet M, Jurie C, et al. Functional analysis of beef tenderness[J]. Journal of Proteomics, 2011, 75(2): 352-365.
[7] Angelo D A, Sara R, Cristina M, et al. Love me tender: An Omics window on the bovine meat tenderness network [J]. Journal of Proteomics, 2012, 75(14): 4360-4380.

[8] Picard B, Berri C, Lefaucheur L, et al. Skeletal muscle proteomics in livestock production[J]. Briefings in Functional Genomics, 2010, 9(3): 259-278.
[9] YANG Youbing, Pandurangan M, Hwang I. Changes in proteolytic enzymes m RNAs and proteins relevant for meat quality during myogenesis and hypoxia of primary bovine satellite cells[J]. In Vitro Cellular Development Biology Animal, 2012, 48(6): 359-368.
[10] Salokhe S, Sarkar A, Kulkarni A, et al. Flufenoxuron, an acylurea insect growth regulator, alters development of Tribolium castaneum (Herbst) (Coleoptera: Tenebrionidae) by modulating levels of chitin, soluble protein content, and HSP70 and p34 cdc2 in the larval tissues[J]. Pesticide Biochemistry and Physiology, 2006, 85(2): 84-90.
[11] YU Jimian, TANG Shu, BAO Endong, et al. The effect of transportation on the expression of heat shock proteins and meat quality of M. longissimus dorsi in pigs[J]. Meat Science, 2009, 83(3): 474-478.
[12] SUN Yu, Thomas H M. The small heat shock proteins and their role in human disease[J]. FEBS Journal, 2005, 272(11): 2613-2627.
[13] 张淼. 应激过程中组织和细胞内HSPs 表达与应激性损伤机理研究[D].南京:南京农业大学, 2011.
[14 ]孙志昶,冯晓琴,韩玲,赵会平,余群力.牦牛肉宰后成熟嫩化与细胞凋亡酶活力变化研究[J]. 农业机械学报,2014,30(08):81-88.
[15]黄峰. 细胞凋亡效应酶在牛肉成熟过程中的作用机制研究[D]. 南京: 南京农业大学, 2012.


