城市污水厂尾水对文蛤微核率、溶酶体膜稳定性及解毒酶活性的影响*
2016-04-06崔鸿武孟范平杜永祥苏恩萍
崔鸿武, 张 倩, 孟范平, 杜永祥, 苏恩萍
(中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100)
城市污水厂尾水对文蛤微核率、溶酶体膜稳定性及解毒酶活性的影响*
崔鸿武, 张倩, 孟范平**, 杜永祥, 苏恩萍
(中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100)
摘要:利用天然海水将取自青岛市团岛污水处理厂的尾水稀释为不同浓度(EVR=1%、5%、10%、20%、30%、40%)的混合液,对文蛤(Meretrix meretrix)进行15 d的暴露培养,并测定血细胞中的溶酶体膜稳定性(LMS)、微核率(MNF)以及鳃和内脏中I相解毒酶(7-乙氧基-3-异吩恶唑酮-脱乙基酶-EROD)和Ⅱ相解毒酶(谷胱甘肽转硫酶-GST)随EVR的变化。结果表明,各尾水处理组(即使EVR=1%)的血细胞LMS均明显低于对照水平(P<0.05);EVR≥20%的尾水造成血细胞MNF的显著诱导(P<0.05);然而,鳃、内脏中的EROD、GST活性仅在少数尾水处理组中被激活(P<0.05)。文蛤血细胞LMS对尾水暴露的响应敏感性及其与EVR之间的显著负相关性(R=-0.857,P< 0.05),使其适于作为纳污海域尾水污染的生物标志物。
关键词:城市污水处理厂(MSTPs);尾水;文蛤;解毒酶;微核率(MNF);溶酶体膜稳定性(LMS)
城市污水处理厂(MSTPs)尾水中含有重金属、多环芳烃(PAHs)、多氯联苯(PCBs)、农药、内分泌干扰物(壬基酚(NP)、双酚A (BPA)、三氯生(TCS)、17α-乙炔雌二醇(EE2)、17β-雌二醇(E2))、药物和个人护理用品(PPCPs,如磺胺吡啶、睾酮、布洛芬等)[1-3]等众多种类的痕量污染物,主要是因为现有的以A2O(厌氧-缺氧-好氧)为核心技术的污水处理工艺无法将这些污染物有效去除[2-4]。MSTPs的尾水大多就近或通过管道排入海域,成为近岸海域污染[5-6]的主要来源之一。这些种类繁多的痕量污染物进入海洋生物体后,可产生拮抗、相加、无关或协同等多种效应[7],研究这种复杂污染形势下海洋生物的生化响应,有助于分析尾水的致毒机制,并可为纳污海域的尾水污染预警提供适宜的生物标志物,因此近年来有关MSTPs尾水对海洋生物亚致死毒性研究受到国外学者的关注,其中,双壳类动物(沟纹蛤仔Ruditapesdecussatus[8]、浅沟蛤Scrobiculariaplana[9]、欧洲鸟尾蛤Cerastodermaedule[9]、地中海贻贝Mytilusgalloprovincialis[10]、悉尼岩牡蛎Saccostreaglomerata[11]等)被广泛用作指示生物。但是,中国有关尾水生态毒性研究的报道较少。文蛤是广泛分布于中国南北海区的双壳类动物,营固着生活,对污染物具有高富集性和高耐受性,因而常被作为环境污染的指示生物[12-14]。笔者于2014年先后报道了MSTPs尾水对文蛤(Meretrixmeretrix)抗氧化防御系统的影响[15]及类雌激素效应[16]。
外源污染物进入机体后的生物代谢转化是细胞解毒的关键,分为Ⅰ相与Ⅱ相2个反应阶段,7-乙氧基-3-异吩恶唑酮-脱乙基酶(EROD)和谷胱甘肽转硫酶(GST)分别是这2个阶段的重要代谢酶[17]。它们在尾水暴露下的活性变化,决定着生物体对污染物的清除能力。DNA是遗传信息的载体,其结构的任何变化都可能引起严重的生物学变化。暴露于某些药品(布洛芬[18]等)和PAHs、PCBs等有机污染物[19]后,双壳类动物均会发生遗传性损伤,表现为细胞微核率(MN frequency, MNF)增加、DNA链断裂等。双壳类动物血细胞中的溶酶体可与外源物质融合,并利用其中丰富的水解酶类将污染物水解而清除,因此在细胞免疫中发挥着重要作用[20-21]。环境污染物富集过多,会使溶酶体处于氧化胁迫中,溶酶体膜通透性增大甚至发生破裂,其中的水解酶类进入细胞质中,导致细胞损伤。因此,溶酶体膜稳定性(LMS)被认为是环境胁迫的生物标志物,常通过测定细胞内中性红保持时间(Neutral red retention time,NRRT)来表征[21-22]。但是,目前有关MSTPs尾水对海洋双壳类代谢酶、遗传性损伤、溶酶体膜稳定性的影响研究极少。
为了全面评价尾水对海洋双壳类动物的亚致死毒性,本研究以青岛海域常见的双壳类动物文蛤(M.meretrix)为研究对象,根据暴露于不同浓度尾水(由天然海水稀释为7种体积比(EVR))的文蛤鳃和内脏中EROD、GST活性以及血细胞MNF、LMS的变化,评价尾水暴露对文蛤代谢酶、遗传毒性和细胞总逆境的影响,为分析尾水对双壳类的亚致死毒性机制以及利用生物标志物进行纳污海域水质监测提供科学依据。
1材料与方法
1.1 实验动物驯养
文蛤购自青岛市崂山湾大管岛海域养殖区,挑选健康、大小基本一致(平均壳长4.0 cm)的蛤仔,在温度(15±1) ℃下,用天然清洁海水(取自青岛市石老人海域,pH=7.90±0.02,盐度32)驯养7 d 待用,期间每天更换新鲜海水,并投喂适量的海水小球藻(Chlorellapacifica),同时利用空气泵持续充氧,使DO保持在(6±0.5) mg·L-1。
1.2 尾水—海水混合液配制
尾水:采自青岛市团岛污水处理厂。该厂所接纳废水以生活污水为主,含少量食品工业废水。处理工艺为A2/O(厌氧-缺氧-好氧活性污泥法)+MBBR(膜生物反应器),污水日处理量约7.7×104m3,设计出水水质为《城镇污水处理厂污染物排放标准》(GB18918-2002)的一级A标准。实验期间,每天在污水处理厂尾水排放口采样,1次/6 h,将24 h内采集的4个尾水样品等体积混合,运回实验室后,于4 ℃保存,当天使用。
尾水与海水混合液:将新鲜采集的尾水静置沉淀1h,取上清液与天然清洁海水进行混合,使尾水体积比(EVR= V尾水/V混合液)依次为0%、1%、5%、10%、20%、30%、40%。然后,依次加入相应量的海水晶(山东省潍坊市海佳海水晶厂以纯净海水为原料生产),溶解混匀,使各处理组的盐度均保持为32。
1.3 暴露培养
每个处理组(包括对照组(EVR=0%),设3个平行,即3个玻璃缸(40 cm×20 cm×20 cm,有效容积10L)。每缸投放经过驯养的文蛤30只(预培养表明,投放密度≤30只/缸时,对文蛤的生长以及4种生化指标水平无显著影响),加入相应体积比的尾水—海水混合液,与驯养条件相同,连续培养15 d,每24 h 更换一次相应体积比的混合液,并定时定量投入离心得到的海水小球藻藻泥,作为文蛤饵料(对培养体系的体积影响甚微),投喂密度为1.3×107cells·L-1·d-1。培养结束时,从每个玻璃缸中随机取出15只动物个体,其中1只用于血细胞MNF测定;1只用于LMS测定;其余个体立即在冰上解剖,分离出鳃和内脏,切细混合均匀,作为一个平行样品(鳃和内脏不混合),于-80 ℃保存,用于酶学分析。
1.4 血细胞LMS测定
采用NRRT法[23]。对于每只文蛤,立即用注射器插入后闭壳肌血窦处吸取40 μL血淋巴液。将40 μL血淋巴液加到多聚赖氨酸处理过的载玻片上,在潮湿箱中放置约3 min,使血细胞附着。加入40 μL中性红使用液,潮湿放置15 min。盖上盖玻片,进行镜检,最初每隔15 min 镜检1次,当视野中约30%的细胞变红时,改为每隔5 min观察1次,记录因中性红渗漏到细胞浆中而使细胞变红的数量达到 50%的时间(min)。如果50%细胞变红出现在2个相邻时刻中间,则采用内插法计算50%细胞变红的时间并取整。
1.5 血细胞MNF测定
1.6 酶学分析
提取液制备:分别称取一定量的鳃和内脏,按质量体积比1∶4加入pH=7.8的Tris-HCl(0.02mol·L-1)缓冲溶液进行匀浆,然后,在转速10000r·min-1、温度4℃下离心15min,取上清液测定EROD和GST活性。
EROD活性测定:采用美国杰美基因公司生产的试剂盒测定。通过测定EROD催化下乙氧基异吩噁唑酮(ERF)转化为羟基异吩噁唑酮(RF)后的荧光峰值(Ex=550nm,Em=580nm)变化,定量EROD活性,单位为pmol·min-1·mg prot-1。
GST活性测定:参照Habig等[25]的方法。GST催化谷胱甘肽(GSH)与1-氯-2,4-二硝基苯(CDNB)结合,生成1-巯基-2,4-二硝基苯(GS-DNB)。根据波长340nm下测定GS-DNB吸光度的增加速度可计算GST活性。酶活力表示为每分钟催化生成产物的nmol数,单位为nmol·min-1·mg prot-1。

1.7 数据统计分析
对于每个处理组或对照组,酶活性均以3个平行样品测定值的(平均值±标准差)表示;MNF、LMS分别以3只文蛤(来自3个平行)测定值的(平均值±标准差)表示。
采用SPSS18.0软件进行数据分析,通过单因素方差分析中Games-Howell(方差非齐性)和Tukey(方差齐性)检验方法,分别对每种生化因子随EVR的变化程度进行差异显著性检验(P<0.05);同时,采用双变量Pearson相关性分析,研究生化因子之间以及它们与EVR之间的关系,统计显著性水平为P<0.05。
2结果
2.1 文蛤血细胞LMS的变化
由图1可见,尾水暴露结束时,文蛤血细胞的溶酶体膜稳定性随着EVR的增大而逐渐降低。NRRT以对照组最大(94min),即:溶酶体膜稳定性较高。尾水的存在能够造成NRRT大幅下降,EVR 1%、EVR40%的处理组中NRRT分别为70和22min,均与对照组差异显著(P<0.05)。虽然EVR5%与EVR10%、EVR20%与EVR30%之间的NRRT无显著差异,但是,它们的NRRT均显著低于对照组和EVR 1%处理组(P<0.05),而高于EVR40%处理组。
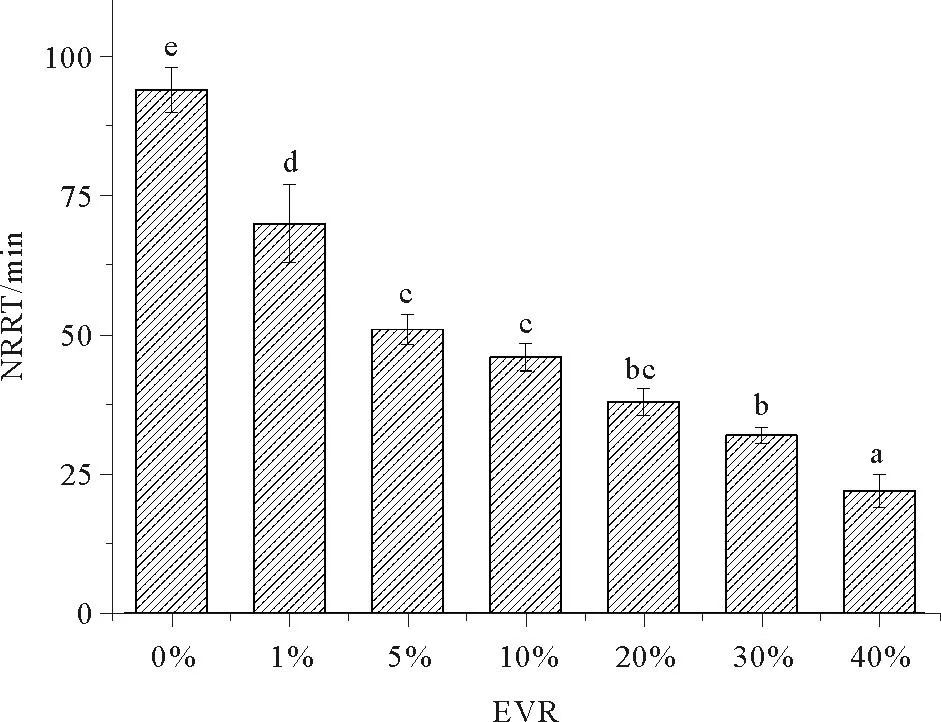
(标有不同字母的处理组间存在显著差异(P<0.05)。 Groups sharing different letters indicate significant differences (P<0.05).)
图1尾水暴露15 d后文蛤血细胞LMS
(以NRRT表示)随EVR的变化
Fig.1LMS values measured as the time (in minutes) to loss of
lysosomal retention of neutral red in 50% of scored cells in
haemocytes of clams (M.meretrix) exposed to serial dilutions
of MSTP effluents for 15 days
2.2 文蛤血细胞MNF的变化
图2中,尾水暴露15 d后,文蛤血细胞MNF随EVR的增加而表现出较大变化,与对照组(MNF平均)相比,3个低浓度(EVR 1%、5%、10%)尾水处理未引起MNF的明显变化,但是3个高浓度处理组(EVR 20%、30%、40%)所诱导的MNF显著高于对照组,其中,EVR 40%的处理组的MNF达到12.67‰,为对照组的4.75倍。
2.3 文蛤I相酶的活性变化
图3显示,尾水暴露结束时,与对照组相比,EVR1%、EVR40%处理组的鳃EROD活性无显著变化;EVR5%、10%处理组的鳃EROD活性受到显著抑制,降幅分别为6.64%和8.06%;EVR20%、30%处理组的鳃EROD活性被显著诱导,增幅分别为11.37%和18.96%。暴露结束时,比对照组内脏EROD活性有显著变化的处理组有3个,其中EVR5%、20%处理组的EROD活性分别降低9.09%和7.27%;EVR10%处理组的EROD活性上升27.28%。相关性分析显示,2种组织的EROD活性均与EVR无显著相关性(P>0.05)。

( 标有不同字母的处理组间存在显著差异(P<0.05)。Groups sharing different letters indicate significant differences (P<0.05).)
图2尾水暴露15 d后文蛤血细胞MNF随EVR的变化
Fig.2MNF values in haemocytes of clams (M.meretrix)
exposed to serial dilutions of MSTP effluents for 15 days
2.4 文蛤II相酶的活性变化
由图4可见,鳃GST活性在EVR5%、10%处理组中受到显著诱导,分别比对照组上升50.48%和33.90%。其他处理组的活性均与对照组差异不显著。EVR1% ~30%处理组中,内脏GST活性未见明显变化,仅EVR40%处理组的活性显著高于对照组。相关性分析显示,鳃、内脏的GST活性与EVR不存在显著相关性(P>0.05)。

(标有不同字母的处理组间存在显著差异(P<0.05)。Groups sharing different letters indicate significant differences (P<0.05).)
图3尾水暴露15d后文蛤鳃和内脏的EROD活性变化
Fig 3Variation of EROD activity measured in the gill and
viscera of clams (M.meretrix) exposed to serial dilutions
of MSTP effluents for 15 days.

(标有不同字母的处理组间存在显著差异(P<0.05)。Groups sharing different letters indicate significant differences (P<0.05).)
图4尾水暴露15 d后文蛤鳃和内脏的GST活性变化
Fig.4Variation of GST activity measured in the gill and
viscera of clams (M.meretrix) exposed to serial
dilutions of MSTP effluents for 15 days
3讨论
溶酶体是细胞中含多种酸性水解酶的细胞器,在细胞学组分的分解代谢、生物大分子的胞内转移、无机和有机污染物及其代谢物的吸收、捕获方面均起着关键作用。溶酶体膜稳定性LMS是指示双壳类动物细胞总逆境的经典因子,被认为是水质评价中最可靠的生物标志物[22]。本研究观察到,随EVR增大,文蛤血细胞NRRT持续降低,表明尾水暴露会加重文蛤血细胞内的总健康逆境,这可能与尾水污染物诱导的氧化逆境有关。笔者之前的研究[15]发现,EVR1%~20%的尾水暴露15 d后,文蛤内脏中3种抗氧化酶(CAT、GPx、GR)的活性大幅降低。Parolini等[18]证明,斑马纹贻贝(Dreissenapolymorpha)暴露于浓度9和35nM的布洛芬后,NRRT与SOD、CAT、GPx等抗氧化酶活性呈显著负相关。本研究中,NRRT与EVR(%)之间存在明显的剂量-效应关系(NRRT =-1.4EVR +71,R=-0.857,P<0.05)。这种溶酶体膜失稳现象也存在于前人关于双壳类暴露于重金属、有机污染物的研究中[26-27]。Aguirre-Martínez等[28]提出的基于LMS的细胞学逆境分级标准(临界值)如下:当蛤仔的NRRT≥80 min时,则处于健康状态;如果45 min≤NRRT <80 min,则受到逆境胁迫但尚可恢复;当NRRT<45min时,蛤仔处于非健康状态。由本研究结果可见,暴露15 d后,EVR 1%、5%、10% 3个处理组的文蛤血细胞尚未受到严重影响,即:溶酶体膜稳定性可恢复到对照水平;而EVR≥20%时,文蛤血细胞处于严重胁迫之中。
微核是指真核生物在化学污染物作用下染色体发生断裂,这些断片在有丝分裂后期无法向两极移动,而游离于细胞质中,经过卷曲形成圆形或椭圆形的小核。在相同的毒物暴露条件下,微核率与物种、细胞类型有很大关系,双壳类中用于微核显微计数的典型细胞是鳃的上皮细胞和血淋巴细胞。各种逆境条件(特别是遗传毒物)均能引起生物体DNA链的损伤,表现为MNF随污染物浓度和暴露时间而持续增加,因此,MNF被认为是遗传毒性原位监测的重要工具[29]。本研究中,当EVR≥20%时,文蛤血细胞的MNF与对照组差异达到显著水平,由此证明尾水中含有能够诱导微核产生的污染物。前人进行的单因子影响实验已发现,尾水所含的许多污染成分能够诱导微核效应。例如,Hg、Pb的无机盐类是间接的遗传毒物,在与微管蛋白、驱动蛋白等骨架蛋白作用后,刺激了非整倍体微核(Aneugenic MN)形成[30]。再如,暴露于浓度1 nmol·L-1的TCS 24 h后,斑马纹贻贝(D.polymorpha)血细胞MNF比暴露前提高1倍[31]。
生物转化是生物体暴露于亲脂性化合物后的重要解毒反应。首先,Ⅰ相代谢酶EROD属于混合功能氧化酶系中细胞色素P450单加氧酶(CYP450)的一个重要亚类,其催化羟基化、环氧化等氧化反应,使脂溶性有机污染物(PAHs、PCBs、药物、杀虫剂等)的亲水性和极性增大,易于从生物体内排泄[32-33];随后,由Ⅱ相代谢酶GST催化谷胱甘肽(GSH)分子中的—SH、—NH2、—COOH以及肽键与I相代谢产物结合,生成低毒或无毒的水溶性化合物而排出体外,从而保护DNA及一些蛋白质免受损伤[34]。PAHs、PCBs等化合物均能激活双壳类的EROD或GST活性[35-36]。有研究报道,暴露于MSTPs尾水排放口下游的平面椭圆蚌(Elliptiocomplanata)消化腺以及斑马纹贻贝(Dreissenapolymorpha)软组织中的EROD活性均受到诱导[37]。Kamel等[8]在不同体积比(0%、1%、3%和10%)的突尼斯苏塞市污水厂尾水中培养沟纹蛤仔(Ruditapesdecussatus)7、14 d,1%尾水使鳃GST活性显著提升,较高浓度尾水却造成鳃GST活性降低甚至抑制;而内脏GST基本上表现为诱导效应,只是高浓度尾水的诱导力减弱。本研究发现,文蛤鳃和内脏中参与I相代谢的EROD活性分别在EVR20%、30%以及EVR10%的尾水处理组中受到显著诱导(P<0.05)(见图3);而鳃和内脏的Ⅱ相解毒酶(GST)的活性分别在EVR5%、EVR10%的处理组以及EVR40%处理组中受到显著诱导(P<0.05)(见图4)。这表明,尾水中存在着能被I相代谢和Ⅱ相代谢的化合物。但是,由图3还观察到,在某些浓度(EVR5%、EVR10%处理组的鳃;EVR5%、EVR20%处理组的内脏)尾水暴露下,EROD活性受到明显抑制(抑制率<10%,P<0.05)。这可能是因为,研究所用的尾水中含有痕量重金属成分(Pb2+、Cd2+等),对双壳类的EROD活性具有抑制作用[38-39]。有学者发现,在B[a]P(单独胁迫时表现出诱导效应)和重金属(单独胁迫时表现出抑制效应)联合作用下,扇贝的EROD活性下降甚至被显著抑制,表明重金属与B[a]P之间存在拮抗作用[39]。至于进入双壳类体内的尾水无机污染物(重金属)和有机污染物(PAHs、PCBs等)在何种浓度比例下容易发生拮抗作用尚需进一步研究。
根据表1中所有尾水处理组中上述生物标志物(鳃和内脏的EROD、GST分别表示为ERODg、ERODv和GSTg、GSTv)的相关性分析结果,文蛤的LMS与MNF之间(R=-0.858,P<0.05)、LMS与GSTv之间(R=-0.774,P<0.05)均呈显著负相关。尾水暴露所诱导的细胞毒性、染色体损伤和GSTv活性上升,均与氧化逆境增强有关。文蛤的溶酶体膜对尾水暴露最为敏感(EVR 1%的尾水即能引起NRRT显著降低,P<0.05),这是因为,溶酶体是细胞中具有最大降解能力的细胞器,动物细胞溶酶体容易积累高水平污染物而成为环境污染物的靶标[40],在此条件下形成的氧自由基首先会攻击溶酶体膜磷脂中的多聚不饱和脂肪酸,引发脂质过氧化,造成溶酶体膜的通透性增加[41],表现为较低浓度尾水暴露下的文蛤NRRT明显减小。随着溶酶体膜损伤程度不断加大,该细胞器中所含的各种水解酶以及产生的氧自由基逐渐释放到细胞质中,致使细胞核中的染色体受到攻击而断裂并形成微核。但是,与LMS(EVR1%时比对照组降低25.5%)相比,MNF对低浓度尾水的响应程度较小,可能是因为只有当溶酶体膜损伤程度因污染胁迫较重而达到一定水平时,才会有较多的氧自由基释放到细胞质中,而且这些自由基穿越两层核膜进入细胞核内也需一定时间。在LMS随EVR增大而不断降低的同时,观察到GSTv活性有所升高,但是仅在EVR40%时与对照存在显著性差异(P<0.05),表明内脏GST对尾水污染物的敏感性弱于血细胞LMS和MNF。其它代谢酶(鳃的EROD、GST以及内脏EROD)只在1~2个尾水处理组中受到诱导(P<0.05),而当EVR继续增大时,其活性无一例外地回落到对照水平甚至显著低于对照。这种非单一方向(持续降低或持续上升)的变化趋势使它们与LMS、MNF之间的相关性较差(P>0.05)。此外,文蛤鳃中的EROD和GST、内脏中的EROD和GST之间均不存在显著相关性,表明两者在对尾水中污染物的解毒方面并不同步。总之,由于以NRRT表征的LMS在EVR=1%时即对尾水产生明显响应,且与EVR之间存在显著相关性,而其它几种生物标志物则在EVR≥5%时才出现显著变化,因此文蛤血细胞LMS在尾水污染预警中具有较大应用潜力。
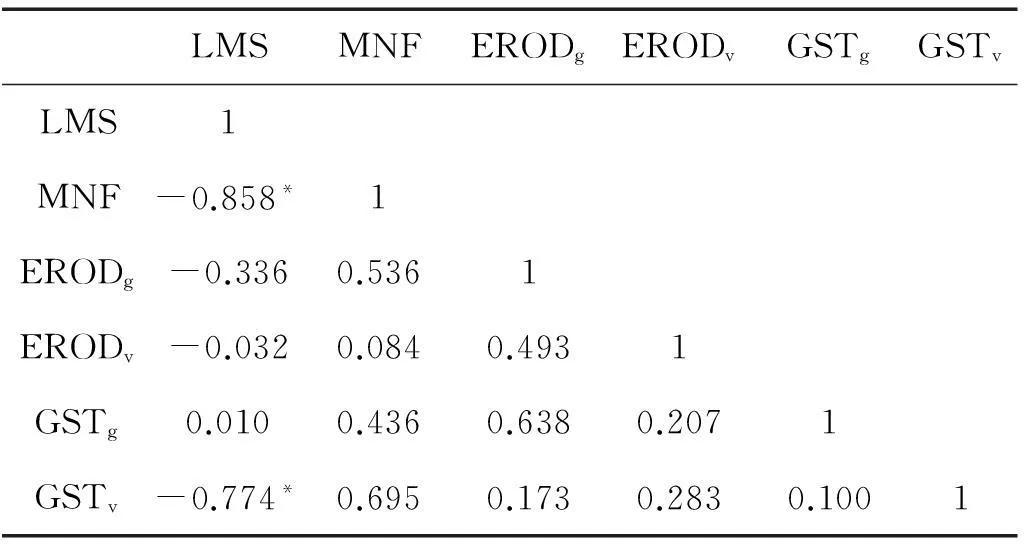
表1 4种生化指标的相关性分析结果
Note:*P<0.05; 下标g和v分别表示鳃和内脏。*P<0.05,subscript g and v represent gills and viscera, respectively.
4结论
(1) MSTPs尾水暴露15 d,文蛤的总健康逆境加重,表现为血细胞NRRT随EVR增大而降低,当EVR≥20%时,处于严重胁迫之中;尾水暴露可造成文蛤血细胞DNA损伤,表现为MNF随EVR增大而不断上升。
(2) LMS对尾水的响应敏感性及其与EVR之间的显著相关性,使其在指示纳污海域尾水污染水平方面具有较大潜力。单独依据LMS响应值判断,暴露于EVR≥20%的尾水15 d后,文蛤将因严重胁迫而处于非健康状态。
(3)个别浓度的尾水处理能够诱导文蛤鳃和内脏中I相、Ⅱ相代谢酶的活性,表明尾水中含有能被生物代谢的有机污染物;但是,由于EROD、GST对低EVR尾水的敏感性不高,且大多数与EVR之间的相关性不够显著,导致它们在尾水污染生物监测中的应用潜力较小。尾水中复杂污染成分的相互作用,可能是这两种代谢酶对尾水无明确响应规律的原因。
参考文献:
[1]Ratolab N, Cincinelli A, Alvesc A, et al. Occurrence of organic microcontaminants in the wastewater treatment process. A mini review [J]. Journal of Hazardous Materials, 2012, 239: 1-18.
[2]Watkinson A J, Murby E J, Kolpin D W. The occurrence of antibiotics in an urban watershed: From wastewater to drinking water [J]. Science of Total Environment, 2009, 407(8): 2711-2723.
[3]柯润辉, 蒋愉林, 黄清辉, 等. 上海某城市污水处理厂污水中药物类个人护理用品(PPCPs)的调查研究 [J]. 生态毒理学报, 2014, 9(6): 1146-1155.
Ke R H, Jiang Y L, Huang Q H, et al. Investigative screening of pharmaceuticals in a municipal wastewater treatment plant in Shanghai [J]. Asian Journal of Ecotoxicology, 2014, 9(6): 1146-1155.
[4]Bolong N, Ismail A F, Salim M R. A review of the effects of emerging contaminants in waste water and options for their removal [J]. Desalination, 2009, 239(1): 229-246.
[5]Horii Y, Reiner J L, Loganathan B G, et al. Occurrence and fate of polycyclic musks in wastewater treatment plants in Kentucky and Georgia, USA [J]. Chemosphere, 2007, 68(11): 2011-2020.
[6]Ohe T, Watanabe T, Wakabayashi K. Mutagens in surface waters: a review [J]. Mutation Research/Reviews in Mutation Research, 2004, 567(2-3): 109-149.
[7]Chen C C, Lu C L. An analysis of the combined effects of organic toxicants [J]. Science of Total Environment, 2002, 289(1): 123-132.
[8]Kamel N, Jebali J, Banni M, et al. Biochemical responses and metals levels inRuditapesdecussatusafter exposure to treated municipal effluents [J]. Ecotoxicology and Environmental Safety, 2012, 82: 40-46.
[9]Bergayou H, Mouneyrac C, Pellerin J, et al. Oxidative stress responses in bivalves (Scrobiculariaplana,Cerastodermaedule) from theOuedSoussestuary(Morocco) [J]. Ecotoxicology and Environmental Safety, 2009, 72: 765-769.
[10]de los Ríos A, Juanes J A, Ortiz-Zarragoitia M, et al. Assessment of the effects of a marine urban outfall discharge on cagedmussels using chemical and biomarker analysis [J]. Marine Pollution Bulletin, 2012, 64(3): 563-573.
[11]Andrew-Priestleya M N, O’Connorc W A, Dunstanb R H, et al. Estrogen mediated effects in the Sydney rock oyster,Saccostreaglomerata, following field exposures to sewage effluent containing estrogenic compoundsand activity [J]. Aquatic Toxicology, 2012, 120: 99-108.
[12]Meng F P, Wang Z F, Cheng F L, et al. The assessment of environmental pollution along the coast of Beibu Bay, northern South China Sea: An integrated biomarker approach in the clamMeretrixmeretrix[J]. Marine Environment Research, 2013, 85: 64-75.
[13]易晓燕, 孟范平, 杜秀萍, 等. 北部湾文蛤体内石油烃、多氯联苯: 含量与氧化应激响应 [J]. 环境科学研究, 2013, 26(6): 645-652.
Yi X Y, Meng F P, Du X P, et al. Oxidative stress responses to total petroleum hydrocarbons and polychlorinated biphenyls inMeretrixmeretrixin the Beibu Bay [J]. Research of Environmental Sciences, 2013, 26(6): 645-652.
[14]王群, 孟范平, 李永富, 等. 北部湾文蛤体内氧化逆境标志物对重金属积累的响应研究 [J]. 中国科学(化学), 2013, 43(9): 1189-1199.
Wang Q, Meng F P, Li Y F, et al. Study on the responses of oxidative stress biomarkers to heavy metals accumulation in the clamMeretrixmeretrixalong the Beibu Bay [J]. Scientia Sinica Chimica, 2013, 43(9): 1189-1199.
[15]苏恩萍, 孟范平, 孙婷, 等. 短期暴露于城市污水处理厂尾水的文蛤抗氧化酶响应 [J]. 中国环境科学, 2014, 32(2): 511-517.
SU E P, Meng F P, Sun T, et al. Responses of the antioxidant enzymes inMeretrixmeretrixexposed to effluent from municipal sewage treatment [J]. China Environmental Science, 2014, 32(2): 511-517.
[16]张倩, 孟范平, 付文超, 等. 市政污水厂尾水对文蛤卵黄蛋白原的诱导效应研究 [J]. 中国海洋大学学报(自然科学版), 2014, 44(12): 100-105.
Zhang Q, Meng F P, Fu W C, et al. A study on vitellogrnin induction in the bivalvesMeretrixmeretrixL. exposed to effluent from a municipal sewage treatment plant [J]. Periodical of Ocean University of China, 2014, 44(12): 100-105.
[17]Vander Oost R, Beyer J, Vermeulen N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: A review [J]. Environmental Toxicology and Pharmacology, 2003, 13(2): 57-149.
[18]Parolini M, Binelli A, Provini A. Chronic effects induced by ibuprofen on the freshwater bivalveDreissenapolymorpha[J]. Ecotoxicology and Environmental Safety, 2011, 74(6): 1586-1594.
[19]Venier P, Zampieron C. Evidence of genetic damage in grass gobies and mussels from the Venice lagoon [J]. Environment International, 2005, 31(7): 1053-1064.
[20]Kǒhler A, Pluta H J. Lysosomal injury and MFO activity in the liver of flounder (PlatichthysflesusL. ) in relation to histopathology of hepatic degeneration and carcinogenesis [J]. Marine Environmental Research, 1995, 39(1): 255-260.
[21]Lowe D M, Fossato V U, Depledge M H. Contaminant-induced lysosomal membrane damage in blood cells of musselsMytilusgalloprovincialisfrom the Venice Lagoon: An in vitro study [J]. Marine Ecology Progress Series, 1995, 129(1): 189-196.
[22]UNEP. Report of the meeting of experts to review the MED POL Biomonitoring Programme [R]. Greece: UNEP-(OCA)/MED WG, Athens, 1997, 132-137.
[23]Lowe D M, Soverchiab C, Moore M N. Lysosomal membrane responses in the blood and digestive cells of mussels experimentally exposed to fluoranthene [J]. Aquatic Toxicology, 1995, 33(2): 105-112.
[25]Habig W H, Jakoby W B. Assays for differentiation of glutathione S-transferases [J]. Methods in Enzymology, 1981, 77: 398-405.
[26]Martínez-Gómez, C, Benedicto J, Campilloa J A, et al. Application and evaluation of the neutral red retention (NRR) assay for lysosomal stability in mussel populations along the Iberian Mediterranean coast [J]. Journal of Environmental Monitoring, 2008, 10(4): 490-499.
[27]王晓宇, 杨红生, 邢坤, 等. 镉和汞胁迫对四角蛤蜊(Mactraveneriformis)血细胞的毒性损伤研究 [J]. 海洋与湖沼, 2011, 42(6): 850-856.
Wang X Y, Yang H S, Xing K, et al. Toxicity assessment of cadmium and mercury on the hemocytes ofMactraveneriformis[J]. Oceanologia Et Limnologia Sinica, 2011, 42(6): 850-856.
[28]Aguirre-Martínez1 G V, Buratti S, Fabbri E, et al. Using lysosomal membrane stability of haemocytes inRuditapesphilippinarumas a biomarker of cellular stress to assess contamination by caffeine, ibuprofen, carbamazepine and novobiocin [J]. Journal of Environmental Sciences, 2013, 25(7): 1408-1418
[29]Viarengo A, Lowe D, Bolognesi C, et al. The use of biomarkers in biomonitoring: A 2-tier approach assessing the level of pollutant-induced stress syndrome in sentinel organisms [J]. Comparative Biochemistry and Physiology C: Toxicology and Pharmacology, 2007, 146(3): 281-300.
[30]Their R, Bonacker D, Stoiber T, et al. Interaction of metal salts with cytoskeletal motor protein systems [J]. Toxicology letters, 2003, 140: 75-81.
[31]Parolini M, Pedriali A, Binelli A. Application of a biomarker response index for ranking the toxicity of five pharmaceutical and personal care products (PPCPs) to the BivalveDreissenapolymorpha[J]. Archives of Environmental Contamination and Toxicology, 2013, 64(3): 439-447.
[32]Stegeman J J, Lech J J. Cytochrome P450 monooxygenase systems in aquatic species: Carcinogen metabolism and biomarkers for carcinogen and pollutant exposure [J]. Environmental Health Perspectives. 1991, 90: 101-109.
[33]徐镜波, 王咏, 张蕾, 等. 9种硝基苯对鱼肝微粒体EROD活性的影响 [J]. 环境科学研究, 2003, 16(1): 43-45.
Xu J B, Wang Y, Zhang L, et al. Effects of nine nitrobenzenes on enzymic activity of EROD in carp hepatic microsomal system [J]. Research of Environmental Sciences, 2003, 16(1): 43-45.
[34]Van der Oost R, Beyer J, Vermeulen N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: a review [J]. Environmental Toxicology and Pharmacology, 2003, 13(2): 57-149.
[35]Gowland B T G, McIntosh A D, Davies I M, et al. Implications from field study regarding the relationship between polycyclic aromatic hydrocarbons and glutathione S-transferase activity in mussels [J]. Marine Environmental Research, 2002, 54(3): 231-235.
[36]Faria M, Carrasco L, Diez S, et al. Multi-biomarker responses in the freshwater musselDreissenapolymorphaexposed to polychlorobiphenyls and metals [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2009, 149(3): 281-288.
[37]Gagné F, Blaise C, Aoyama I, et al. Biomarker study of a municipal effuent dispersion plume in two species of freshwater mussels [J]. Environmental Toxicology, 2002, 17 (3): 149-159.
[38]Zhang Y, Song J, Yuan H, et al. Biomarker responses in the bivalve (Chlamysfarreri) to exposure of the environmentally relevant concentrations of lead, mercury, copper [J]. Environmental Toxicology and Pharmacology, 2010, 30(1): 19-25.
[39]张英. 扇贝体内生物标志物对重金属与多环芳烃胁迫的应答 [D]. 青岛: 中国科学院海洋研究所, 2010.
Zhang Y. Biomarker responses to heavy metals and polycyclic aromatic hydrocarbons exposure in bivalve [D]. Qingdao: Chinese Academy of Science(Institute of Oceanology), 2010.
[40]翁幼竹, 方永强, 张玉生. 溶酶体检测在海洋污染监测中的应用研究进展 [J]. 应用生态学报, 2013, 24(11): 3318-3324.
Weng Y Z, Fang Y Q, Zhang Y S. Application of lysosomal detection in marine pollution monitoring: Research progress [J]. Chinese Journal of Applied Ecology, 2013, 24(11): 3318-3324.
[41]Moore M N, Allen I J, McVeigh A. Environmental prognostics: an integrated model supporting lysosomal stress responses as predictive biomarkers of animal health status [J]. Marine Environmental Research, 2006, 61(3): 278-304.
责任编辑高蓓
Effects of Chronic Exposure to Effluent from Municipal Sewage Treatment Plants on Micronuclei Frequency, Lysosomal Membrane Stability and Detoxifying Enzymes in ClamsMeretrixmeretrix
CUI Hong-Wu, ZHANG Qian, MENG Fan-Ping, DU Yong-Xiang, SU En-Ping
(The Key Laboratory for Marine Environment and Ecology, Ministry of Education, Ocean University of China, Qingdao 266100, China)
Abstract:Multiple trace pollutants could not be removed completely by existing A2O (Anaerobic-Anoxic-Oxic) treatment process in municipal sewage treatment plants (MSTPs). With the discharge of the MSTPs effluent, these pollutants are introduced into the surrounding waters and accumulated in the aquatic organisms, which may lead to synthetic toxicity effects such as antagonistic action, additive action, independent effect and synergistic effect. In order to master the sub-lethal toxic mechanisms of sewages on bivalves, and provide feasible biomarkers for polluted seawaters for early- alert, in this experiment, clams (Meretrix meretrix) were exposed to effluent from the Tuandao MSTP in Qingdao City at various concentrations (EVR= 0, 1%, 5%, 10%, 20%, 30% and 40% v/v), diluted in natural seawater, for 15 days. Lysosomal membrane stability (LMS) and micronuclei frequency (MNF) in the hemocytes, and phase I detoxifying enzyme (ethoxyresorufin O-deethylase, EROD) and phase II detoxifying enzyme (glutathione S-transferase, GST) in gills and viscera were examined. Results showed that the NRRT in hemocyte of clams exposed to effluents decreases with the increasing of EVR, even if EVR=1%, and hemocyte LMS in all treatment groups are significantly lower than those in controls (P<0.05). Higher MNF values were observed in effluent groups at EVR≥20% (P<0.05). However, both EROD and GST in gills and viscera were activated only by a few concentrations of effluents (P<0.05). Compared to controls, EROD activity in gill of clams was significant induced in EVR20% and EVR30% treatment groups; EROD activity in viscera of M. meretrix only in EVR10% treatments was induced. GST activity in EVR5% and EVR10% treatments was induced dramatically in gills; and that in viscera of clams had an obvious change only in EVR40% groups, which was significant higher than controls. Conclusions: (1) Health adversity of M. meretrix was aggravating after exposed to MSTPs effluents for 15 d, and hemocyte was in severe stress when EVR≥20%; DNA of hemocyte could be damaged by exposed to the effluents. (2) Response of LMS to effluents is sensitive and is significantly correlated with EVR (R=-0.857, P<0.05), making it possible for LMS to indicate levels of polluted seawaters. (3) Individual effluents treatment could induce the activity of EROD and GST in gills and viscera; owing to the hyposensitivity of EROD and GST to low concentration effluents, and has non-significant correlation with EVR mostly, as a result, these two kinds of indicators are not suitable for effluent pollution monitoring in biological ways.
Key words:municipal sewage treatment plants (MSTPs); effluents; Meretrix meretrix; detoxifying enzymes; micronuclei frequency (MNF); lysosomal membrane stability (LMS)
中图法分类号:X835
文献标志码:A
文章编号:1672-5174(2016)01-056-008
作者简介:崔鸿武(1990-),男,硕士生。E-mail:hongwuc@tom.com
收稿日期:2015-03-11;
修订日期:2015-04-27
*基金项目:国家自然科学基金项目(41240040)资助
DOI:10.16441/j.cnki.hdxb.20150066
引用格式:崔鸿武, 张倩, 孟范平, 等. 城市污水厂尾水对文蛤微核率、溶酶体膜稳定性及解毒酶活性的影响[J]. 中国海洋大学(自然科学版), 2016, 46(1): 56-63.
CUI Hong-Wu, ZHANG Qian, MENG Fan-Ping, et al. Effects of chronic exposure to effluent from municipal sewage treatment plants on micronuclei frequency, lysosomal membrane stability and detoxifying enzymes in clamsMeretrixmeretrix[J]. Periodical of Ocean University of China, 2016, 46(1): 56-63.
Supported by the National Natural Science Foundation of China (41240040)
**通讯作者:E-mail:fanpingm@tom.com
