桑枝水提物对桑黄液体发酵的影响及桑黄液体发酵条件的优化研究
2016-04-05邹湘月李飞鸣邵元元宋南平颜新培
邹湘月 李飞鸣 邵元元 宋南平 张 仟 颜新培
(湖南省蚕桑科学研究所,湖南长沙 410127)
桑枝水提物对桑黄液体发酵的影响及桑黄液体发酵条件的优化研究
邹湘月 李飞鸣 邵元元 宋南平 张 仟 颜新培
(湖南省蚕桑科学研究所,湖南长沙 410127)
以每100 mL发酵液生成的菌丝体生物量及其中桑黄多糖、三萜及黄酮含量为考察指标,研究液体培养基中添加桑枝水提物对桑黄发酵的影响,并对桑黄的液体发酵培养条件进行了优化。结果表明,在常规培养基中添加桑枝水提物对菌丝体每100 mL发酵液生成的生物量及发酵液中的有效成分的含量具有明显的促进作用,桑黄菌株SH1501、SH1502、SH1503每100 mL发酵液生成的生物量分别达到0.312 g、0.183 g、0.235 g,比对照组分别提高了9.1%、107.9%、39.9%;最适桑黄液体发酵的培养条件为发酵温度25℃,发酵时间11 d,pH值6.5。
桑黄;液体发酵;生物量;多糖;三萜;黄酮;优化
桑黄(Inonotus sanghuang)又称桑臣、桑耳,属担子菌门(Basidiomycota),伞菌纲(Agaricomycetes),锈革孔菌目(Hymenochaetales),锈革孔菌科(Hymenochaetaceae),纤孔菌属(Inonotus)[1-2],有“森林黄金”之美称,因其通常长在桑属植物上,子实体呈黄褐色而得名[3]。有研究表明桑黄子实体的水提取物对小白鼠肉瘤S-180细胞的抑制率高达96.7%,具有独特的抗肿瘤功效,是目前国际公认的生物抗癌领域中效果最显著的一种珍稀药用菌[4];桑黄中的多糖是主要的抗肿瘤活性物质和免疫增强剂[5],三萜和黄酮类成分也具有抗炎、抗菌、抗氧化等多种活性[6]。近年来,对桑黄的研究开发已逐渐成为国内外药用真菌领域的研究热点。
由于市场需求量大,自然形成的野生桑黄资源面临枯竭,而目前桑黄的人工培育生物学效率又偏低,难以实现规模化栽培,极大地制约了桑黄产业的发展[7]。有研究表明,采用液体发酵培养能在短时间内获得大量细胞产物和代谢物,且操作简化、控制性好,是满足国内外市场需要的有效途径[8]。为提高桑黄的生物量和活性物质含量,探索液体发酵生产的新途径,本研究考察了桑枝水提物的添加对桑黄液体发酵的影响,并对其发酵培养条件进行了优化,现将试验结果报告如下,供同仁参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 SH1501、SH1502、SH1503,均为湖南省蚕桑科学研究所实验室保存用种。
1.1.2 主要试剂及材料 葡萄糖、蒽酮、硫酸、熊果酸、香兰素、冰醋酸、高氯酸、芦丁、甲醇、乙醇、氢氧化钠、硝酸铝、蛋白胨、酵母膏、磷酸二氢钾、硫酸镁等购自Sigma公司,均为分析纯;土豆、蒸馏水等均为市售;桑枝为桑树品种湘7920的夏伐枝条。
1.1.3 主要仪器设备 YXQ-LS-50SII型立式压力蒸汽灭菌锅,上海博迅实业有限公司医疗设备厂产品;PL203型电子天平,梅特勒-托利多仪器(上海)有限公司产品;DH G-9140型恒温干燥箱,上海一恒科学仪器有限公司产品;SW-CJ-2FO型净化工作台,苏州净化设备有限公司产品;LRH-150型生化培养箱,上海一恒科学仪器有限公司产品;KA-1000型台式离心机,日本日立公司产品;U-1800型紫外可见分光光度仪,日本岛津公司产品;ZHWY-2102C型恒温摇床,上海智诚分析仪器制造有限公司产品;其他为实验室常规设备。
1.2 试验方法
1.2.1 培养基制备 (1)PDA斜面培养基的制备。将土豆200 g、葡萄糖20 g、蛋白胨2 g、酵母膏2 g、磷酸二氢钾2 g、硫酸镁1.5 g、琼脂20 g、蒸馏水1 L配制成PDA斜面培养基,自然pH值。(2)液体基础培养基的制备。将葡萄糖20 g、蛋白胨2 g、酵母膏2 g、磷酸二氢钾1 g、硫酸镁0.5 g、蒸馏水1 L配制成液体基础培养基,自然pH值。上述各培养基均于121℃、0.1 MPa高压蒸汽灭菌后备用。
1.2.2 母种活化与液体培养 按无菌操作要求取黄豆大小桑黄母种的菌种,转接于PDA斜面培养基中央,28℃培养箱暗培养6 d,取边缘的生长旺盛菌丝再接种于新斜面培养基上,反复转接至菌丝恢复生长活力,保存备用。
在装液量100 mL的250 mL三角瓶中,按10 mg的接种量无菌接入活化后的桑黄母种菌丝,将三角瓶置于25℃恒温培养室1 d,观察液体培养基污染情况,再放入摇床在25℃、160 r/min振荡条件下黑暗培养10 d,观察菌丝及菌液的发酵情况,待用。
1.2.3 菌丝体生物量的测定 用布氏漏斗真空抽滤液体培养基得到菌丝体滤饼,收集上清液和菌丝沉淀,用蒸馏水反复冲洗、离心,直到清洗液不再带有培养基的颜色为止。合并菌丝体,置于60℃的电热鼓风干燥箱中烘干至恒质量,冷却后称量。
1.2.4 活性物质含量的测定 (1)菌液中桑黄多糖的提取与检测。以葡萄糖为标准品,绘制标准曲线回归方程Y=5.141 8X+0.017 4,R2=0.997 1,测定桑黄多糖的含量[9]。(2)菌液中桑黄三萜的提取与检测。以熊果酸为标准品,绘制标准曲线回归方程Y=6.513 4X-0.020 2,R2=0.995 5,测定总桑黄三萜的含量[10]。(3)菌液中黄酮的提取与检测。以芦丁为标准品,绘制标准曲线回归方程Y=11.811 6X+ 0.004 7,R2=0.999 2,测定总黄酮的含量[11]。
1.2.5 桑枝水提物的添加对不同桑黄菌株液体发酵的影响试验 将桑枝烘干并粉碎,过10目筛,取500 g桑枝粉末加3 L蒸馏水煎煮30 min,过滤收集提取液,将滤渣重复提取1次,合并2次滤液,加入液体基础培养基。以液体基础培养基为对照,设置3个平行,经灭菌冷却,按1.2.2项所述液体发酵的方法对3种桑黄菌株SH1501、SH1502、SH1503进行培养,10 d后分别测定生物量和各活性物质的含量。
1.2.6 最适液体发酵培养条件的单因素筛选 选用SH1501为供试菌株,接入液体基础培养基中,按1.2.2所述液体发酵的方法培养,分别设置温度梯度16、19、22、25、28℃,pH梯度6.0、6.5、7.0、7.5、8.0,时间梯度3、5、7、9、11、13 d,单因素筛选,其他发酵条件不变,发酵成熟或到达设定时间后分别参照1.2.3和1.2.4项测定菌丝体生物量及发酵液中多糖、三萜和黄酮类物质的含量,确定最佳温度、最佳初始pH、最佳液体发酵时间。
2 结果与分析
2.1 桑枝水提物对3种桑黄菌株液体发酵的影响
与常规液体培养基相比,桑枝水提液的添加对3种不同桑黄菌株生物量的积累效果明显(图1),桑黄菌株SH1501、SH1502、SH1503每100 mL发酵液生成的生物量分别为0.312 g、0.183 g、0.235 g,比对照组分别提高了9.1%、107.9%、39.9%。而且,桑枝水提液对桑黄胞外活性产物的分泌也具有较好的诱导效果(图2),说明桑枝水提液中某些物质能被桑黄菌丝有效地吸收利用,除添加桑枝水提液的桑黄菌株SH1503的三萜含量稍低于对照外,其余各项指标与对照相比均有所增加;另外从图中还能看出,桑黄菌株SH1502的三萜含量明显高于其它菌株,添加桑枝水提液的三萜含量达到了2.765 mg/mL,对照值也达到了2.345 mg/mL,该结果应与种性特点相关。此外,由图1-2还可以看出,每100 mL发酵液生成菌丝体的生物量与活性成分含量不具有相关性,如桑黄菌株 SH1502每100 mL发酵液生成的生物量在3个菌株中最低,而发酵液中三萜类和多糖类成分的含量却相对较高。

图1 桑枝水提液的添加对不同桑黄菌株生物量的影响

图2 桑枝水提液的添加对不同桑黄菌株发酵液中活性成分含量的影响
2.2 最适液体发酵温度的选择
在一定温度范围内,桑黄菌株 SH1501每100 mL发酵液生成的菌丝体生物量随着温度的升高而快速增加,当发酵温度为25℃时,生成的生物量达到峰值为0.088 g,之后随着温度的上升而下降(图3)。从图4可以看出,发酵温度对桑黄多糖和黄酮含量的影响与每100 mL发酵液生成的生物量的变化趋势相同,均在25℃时含量达到最高,分别为0.841 mg/mL和0.097 mg/mL,而发酵液中三萜类物质却没有因过高的温度而导致含量有明显下降的现象。综合2个图分析的结果,桑黄与多数药用菌的生长特性吻合,即高温环境有利于桑黄的正常生长,但温度过高不仅会破坏菌丝的结构和活性,还会加速自身物质的消耗,导致生成的生物量与代谢产物的含量均降低。因此,25℃为最适液体发酵温度。

图3 发酵温度对桑黄菌株SH1501生物量的影响

图4 发酵温度对桑黄菌株SH1501活性成分含量的影响
2.3 最适初始pH值的选择
桑黄菌丝体产量受pH的影响较大,整个培养环境偏弱酸性时适合桑黄的生长发育(图5)。当初始pH值为6.5时,桑黄菌株SH1501生长状况良好,每100 mL发酵液生成的生物量达到最大值,为0.088 g,当pH值大于6.5时,菌丝体生成量随pH值的增大而明显减少。由图6可知,桑黄发酵液中活性成分的分泌累积对pH值的耐受范围较广,各项指标在pH值6~8内没有明显差异,除三萜外,发酵液中多糖和黄酮的含量都在pH值为6.5时达到峰值,从最大限度获得桑黄的生物量和活性物质含量的角度考虑,选择培养基初始pH值为6.5。

图5 初始pH值对桑黄菌株SH1501生物量的影响

图6 初始pH值对桑黄菌株SH1501活性成分含量的影响
2.4 最适液体发酵时间的选择
随着发酵时间的延长,桑黄菌株 SH1501每100 mL发酵液生产的菌丝体生物量和活性成分含量不断增加(图7-8),在11 d时达到最大值,生成的生物量0.088 g,发酵液中三萜含量2.345 mg/mL、多糖含量0.841 mg/mL、黄酮含量0.097 mg/mL。随后各项指标值都有不同程度的下降,其原因可能是11 d后菌丝体大量聚集并伴有菌球自溶现象,菌丝老化,且培养基中营养物质消耗殆尽,导致代谢产物含量逐渐降低。因此,综合考虑,桑黄液体发酵的最适培养时间为11 d。

图7 发酵时间对桑黄菌株SH1501生物量的影响
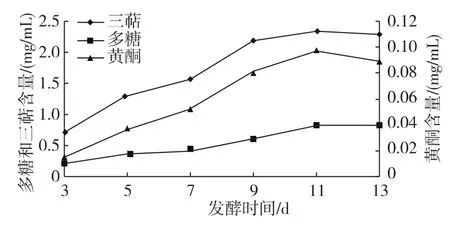
图8 发酵时间对桑黄菌株SH1501活性成分含量的影响
3 小结与讨论
为提高桑黄的发酵生产效率,本试验考察了桑枝水提物的添加对桑黄液体发酵的影响,并对培养条件进行了优化。研究结果表明,桑枝水提物能刺激桑黄菌丝的生长和活性代谢产物的分泌,其每100 mL发酵液生成的生物量以及发酵液中多糖类、三萜、黄酮类物质含量都明显高于液体基础培养基,本方法对桑黄菌丝的生长和药理活性成分的积累具有明显的促进作用,但桑枝水提物刺激桑黄菌丝生长和活性产物分泌的调节机理有待进一步研究。
采用单因素试验对桑黄菌株SH1501进行液体培养,获得最适的桑黄液体发酵条件为发酵温度25℃、发酵时间11 d、初始pH值6.5,该结论及变化趋势与李瑞雪[12]等的研究结果相似。根据单因素的考察,今后将对影响桑黄液体发酵的培养条件进行正交试验和工艺验证,为桑黄的扩大发酵生产提供一定的理论基础和技术参考。为了进一步提高其生物学效率,今后需在桑黄生长的代谢途径、诱导物筛选及两者协同作用等方面继续开展试验研究。
[1]吴声华.珍贵药用菌“桑黄”物种正名[J].食药用菌,2012,20 (3):177-179.
[2]戴玉成,崔宝凯.药用真菌桑黄种类研究[J].北京林业大学学报,2014,36(5):1-7.
[3]刘波.中国药用真菌[M].太原:山西人民出版社,1974.
[4]IKEKAWA T,NAKANISHI M,UEHARA N,et al.Anitumor action of some basidiomycetes,especially Phellinus linteus[J].Gann,1968,59(9):155-157.
[5]宋爱荣,王光远,赵晨,等.火木针层孔菌(桑黄)粗多糖对荷瘤小鼠的免疫调节研究[J].菌物学报,2009,28(2):295-298.
[6]刘惠知,邵晨霞,吴胜莲,等.桑黄菌的药理及产品开发研究进展[J].食用菌,2013(5):1-3.
[7]吕英华,王建芳,李玉平,等.药用真菌桑黄的研究进展[J].蚕业科学,2009,35(1):204-211.
[8]刘凡,庞道睿,游庭活,等.桑黄液体发酵菌丝体提取物抑菌活性研究[J].广东农业科学,2013(18):69-72.
[9]杨成凤,郑凌君,廖尊胜,等.桑黄液体发酵培养条件和多糖提取工艺的优化[J].中国调味品,2015,40(6):5-10.
[10]张志军,朱越,罗莹,等.灵芝中三萜化合物提取工艺[J].食品研究与开发,2009,30(9):81-83.
[11]陈晓平,于翠翠.响应面法优化微波辅助乙醇提取桑黄黄酮工艺的研究[J].食品与发酵科技,2013,49(4):31-36.
[12]李瑞雪,汪泰初,贾鸿英,等.液体发酵技术培养桑黄的工艺条件优化试验[J].中国蚕业,2010,31(3):20-24.
S886.9
A
1007-0982(2016)04-0017-04
10.16839/j.cnki.zgcy.2016.04.004
2016-03-29;接受日期:2016-09-21
湖南省科技计划重点研发项目(编号2015NK3054);现代农业产业技术体系建设专顶(编号CARS-22)。
第1作者信息:邹湘月(1988—),女,湖南长沙,硕士研究生,研究实习员。Tel:0731-84692978,E-mail:xiangyuezou@163.com
信息:颜新培,博士,研究员。E-mail:yanxinpei@sina.com
