《化学与技术》模块考向探析
2016-04-01江苏朱伟刚
江苏 朱伟刚
《化学与技术》模块考向探析
江苏 朱伟刚
研究近年来的高考试题可以发现,高考对《化学与技术》模块的考查,通常都是选取与化学相关的新科技成果、社会热点、环境问题、资源的开发利用、废弃物的处理等为命题素材,从化学与资源的开发利用、化学与材料的制造和应用、化学与工农业生产等方面选取一个角度为切入点,考查涉及化学工艺流程、反应原理、实验操作方法、化学用语和化学计算等内容。
1.化学与资源开发利用
这类试题常以空气分离、海水淡化、氯碱工业、制碱工业等工艺为命题载体,考查空气分离、海水淡化、硬水软化的方法及原理和海水提镁、海水提溴、氯碱工业等知识。
2.化学与材料的制造和应用
这类试题常以金属冶炼、非金属材料制备以及重要化工原料(如胆矾、氯化钡、含硅物质)的制备等为命题载体,考查元素化合物、化学反应原理、实验设计及三废处理等知识。
3.化学与工农业生产
这类试题常以合成氨、硫酸和硝酸的制备与应用、化石燃料的综合利用、农产品的加工、医药材料的制备等为命题载体,考查影响化学反应速率的元素、平衡移动原理等知识,同时还渗透尾气处理方法与技术。
一、考试热点探析
2017年高考对《化学与技术》模块的考查,命题方式不会改变,题目的背景可以不断翻新,但考查的基础知识不变。以国家蓝色经济带政策落实为素材,可考查海水资源的综合利用;以新丝绸之路战略为背景,可考查西部资源的开发利用,这些都可能成为命题的热点。
1.反应条件的控制
因为化学反应是有条件的,往往要在一定的浓度、温度、压强、催化剂等条件下进行,有时还需要在一定的酸碱性条件下进行,所以生产中必须控制反应条件,其中温度和酸度的控制是条件控制的两大主旋律。
例1 (2016全国Ⅲ)聚合硫酸铁(PFS)是水处理中重要的絮凝剂。下图是以回收废铁屑为原料制备PFS的一种工艺流程。

回答下列问题:
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为________。粉碎过筛的目的是___________________。
(2)酸浸时最合适的酸是________,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________________ _____________,下列氧化剂中最合适的是___________(填标号)。
a.KMnO4b.Cl2c.H2O2d.HNO3
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则________。
(5)相对于常压蒸发,减压蒸发的优点是____________。
解析:(1)铁锈的主要成分是氧化铁的水合物。粉碎过筛可以选取细小的废铁屑颗粒,增大反应物之间的接触面积,提高“酸浸”反应速率。
(2)反应时不能引入新的杂质,酸浸时最合适的酸是硫酸。
(3)反应釜中加入氧化剂的作用是将Fe2+氧化为Fe3+,为了不引入新的杂质,应加入绿色氧化剂H2O2。
(4)pH偏大时,Fe3+会转化为Fe(OH)3沉淀而损失,造成产率降低。
(5)压强减小时,物质的沸点降低。相对于常压蒸发,减压蒸发的优点是可防止温度过高,聚合硫酸铁分解。
(6)由题意可知,与样品反应的盐酸的物质的量为(V0-V)c×10-3mol,则样品中OH-的物质的量为(V0-V)c×10-3mol。因为该样品中Fe的质量分数w,则mg样品中铁的物质的量是mol,因此。
答案:(1)Fe2O3·xH2O 选取细小颗粒,增大反应物接触面积,提高“酸浸”反应速率
(2)H2SO4Fe2O3·xH2O+6H+2Fe3++(x+ 3)H2O
(3)使Fe从+2价变成+3价 c
(4)形成氢氧化铁沉淀
(5)降低蒸发温度防止产物分解
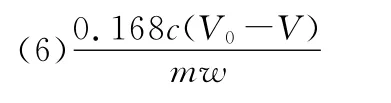
2.物质的分离与提纯
为了得到纯净的产物,生产过程中经常要对物质进行分离与提纯。提纯就是要除去杂质,除杂的方法较多,其中调溶液的pH除杂是一种重要方法。控制溶液的酸碱性可使其中某些金属离子形成氢氧化物沉淀。例如,若要除去Mn2+溶液中含有的Fe2+,可先用氧化剂把Fe2+氧化为Fe3+,再调溶液的pH到3.7。调节pH所需的物质应满足两点:能与H+反应,使溶液pH增大;不引入新杂质。例如:要除去Cu2+溶液中混有的Fe3+,可加入CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3等物质来调节溶液的pH。
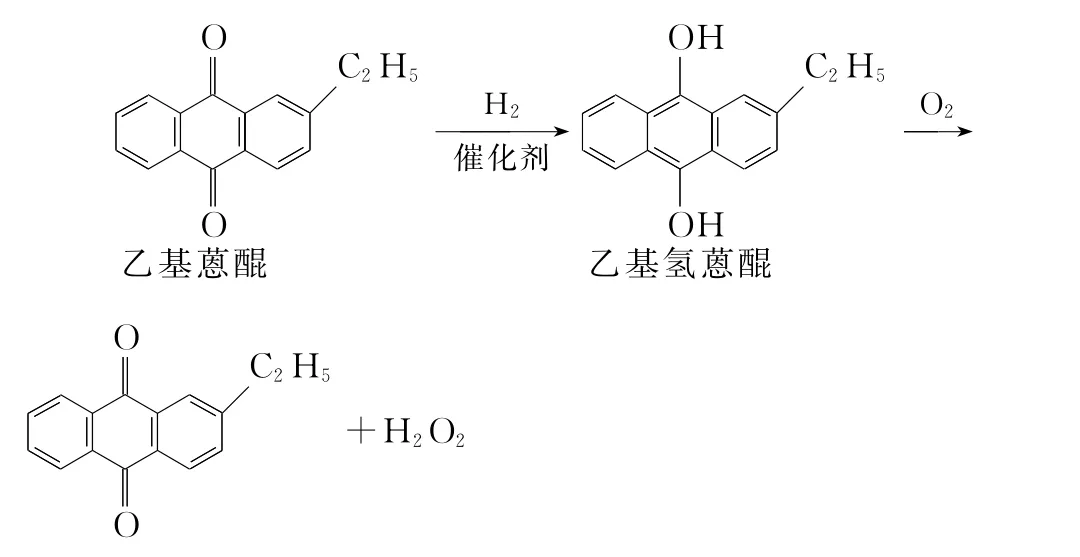
例2 (2016全国Ⅱ)双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
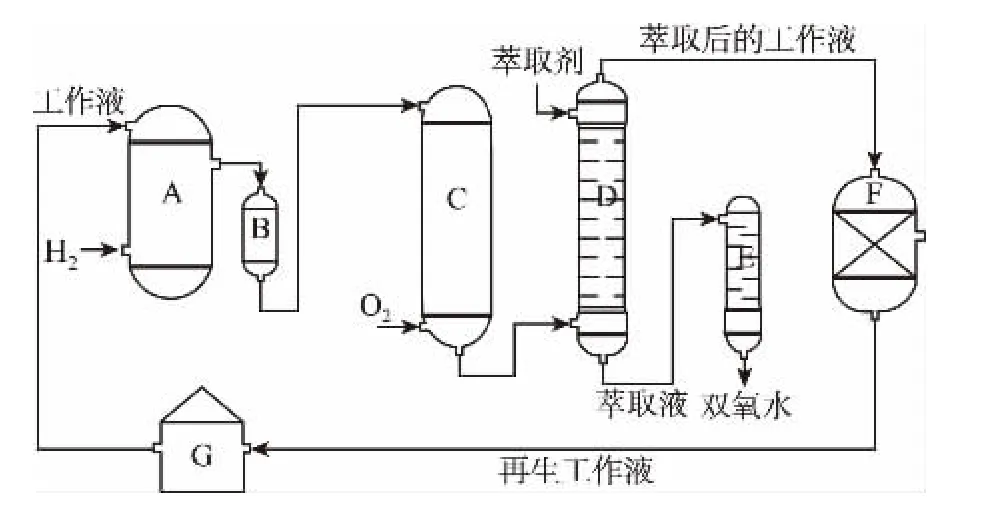
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E.净化塔F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备H2O2理论上消耗的原料是________,循环使用的原料是________,配制工作液时采用有机溶剂而不采用水的原因是_______________________。
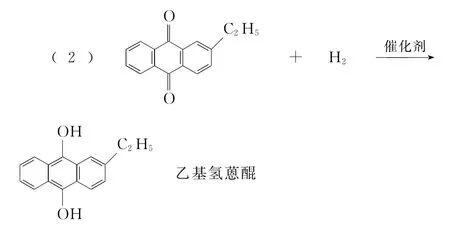
(2)氢化釜A中反应的化学方程式为_______________。进入氧化塔C的反应混合液中的主要溶质为________。
(3)萃取塔D中的萃取剂是__________,选择其作萃取剂的原因是___________________________________________。
(4)工作液再生装置F中要除净残留的H2O2,原因是___________________________。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_________________________,一种双氧水的质量分数为27.5%(密度为1.10g·cm-3),其浓度为________mol·L-1。
解析:(1)由反应原理可知,蒽醌法制备H2O2理论上消耗的原料是氢气和氧气;由工艺流程图可知,循环使用的原料是乙基蒽醌。乙基蒽醌是有机物,难溶于水而易溶于有机溶剂,所以配制工作液采用有机溶剂而不采用水。(2)在氢化釜A中,乙基蒽醌与氢气反应生成乙基氢蒽醌。进入氧化塔C的反应混合液中的主要溶质为乙基氢蒽醌。(3)萃取塔D中需要分离H2O2和乙基蒽醌,H2O2溶于水被水萃取,乙基蒽醌不溶于水,所以选取的萃取剂是水。(4)H2O2可分解放出O2,与H2混合易发生爆炸,工作液再生装置F中要除净残留的H2O2。(5)H2O2在酸性条件下被KMnO4氧化,Mn元素的化合价由+7价降低到+2价,O元素的化合价由-1价升高到0价,根据得失电子相等、电荷守恒和原子守恒可配平方程式。根据物质的量浓度和质量分数的换算公式,可求出双氧水的物质的量浓度。
答案:(1)氢气和氧气 乙基蒽醌 乙基蒽醌(乙基氢蒽醌)不溶于水,易溶于有机溶剂
(3)水 H2O2溶于水被水萃取,乙基蒽醌不溶于水
(4)H2O2分解放出氧气,与氢气混合,易发生爆炸
(5)6H++5H2O2+2Mn2++5O2↑+8H2O 8.9
3.经济环保的意识
化工生产既要考虑化学反应原理,又要考虑生产实际,要力求做到经济环保。例如,对于合成氨反应,温度降低有利于平衡正向移动,但温度太低反应速率慢,不经济;压强大有利于反应正向移动,但压强太大,对设备、动力的要求更高,也不经济,故应选择适宜的压强和温度。再如,对SO2催化氧化为SO3的反应,增大压强有利于提高SO2的转化率,但常压下SO2的转化率已经比较大,增大压强提高转化率不经济,故采用常压下进行反应。
例3 (2016全国Ⅰ)高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
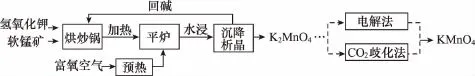
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是______________。
(2)“平炉”中发生的化学方程式为__________________。
(3)“平炉”中需要加压,其目的是___________________。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4,MnO2和_________________(写化学式)。
②“电解法”为现代工艺,即电解K2MnO4的水溶液,电解槽中阳极发生的电极反应为_____________,阴极逸出的气体是________。
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为________。
解析:(1)粉碎软锰矿可增大反应物之间的接触面积,加快反应速率,提高原料利用率。
(2)“平炉”中的反应物是MnO2、O2和KOH,产物除K2MnO4外,还应有水。
(3)在“平炉”中增大压强,可以提高O2的浓度,加快反应速率,同时也可使化学平衡正向移动(化学反应大多具有可逆性),提高软锰矿的转化率。
(4)①根据质量守恒定律,可知反应中还有KHCO3生成。②电解时,阳极发生氧化反应生成;阴极水电离出的H+发生还原反应生成H2。③在“电解法”中,K2MnO4的理论利用率是100%;在“CO2歧化法”中,K2MnO4的理论利用率是2/3,故二者的理论利用率之比为1∶2/3=3∶2。
答案:(1)增大接触面,加快反应速率,提高原料利用率

(3)提高氧气的压强,加快反应速率,增加软锰矿转化率

(作者单位:江苏省常州市横山桥高级中学)
