鸡堆型艾美耳球虫Hsp90克隆表达及其核酸疫苗的免疫保护作用
2016-03-31聂思静黄艺华黄小丹蔡皓璠马德星李广兴东北农业大学动物医学学院黑龙江哈尔滨50030黑龙江职业学院黑龙江哈尔滨50080
冯 俪,聂思静,黄艺华,黄小丹,蔡皓璠,马德星,李广兴(.东北农业大学动物医学学院,黑龙江哈尔滨50030;.黑龙江职业学院,黑龙江哈尔滨50080)
鸡堆型艾美耳球虫Hsp90克隆表达及其核酸疫苗的免疫保护作用
冯俪1,聂思静1,黄艺华1,黄小丹1,蔡皓璠2,马德星1,李广兴1
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.黑龙江职业学院,黑龙江哈尔滨150080)
摘要:利用RT-PCR方法从鸡堆型艾美耳球虫(E.acervulina)子孢子中成功克隆热休克蛋白90(Hsp90)基因,并构建其原核和真核表达质粒pET30a-Hsp90和pVAX-Hsp90。重组表达的89 kD可溶蛋白免疫家兔制备多克隆抗体,间接ELISA和Western-Blot表明,其反应性和特异性良好。真核表达质粒pVAX-Hsp90体外瞬时转染间接免疫荧光检测可见成功表达。雏鸡真核表达质粒免疫后进行攻虫保护试验,结果表明,pVAX-Hsp90组较空载体组及PBS组增重极明显(P<0.01),且肠道病变减轻,OPG减少,抗球虫指数为166.17。综上初步评价了Hsp90核酸疫苗的免疫保护作用,表明Hsp90是一种潜在的鸡球虫保护性抗原。
关键词:堆型艾美耳球虫;热休克蛋白90;克隆表达;核酸疫苗;免疫保护
鸡球虫是由包括堆型艾美耳球虫(Eimeria acervulina)在内的7种常见艾美耳球虫引起的一种寄生虫病。寄生虫侵入鸡肠道组织并分裂增殖使其发生损伤而导致腹泻、血便和体重降低,对养禽业造成严重的经济损失[1]。热休克蛋白90 (heat shock protein 90,Hsp90)是热休克蛋白家族中的重要成员,广泛存在于从低等原核生物到高等哺乳动物中。Hsp90是一种进化保守的蛋白质,在分子伴侣功能、细胞循环调控、抗原传递方面发挥着重要作用[2]。已有研究表明Hsp90在弓形虫的生长中发挥重要作用,用重组Hsp90蛋白免疫小鼠可产生保护效果且血清抗体IgG提高[3],提示Hsp90对弓形虫免疫来说是一种有效的保护性抗原。本研究采用原核表达系统克隆表达了E.acervulina Hsp90蛋白,利用重组蛋白免疫家兔制备多克隆抗体对其进行了生物学特性鉴定,并构建pVAX-Hsp90真核表达质粒免疫雏鸡后进行攻虫试验来检测Hsp90核酸疫苗抗球虫感染的保护作用。
1 材料与方法
1.1寄生虫、菌株、质粒和试验动物E.acervulina由本实验室保存。pMD18-T载体,购自宝生物工程(大连)有限公司。pET-30a(+)、pVAX载体由本实验室保存。E.coli JM109和Rosetta,购自北京全式金生物技术有限公司。雌性大白兔和一日龄雏鸡,购自哈尔滨市某养殖场。
1.2主要试剂RT-PCR相关常规试剂盒,购自宝生物工程(大连)有限公司。HRP和FITC标记的羊抗兔IgG,购自北京中杉金桥生物技术有限公司。TRIZol,购自Sigma公司。
1.3Hsp90基因克隆根据GenBank公布的E. acervulina Hsp90 cDNA序列(GenBank:AY459429.1)设计引物:F1:5′-AATCCCTAACCTCATCCACGTC-3′;R1:5′-GCACCGCCTTTGTCTGTACT-3′。按TRIZol Reagent说明书提取子孢子总RNA,按反转录试剂盒合成cDNA,按反应条件进行RT-PCR。并连接pMD18-T,进行测序。
1.4pET-30a-Hsp90和pVAX-Hsp90重组质粒的构建及鉴定根据测序结果分别设计一对原核引物与真核引物:P1: 5′-CGCGGATCCATGGAGAACAAGGAGACCTT-3′,P2:5′-ACGCGTCGACTTAGTCTACCTCCTCCATCT-3′;U1:5′-CGCGGATCCGC⁃CACCATGGAGAACAAGGAGACC-3′,U2:5′-AACTGCAGTTAGTCTACCTCCTCCATCT-3′,下划线为插入的酶切位点,斜体为Kozak序列。回收纯化DNA后分别连接pET-30a、pVAX表达载体,进行酶切鉴定。
1.5Hsp90的表达、纯化及鉴定将pET-30a-Hsp90转化大肠杆菌Rosetta感受态,经1 mmol/L IPTG诱导后收集菌体,超声破碎,进行SDS-PAGE分析。以鼠抗His单抗为一抗,HRP标记羊抗鼠IgG为二抗对重组蛋白进行Western-Blot分析。表达蛋白通过镍柱进行纯化。
1.6多克隆抗体的制备及鉴定用纯化的Hsp90蛋白免疫大白兔,参考[4]制备多克隆抗体,间接ELISA多析测定抗体效价。用孢子化卵囊蛋白的SDS-PAGE,以1∶1 000倍稀释的多抗血清为首抗,HRP标记的羊抗兔IgG为二抗,通过Western-Blot检测抗体特异性。
1.7Hsp90体外瞬时表达按Invitrogen Lipofectamine 2000说明书,将pVAX-Hsp90转染Hela细胞,转染24 h后,多聚甲醛固定,以1∶100稀释多抗血清作为首抗,1∶200稀释的FITC标记山羊抗兔IgG为二抗,荧光显微镜观察Hsp90表达情况。1.8动物免疫保护试验1日龄雏鸡随机分为4组,每组15只,即未免疫未攻虫组(None)、PBS对照组(PBS)、pVAX免疫组(pVAX)、pVAX-Hsp90免疫组(pVAX-Hsp90)。14、21日龄每只鸡胸部肌肉注射100 μg真核质粒或100 μL PBS,28日龄除None组外均口服接种1×105个孢子化卵囊进行攻虫。14 d、28 d和35 d逐羽称重,计算平均增重及相对增重率、攻虫后第6天记录十二指肠病变计分和每克粪便卵囊排出数(OPG)并计算抗球虫指数(Anticoccidial index,ACI),用以评价免疫保护效果[5]。
1.9数据处理所有数据采用GraphPad Prism 5.0软件进行分析,比较各组间的差异。
2 结果
2.1E.acervulina Hsp90克隆本试验通过RT-PCR扩增得到2 433 bp大小的序列(图1),通过基因测序后在NCBI上进行BLAST分析显示,其与E.acervulina clone 62 Hsp90(GenBank:AY459429.1)同源性为99.7%,表明成功克隆得到E.acervulina Hsp90基因,并提交GenBank,登录号为:KF053874.1。该序列包含一个2 139 bp ORF,编码713 aa,蛋白大小为82.5 kD。
2.2pET-30a-Hsp90和pVAX-Hsp90的鉴定用BamHⅠ和SalⅠ对pET-30a-Hsp90或BamHⅠ和PstⅠ对pVAX- Hsp90进行酶切鉴定结果与预期相符(图1)。
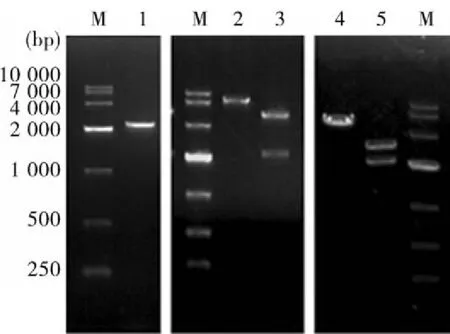
图1 pET- 30a- Hsp90和pVAX- Hsp90的鉴定M:DL-10 000 DNA Marker;1:Hsp90 RT-PCR产物;2、3:pET30a-Hsp90单/双酶切;4、5:pVAX-Hsp90单/双酶切
2.3Hsp90原核表达及鉴定原核重组蛋白进行SDS-PAGE分析,pET-30a-Hsp90在89 kD处出现特异性条带,并且以分泌形式表达,通过镍柱对其进行纯化后条带单一(图2)。pET-30a-Hsp90诱导表达蛋白与His单抗反应在89 kD处可见一特异性条带(图3)。
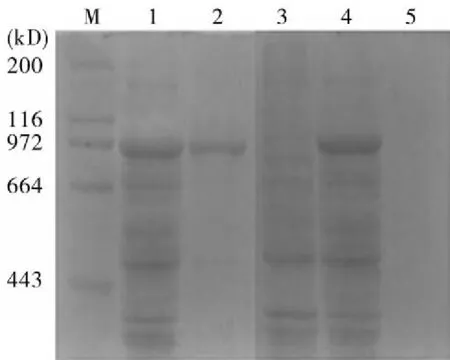
图2 pET- 30a- Hsp90表达产物的SDS- PAGE分析M:蛋白Marker;1:pET30a-Hsp90诱导后;2:纯化后Hsp90蛋白;3:pET-30a诱导后;4:pET30a-Hsp90上清;5:pET30a-Hsp90沉淀
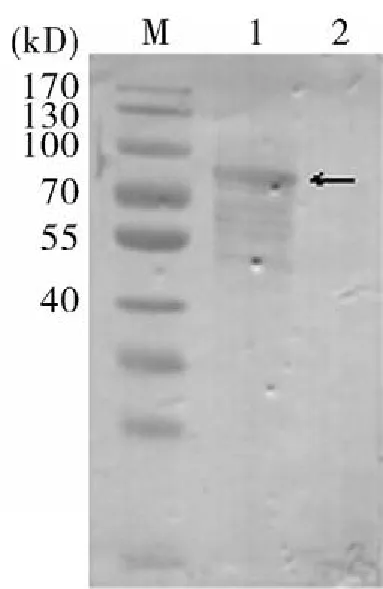
图3 His单抗检测pET- 30a- Hsp90M:Pageruler Prestained Protein Ladder;1:pET30a-Hsp90重组蛋白;2:pET-30a IPTG诱导
2.4多克隆抗体生物学特性鉴定经间接ELISA法检测得所制备的多抗效价为218;Western-Blot显示多抗血清可与孢子化卵囊蛋白特异性结合(图4),说明多抗血清反应性和特异性良好。
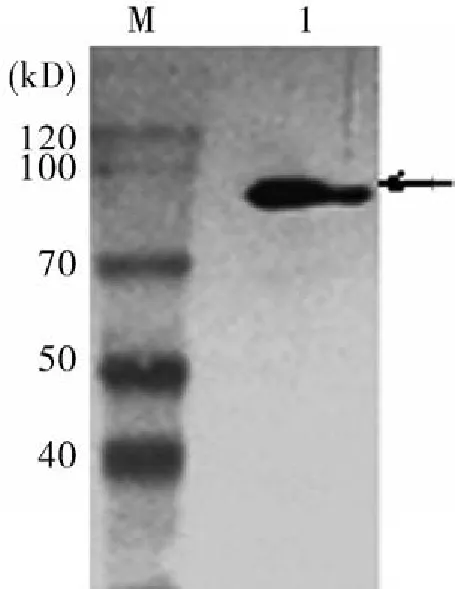
图4 多克隆抗体的Western BlotM:Blue plusⅡProtein Marker;1:孢子化卵囊蛋白
2.5pVAX-Hsp90转染Hela细胞IFA鉴定pVAX-Hsp90转染Hela细胞进行IFA检测可见到特异性绿色荧光信号,而转染pVAX空载体的细胞及细胞对照孔未出现荧光信号(图5),说明多抗血清可以与真核表达的Hsp90蛋白发生特异性结合,pVAX-Hsp90构建成功。
2.6免疫保护效果动物免疫试验结果显示,pVAX与pVAX-Hsp90免疫组增重均高于PBS对照组,且pVAX-Hsp90极显著高于pVAX免疫组与PBS对照组(P<0.01)(图6);pVAX-Hsp90免疫组卵囊排出量显著低于pVAX免疫组与PBS对照组(P<0.05)(图7);pVAX-Hsp90免疫组十二指肠病变计分极显著低于对照组(P<0.01)(图8);综合评价pVAX-Hsp抗球虫ACI为166.17(表1),提示Hsp90核酸疫苗对球虫感染具有保护作用。

图5 真核转染间接免疫荧光 20×A:Hela细胞对照;B:pVAX空载体对照;C:pVAX-Hsp90转染Hela细胞
3 讨论
研究表明,在原虫病中Hsp90对于维持细胞稳态、抵抗外源病原微生物入侵等方面有重要作用。弓形虫Hsp90是由速殖子分泌,Echeverria等[6]利用格尔德霉素(GA)抑制弓形虫Hsp90功能后,发现速殖子向缓殖子转变受到阻碍,说明弓形虫Hsp90对虫体入侵宿主细胞及寄生虫在宿主细胞内的生长发育起关键作用;抑制锥虫Hsp90功能,可使上鞭毛体发育停滞在细胞周期的G1期,从而阻碍了锥虫细胞的增殖[7]。Hsp90与球虫的入侵和生长密切相关,在虫体入侵感染过程中E. tenella Hsp90的表达量增加,且在虫体的所有阶段均有表达[8]。目前多项研究显示,多种病原体Hsp90具有免疫原性,Raska等[9]在白色念珠菌感染小鼠试验中检测到Hsp90蛋白免疫可刺激产生高水平的血清抗体IgG,对小鼠产生一定保护作用;Abdian等[10]用硕大利什曼原虫Hsp90制备的DNA疫苗免疫小鼠,检测到脾细胞IFN-γ及IL-15表达量显著增加,预示着机体产生Th1型细胞免疫应答,目前为止E.acervulina Hsp90抗原性研究尚未见相关报道。
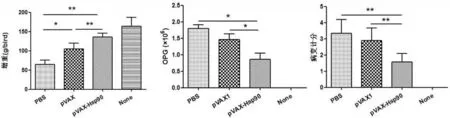
图6 攻虫后增重情况 图7攻虫后第6天每克粪便的卵囊数 图8攻虫后第6天十二指肠病变计分*:两组间差异显著(P<0.05);**:两组间差异极显著(P<0.01)
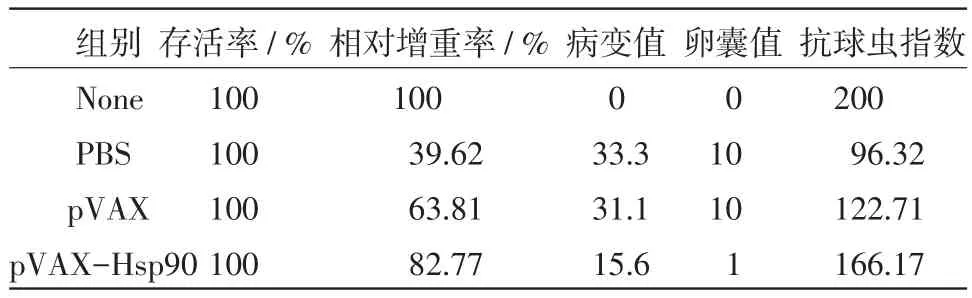
表1 免疫效果观察
本试验从堆型艾美耳球虫子孢子中成功克隆得到Hsp90基因,用pVAX-Hsp90转染Hela进行IFA检测可见绿色荧光信号,说明Hsp90在体外成功表达,接着用pVAX-Hsp90真核质粒免疫雏鸡并进行攻虫试验,与空载体免疫组和PBS对照组相比,鸡增重极显著增加,OPG和病变指数均显著降低,ACI是目前为止评价保护效果的综合指标,pVAX-Hsp90组免疫保护效果较好,ACI为166.17,大于160,且显著高于pVAX组及PBS对照组,表明Hsp90是球虫的一种保护性抗原,可用于鸡球虫病疫苗的研究。
参考文献:
[1] Donal P,Conway M.Elizabeth McKenzie.Poultry Coccidiosis:Diagnostic and Testing Procedure [M] . USA:Blackwell Publishing Professional,2007.
[2] Johnson J L . Evolution and function of diverse Hsp90 homologs and cochaperone proteins[J] . BBA- Mol Cell Res,2012,1823 (3):607-613.
[3] Rojas P A,Martin V,Nigro M,et al . Expression of a cDNA encoding a Toxoplasma gondii protein belonging to the heat-shock 90 family and analysis of its antigenicity[J].FEMS Microbiol Lett,2000,190(2):209-213.
[4]解真真,郑晓星,李广兴,等.产气荚膜梭菌EF-Tu基因的原核表达及其多克隆抗体的制备[J] .中国兽医科学,2013 (02):111-117.
[5]黄小丹.鸡IL-18堆型艾美耳球虫3-1E-α-tubulin增强型核酸疫苗免疫保护机理[D].哈尔滨:东北农业大学,2012.
[6] Echeverria P C,Matrajt M,Harb O S,et al . Toxoplasma gondii Hsp90 is a potential drug target whose expression and subcellular localization are developmentally regulated[J] . J Mol Biol,2005,350(4):723-734.
[7] Graefe S E,Wiesgigl M,Gaworski I,et al.Inhibition of HSP90 in Trypanosoma cruzi induces a stress response but no stage differentiation[J].Eukaryot Cell,2002,1(6):936-943.
[8] Peroval M,Pery P,Labbe M.The heat shock protein 90 of Eimeria tenella is essential for invasion of host cell and schizont growth [J].Int J Parasitol,2006,36(10-11):1205-1215.
[9] Raska M,Belakova J,Wudattu N K,et al.Comparison of protective effect of protein and DNA vaccines hsp90 in murine model of systemic candidiasis[J].Folia Microbiol(Praha),2005,50(1):77-82. [10] Abdian N,Gholami E,Zahedifard F,et al . Evaluation of DNA/ DNA and prime-boost vaccination using LPG3 against Leishmania major infection in susceptible BALB/c mice and its antigenic properties in human leishmaniasis[J] . Exp Parasitol,2011,127 (3):627-636.
Cloning and expression of EimeriaacervulinaHsp90 gene and theimmuneprotection of its DNA vaccine
FENG Li1,NIE Si-jing1,HUANG Yi-hua1,HUANG Xiao-dan1,CAI Hao-fan2,MA De-xing1,LI Guang-xing1
(1.College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China;2.Heilongjiang Polytechnic,Harbin 150080,China)
Abstract:In this study,Eimeria acervulina Hsp90 gene was amplified by RT-PCR and cloned into the plasmid pET30a-Hsp90.The expressed pVAX-Hsp90 was expressed with a molecular weight of 89 kD.pVAX-Hsp90 was then purified and used to immunize the rabbit to generate its polyclonal antibody.Indirect ELISA and western-blot showed the antibody has highly reactivity and specificity . pVAX-Hsp90 was then used to immunize chickens to test its immunoprotection effect . The results showed that pVAX-Hsp90 group had significantly high body weight gains(P<0.01)lower intestine lesion score and occyst shedding compared with control groups, and the ACI is 166.17.Our data suggest that Hsp90 has immunoprotective effect and could be used as a potential protective antigen for chicken coccidiosis.
Key words:E.acervulina;Hsp90;coccidiosis;DNA vaccine;immune protection
Corresponding author:LI Guang-xing
通讯作者:李广兴,E-mail:ligx@neau.edu.cn
作者简介:冯俪(1989-),女,硕士,研究方向为基础兽医学,E-mail:fengli19896@sina.com
基金项目:国家自然科学基金项目(31172295;31272569);2013年黑龙江省普通高等学校动物普通疾病防治重点实验室开放课题
收稿日期:2014-10-10
中图分类号:S852.72+3
文献标志码:A
文章编号:0529- 6005(2016)01- 0010- 04
