鱼类病原菌三联体检测试纸的制作与应用
2016-03-30刘亦娟孙金生2包海岩张勤臧莉徐晓丽
■刘亦娟孙金生,2包海岩张 勤臧 莉徐晓丽
(1.天津师范大学生命科学学院,天津300387;2.天津市水生动物疫病预防控制中心,天津300221;3.天津市水产技术推广站,天津300221)
鱼类病原菌三联体检测试纸的制作与应用
■刘亦娟1孙金生1,2包海岩3张勤3臧莉3徐晓丽3
(1.天津师范大学生命科学学院,天津300387;2.天津市水生动物疫病预防控制中心,天津300221;3.天津市水产技术推广站,天津300221)
摘要:试验分别制作柱状黄杆菌、嗜水气单胞菌、海豚链球菌3种病原菌的胶体金免疫层析试纸条,将其组装成三联体卡条,用于3种常见鱼类病原菌的平行检测。结果表明,所制作的三联体检测试纸具有较好的特异性,与其它鱼类病原菌无交叉反应,对柱状黄杆菌的检测灵敏度为3×106cfu/ml,对嗜水气单胞菌和海豚链球菌的检测灵敏度均为3×105cfu/ml。将三联体检测试纸用于生产上鱼类病原菌的现场检测,与实验室检测结果的符合率在87.7%以上。操作简便快速,一次制样可同时检测3种病原菌,5~ 10 min即可得到检测结果,提高了检测效率,适合基层生产推广应用及大量样本的快速筛查。
关键词:柱状黄杆菌;嗜水气单胞菌;海豚链球菌;免疫层析试纸条;三联体检测试纸
细菌性疾病是鱼类养殖过程中的最常见也是危害最大的一类疾病,病原菌种类较多,危害严重,如由柱状黄杆菌(Flavobacteriumcolumnare)引起的细菌性烂鳃病、由嗜水气单胞菌(A. hydrophila)引起的细菌性败血症以及由链球菌引起的链球菌病,一旦发生,可在短期内造成很高的水生动物死亡率,给养殖业带来巨大的经济损失。对于鱼类细菌病的防治,使用抗生素仍是目前生产中使用的主要手段,但治疗效果并不理想,不仅提高了养殖成本,还带来一系列的负面影响。因此应对鱼类细菌病,日常消毒、早期预防以及有效的检测诊断、对症施治尤为重要。对细菌病的检测诊断,实验室多采用细菌分离鉴定法及PCR法来对病原菌做准确的鉴定,并通过药敏分析筛选敏感药物指导生产,针对性较好,但耗时长,需要专业的实验室及操作人员。养殖生产中则主要依靠技术人员的经验,具体病原菌并不十分确切,用药存在盲目性,且多数细菌性疾病为多种病原菌混合感染导致,不同细菌对药物的敏感性不同,所使用的药物与治疗方法也不尽相同。养殖生产中亟需一种适用于养殖现场的鱼类细菌性病原菌的快速、准确、简便的检测技术,以及早确定病原菌,采取有效措施控制病害发生,为养殖生产提供技术支撑。
胶体金免疫层析试纸是20世纪末发展起来的一种新型的体外诊断技术产品,具简便快速、灵敏准确等优点,不需要专业仪器设备,操作简单,适用于现场检测。目前,胶体金免疫层析试纸在医学及畜牧疾病检测领域已有较多的应用,如检测乙肝病毒、猪链球菌Ⅱ型、金黄色葡萄球菌、H5、H9亚型禽流感病毒、犬弓形虫等的试纸条[1-4]。在水产病原菌生物检测领域,已分别建立了用于检测溶藻弧菌、迟缓爱德华氏菌、豚鼠气单胞菌、创伤弧菌、对虾白斑病病毒[5-9]等的免疫层析试纸条,均针对于某一种病原菌进行检测。本研究制作了柱状黄杆菌、嗜水气单胞菌、海豚链球菌的免疫层析试纸条,并将其组装成三联检测试纸,用于3种鱼类病原菌的同时检测,提高了检测效率,适用于大量样本的现场筛查,也为水产动物疾病的系统诊断提供参考。
1 材料
1.1仪器与试剂
18~20 nm胶体金溶液、硝酸纤维素膜(NC膜)、玻璃纤维、吸水纸、PVC板均购自上海杰一生物技术有限公司;羊抗兔IgG购自北京康为世纪公司;牛血清白蛋白(BSA)、Tween-20、蔗糖购自生工生物工程股份有限公司;单维往复划膜仪购自上海金标公司,细菌比浊仪购自法国梅里埃公司,离心机购自Sigma公司。
1.2菌株来源
海豚链球菌(Streptococcusiniae)、柱状黄杆菌、美人鱼发光杆菌(Photobacteriumdamselae)、鱼肠道弧菌(Vibrio ichthyoenteri)、鰤鱼诺卡氏菌(Nocardia serio⁃lae)、无乳链球菌(S. agalactiae)、鳗利斯顿氏菌(Lis⁃tonella anguillarum)、迟缓爱德华氏菌(Edwardsiella starda)、哈维氏弧菌(V.harveyi)由本实验室分离并保存,类志贺邻单胞菌(Plesiomonasshigelloides)、弗尼斯弧菌(V.furnissii)、维氏气单胞(A.veronii)、嗜水气单胞菌由天津市水生动物疫病预防控制中心提供。
2试验方法
2.1细菌抗体的制备
取海豚链球菌、柱状黄杆菌、嗜水气单胞菌分别免疫新西兰白兔,得到兔抗海豚链球菌、兔抗柱状黄杆菌、兔抗嗜水气单胞菌3种抗血清,采用Protein A亲和层析法纯化所得到的抗血清,间接ELISA方法测定抗体效价,-80℃保存。
2.2金标抗体的制作
2.2.1最适标记pH值的确定
用0.01 mol/l K2CO3将胶体金溶液调至6.0~10.0不同的pH值梯度。取不同pH值的胶体金溶液各1 ml,分别加入抗海豚链球菌抗体(抗柱状黄杆菌抗体或抗嗜水气单胞菌抗体)10 μg,振荡混匀后静置30 min,加入100 μl 10%的NaCl溶液混匀静置4 h,观察每管颜色变化,以颜色保持不变的pH点作为最佳标记pH值。
2.2.2最适标记蛋白量的确定
用0.01 mol/l K2CO3将胶体金溶液调至最适pH值,取6支EP管,每管各加入胶体金溶液1.0 ml,每管分别再加入1、5、10、15、20、25 μg的抗海豚链球菌抗体(抗柱状黄杆菌抗体或抗嗜水气单胞抗体)使其形成不同浓度梯度,混匀后静置30 min,加入100 μl 10%的NaCl溶液混匀静置4 h,观察每管颜色变化,将颜色变化最小一组的抗体标记浓度作为最佳标记浓度,工作浓度则选择最佳标记浓度高一个级别的浓度。
2.2.3金标抗体的制备与纯化
将胶体金溶液调至最适标记pH值,加入最适标记浓度的待标记抗体,混匀后静置;加入5%的BSA使其加入后终浓度为1%,混匀,将初步制得的金标抗体溶液4 000 r/min离心20 min,弃沉淀,上清液于13 500 r/min、4℃离心30 min弃上清,沉淀用金标抗体洗涤液(含1% BSA的PBS)洗涤2次后,用金标抗体保存液(含1% BSA,2%蔗糖,0.1% Tween-20的PBS)重悬保存于4℃。
2.3胶体金垫的制备
将纯化后的金标抗体均匀喷涂在玻璃纤维膜上,37℃干燥后保存备用。
2.4 NC膜检测层的制备
用pH值7.4的0.01 mol/l PBS分别将羊抗兔IgG的浓度稀释为1、2 mg/ml,将细菌抗体分别稀释为3、2.5、2、1.5、1、0.5 mg/ml。然后设置胶体金三维喷点平台参数,在NC膜上分别喷涂1、2 mg/ml的羊抗兔IgG作为质控线(C线),在此基础上分别喷涂6个不同浓度的抗海豚链球菌抗体(柱状黄杆菌多克隆抗体或嗜水气单胞菌抗体)作为检测线(T线),形成12个不同的组合。将包被有抗体的NC膜室温干燥后完全浸润到1% BSA(由0.01 mol/ml PBS配制)中封闭1 h,取出洗涤3次,干燥后,组装成试纸条。以纯培养的海豚链球菌菌液(柱状黄杆菌或嗜水气单胞菌)测试,观察质控线和检测线的显色情况,确定质控线和检测线处包被抗体的最适浓度。
2.5试纸条的组装
将已包被抗体的NC膜检测层依次与吸水纸、胶体金垫、玻璃纤维固定于不干胶底板上组装,用裁条机将其裁切成4 mm宽的试纸条,切好的试纸条与干燥剂一起放入铝箔袋中密封保存于4℃。
2.6 3种试纸条灵敏度的测定
分别调整纯培养的3种细菌菌液浓度为3×108~ 3×102cfu/ml,PBS作为阴性对照,取相应的试纸条进行检测,观察显色结果;再将检测后的试纸条的NC膜检测层剪下,用0.05 mol/l的柠檬酸盐缓冲液(pH值3.8)洗涤平衡5 min后,放入银染液中,避光20 min,观察银染结果,以肉眼能够观察到的检测线出现条带的最低可测试量作为试纸条的灵敏度。
2.7 3种试纸条特异性的测定
取1.2节中所提到的细菌均调整细菌菌液浓度至3×108cfu/ml,以PBS作为阴性对照,测试3种试纸条的特异性。
2.8三联体卡条的组装及应用
将制作好的3种检测试纸裁成6 mm×3 mm的大小封入三联卡槽中,即成鱼类病原菌三联现场检测试纸。使用时取待检病鱼病灶处组织(体表溃烂处、肝、肾、腹水等,5 mg)加0.5 ml PBS研磨,静置取上清液作为待检液,分别取0.1 ml待检液加入鱼类病原菌三联现场检测试纸的三个加样孔中,静置,10 min内观察结果。若某一结果观察窗的T线和C线均出现红线,显示对应的菌的检测结果为阳性;仅C线出现红线显示结果为阴性;仅T线出现红线而C线未出现红线或者二者均不出现红线显示试纸条无效。若2个及以上的细菌检测结果为阳性,显示结果为多种菌的混合感染。
三联体卡条检测结果的验证:嗜水气单胞菌的检测结果采用RS培养基进行细菌分离培养、PCR扩增嗜水气单胞菌丝氨酸蛋白酶(AHP)基因[10]、结合病鱼症状进行验证;海豚链球菌的检测结果采用细菌分离培养、PCR扩增该菌16S rRNA的保守区域[11]、结合病鱼症状进行验证;柱状黄杆菌的检测结果采取选择性培养基进行细菌分离(含1% Tobramycin的shieh培养基分离)结合病鱼症状、显微镜镜检进行验证。
3 结果
3.1金标抗体的最适标记条件
3.1.1最佳标记
pH值以抗海豚链球菌抗体的胶体金标记结果为例(见图1)。加入等量的抗体,1号管内的颜色变蓝,2~5号管的pH值保持均一红色。因此,选择海豚链球菌金标抗体的最适标记pH值为7.0。同样方法得出,嗜水气单胞菌金标抗体的最适标记pH值为7.0,柱状黄杆菌金标抗体的最适标记pH值为8.0(见表1)。

图1海豚链球菌金标抗体标记最适pH值
3.1.2最佳标记蛋白量
调整胶体金的pH值为7.0,加入不等量的抗体(结果见图2)。1号和2号管均变蓝,说明蛋白的加入量过少;3~6管内的颜色保持不变,选择颜色保持不变的抗体标记量为最佳标记量,工作浓度选择比最佳标记浓度高一个级别的浓度点,因此选择10 μg/ml作为海豚链球菌金标抗体的最佳标记量。同样方法得出,嗜水气单胞菌金标抗体的最佳标记量为15 μg/ml,柱状黄杆菌金标抗体的最佳标记量为15 μg/ml(见表1)。
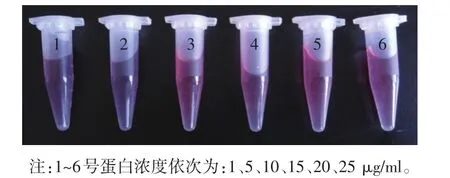
图2海豚链球菌金标抗体最佳抗体标记量
3.2检测线和质控线最适包被浓度
NC膜检测层上检测线和质控线处抗体的包被浓度直接影响检测结果。以海豚链球菌免疫层析试纸条为例,试验结果显示,在NC膜检测层的检测线处包被浓度为1.5 mg/ml或2 mg/ml的抗海豚链球菌抗体,检测线显色结果较好,低于1.5 mg/ml检测线显色变浅,质控线浓度为1 mg/ml或2 mg/ml显色效果无明显变化(见表2)。因此,最终选择检测线上包被1.5 mg/ml的抗海豚链球菌抗体,质控线上包被1 mg/ml的羊抗兔IgG。同样方法测得嗜水气单胞菌和柱状黄杆菌试纸条检测线和质控线处所包被的相应抗体的最适包被浓度(见表3)。
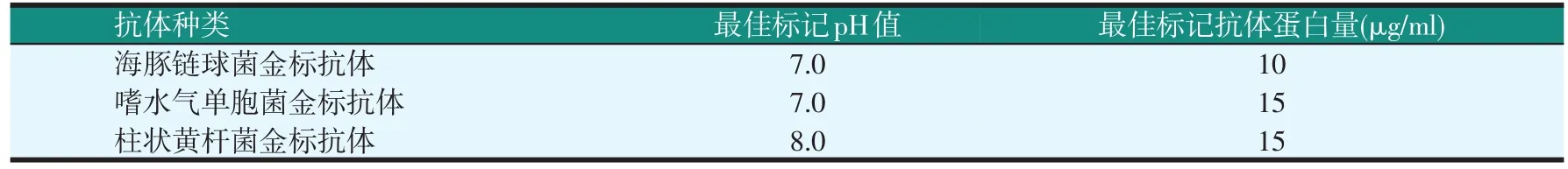
表1胶体金标记的最适条件
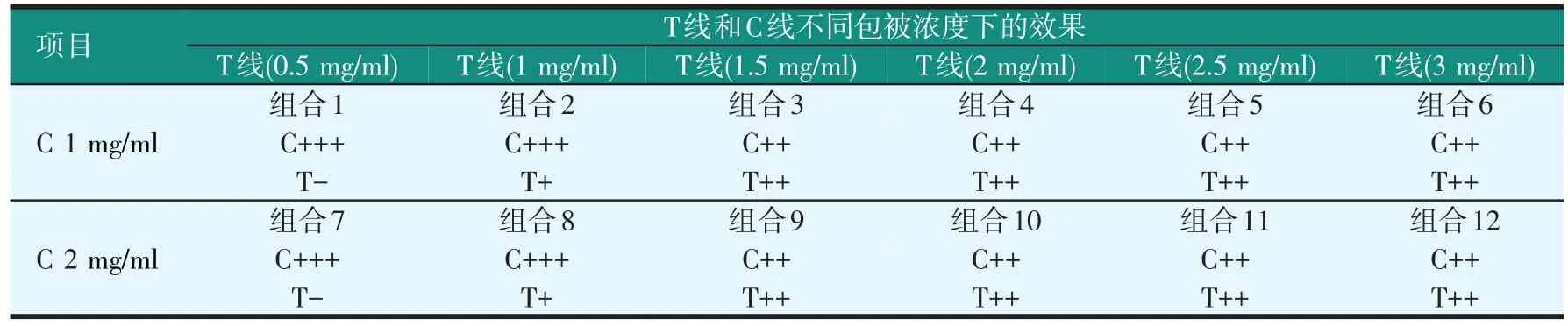
表2检测线和质控线最适包被浓度

表3检测线和质控线最适包被浓度(mg/ml)
3.3 3种试纸条的灵敏度分析
以最适标记条件制作金标抗体及胶体金垫,以最适浓度抗体包被制作NC膜检测层,组装成试纸条,采用10倍比稀释的对应菌液测试所制作试纸条的灵敏度,以试纸条所能检测菌液的最低限度作为该试纸条的灵敏度,结果显示嗜水气单胞菌和海豚链球菌试纸条的检测灵敏度均为3×105cfu/ml,经银染放大检测信号后灵敏度为3×104cfu/ml;柱状黄杆菌的灵敏度稍低,为3×106cfu/ml,经银染放大检测信号后灵敏度为3×105cfu/ml。
3.4 3种试纸条的特异性分析
以1.2中所列细菌检测3种试纸条的特异性,结果显示柱状黄杆菌试纸条仅对柱状黄杆菌菌液的检测结果为阳性,对另外12种菌液的检测结果为阴性;嗜水气单胞菌试纸条仅对嗜水气单胞菌的检测结果为阳性,对另外12种菌液的检测结果为阴性;海豚链球菌试纸条仅对海豚链球菌的检测结果为阳性,对另外12种菌液的检测结果为阴性;所制备的3种试纸条具有良好的特异性。
3.5三联体卡条的应用
挑选濒死且症状明显的鱼进行疾病诊察,疑为细菌病的病鱼,取肝脏、脾脏、腹水、肾脏组织或其它病变部位,研磨后取上清采用三联体卡条进行检测。试验共收集疑为细菌病的病鱼122例,其中检出嗜水气单胞菌阳性样品41个,实验室确诊阳性样品50个,符合率为92.6%,海豚链球菌阳性样品20个,实验室确诊阳性样品32个,符合率为90.2%,柱状黄杆菌阳性样品16个,实验室确诊阳性样品31个,符合率为87.7%。以上结果证实,制备的试纸条具有较高的准确性。部分检测结果如图3所示。
4 讨论
近年来,水产养殖动物的各种暴发性病害时有发生,危害也日益严重,每年由病害所致的直接经济损失至少为数百亿元以上。细菌性疾病是其中危害最为广泛的一类疾病,病原种类繁多,传播扩散快,发病情况复杂,多为多种病原混合感染,病原菌环境适应能力强,对抗菌素易产生耐药性,病害一旦发生,很难控制。现有检测技术试剂盒产品多针对于一种病原进行检测,效率较低,实验室检测可系统全面反映疾病发生的整体状况,但耗时长、成本高。李永芹[12]制备了6种病原菌的检测芯片,可用于海豚链球菌、鳗利斯顿氏菌、荧光假单胞菌、海分枝杆菌、迟缓爱德华氏菌、杀鲑气单胞菌的现场平行检测,提高了检测效率,整个检测过程仍需3 h以上。本研究分别制作了3种常见水产病原菌的试纸条,并将其组装成三联体卡条,仅需5~10 min便可同时检测3种病原菌,应用起来更加方便,尤其适用于基层推广及大量样本的快速筛查,为养殖鱼类疾病的现场快速诊断提供技术支持。
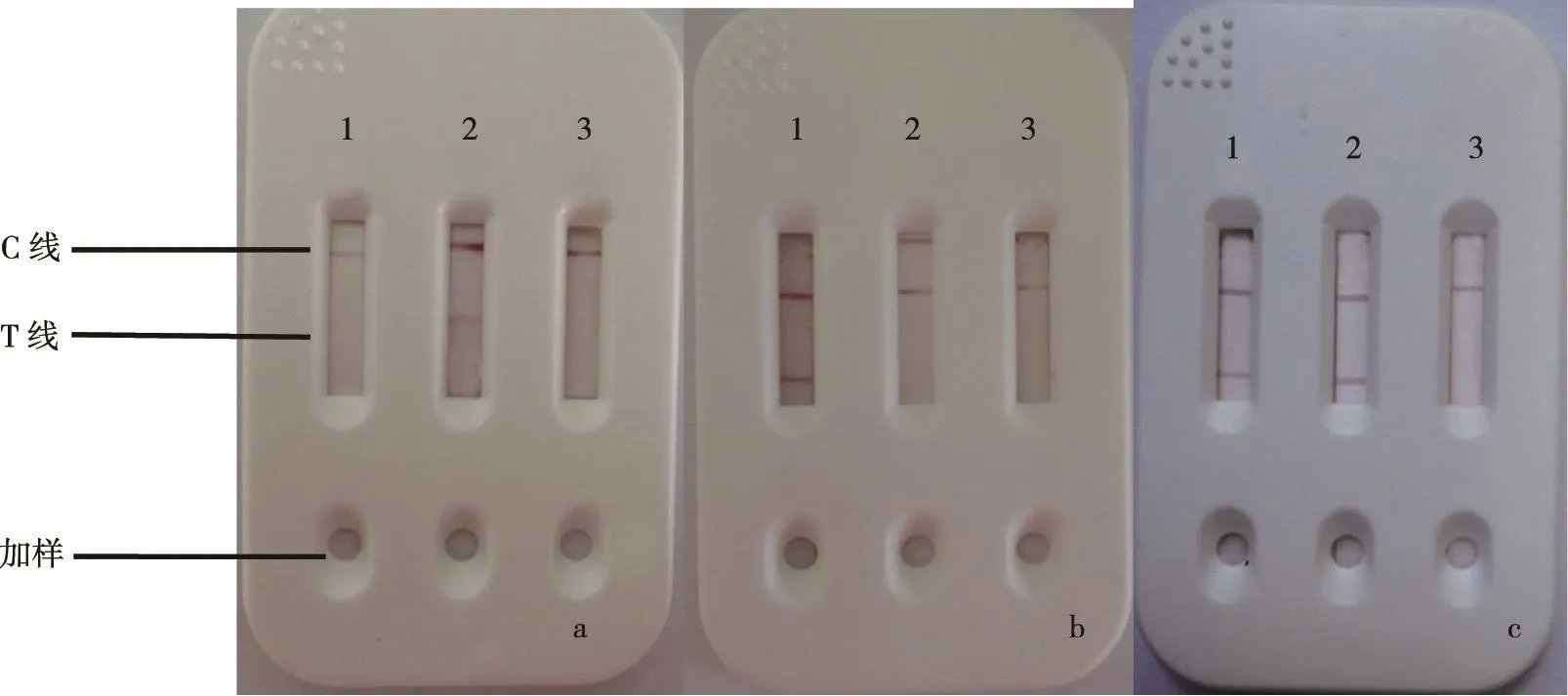
注:①1、2、3分别为柱状黄杆菌试纸条、海豚链球菌试纸条、嗜水气单胞菌试纸条;②a为待检样品中含海豚链球菌,b为待检样品中含柱状黄杆菌,c为待检样品中同时含海豚链球菌和柱状黄杆菌。图3部分样品检测结果
本研究所制备的3种鱼类病原菌三联体卡条,对海豚链球菌、嗜水气单胞菌的检测灵敏度均为3× 105cfu/ml,经银染放大检测信号后,检测灵敏度可达3×104cfu/ml,对柱状黄杆菌的检测灵敏度为3× 106cfu/ml,银染后可达3×105cfu/ml,与已报道的溶藻弧菌、迟缓爱德华氏菌、豚鼠气单胞菌、哈维氏弧菌、创伤弧菌检测试纸条的灵敏度相当,均在105~106cfu/ml。生产上一般认为,病原菌数量超过104cfu/ml可能导致鱼类发病。但水产病原菌多为条件致病菌,病原菌数量并非致病的决定性因素,病害发生是宿主、病原、环境三方面综合作用的结果。因此,本研究所制作的三联体卡条检测结果对生产上疾病的预防仍具有一定的参考意义。
在细菌检测应用中,采用全菌抗原制备的单克隆抗体容易出现漏检情况,尤其是对于抗原结构复杂的细菌来说,单克隆抗体并不占优势,并且单克隆抗体制备技术要求较高,制备周期长从而会增加试纸条的研发成本。本次所制作的试纸条采用的均为细菌全菌免疫制作的多抗,试验结果证实,所制作的试纸条具有较好的特异性和灵敏度,在实际应用中检测结果与实验室检测相比,符合率在87.7%以上,在一定程度上证明了采用多克隆抗体制备试纸条的可行性。
参考文献
[1]鞠莹,熊国华,曹远银.胶体金免疫层析法检测猪链球菌2型的研究[J].生物医学进展,2009,9(10):1881-1884.
[2]刘洪贵,武瑞.免疫层析法检测金黄色葡萄球菌的研究[J].中国预防兽医学报,2009,31(4):283-287.
[3]彭伏虎.禽流感与新城疫胶体金免疫层析快速检测技术及初步应用研究[D].武汉:华中农业大学,2008.
[4]张德林.弓形虫免疫金标快速检测试剂及制备方法:中国,200610104848.4[P]. 2008-04-30.
[5]王蓓,梁军,简纪常,等.溶藻弧菌免疫胶体金快速检测试纸条的制备[J].广东海洋大学学报,2013,33(4):50-55.
[6]秦璞,胡晓,张在阳,等.鱼类致病性迟钝爱德华氏菌胶体金快速检测试纸的研制[J].华东理工大学学报,2011,37(3):330-333.
[7]辛志明,樊海平,吴斌,等.豚鼠气单胞菌胶体金免疫层析试纸条的研制[J].水产学报,2009,33(4):680-684.
[8]严智敏,郑晶,陈清,等.创伤弧菌胶体金免疫层析试纸条研制[J].南方医科大学学报,2011,5(31):894-896.
[9]刘鹿山,绳秀珍,战文斌,等.对虾白斑综合症病毒胶体金免疫层析试纸条的优化及应用[J].中国海洋大学学报,2013,43(11):43-48.
[10]储卫华,陆承平.聚合酶链反应(PCR)法检测嗜水气单胞菌丝氨酸蛋白酶基因[J].中国兽医学报,2003,23(5):463-464.
[11]甘西,陈明,余小丽,等.罗非鱼海豚链球菌16S rRNA基因的序列测定和系统进化分析[J].水产学报,2007,31(5):618-623.
[12]李永芹.养殖鱼类病原菌芯片检测技术的建立[D].中国海洋大学,2010:1-127.
(编辑:沈桂宇,guiyush@126.com)
Development and application of triplet-immunochromatographic strip for simultaneous detection of three aquatic pathogens
Liu Yijuan, Sun Jinsheng, Bao Haiyan, Zhang Qin, Zang Li, Xu Xiaoli
Abstract:Immunochromatographic strips for detection of Streptococcus iniae, Flavobacterium colum⁃nareand Aeromonashydrophilawere developmented respectively and integrated as triplet-immunochro⁃matographic strip. The triplet-immunochromatographic strip was applied in simultaneous detection of three aquatic pathogens. Results showed that the triplet-immunochromatographic strip had no cross-re⁃action with other 12 kinds of aquatic pathogens and the sensitivities were both 3×105cfu/ml to S.iniae, A.hydrophila, 3×106cfu/ml to F.columnare. This method was applied in samples of diseased fish and concordance of the triplet-immunochromatographic strip with methods for detection of pathogens in the lab were above 87.7%. The operation was rapid, simple and 3 kinds of pathogens can be detected in 5~ 10 min simultaneously and the detection efficiency was improved. The triplet-immunochromatographic strip could be used in aquaculture on-spot and rapid screening of a large number of samples.
Key words:Flavobacteriumcolumnare;Aeromonas hydrophila;Streptococcus iniae;immunochromato⁃graphic strip;triplet-immunochromatographic strip
基金项目:天津市科技支撑计划项目[12ZCZDNC00900]
收稿日期:2015-10-03
通讯作者:徐晓丽,博士。
作者简介:刘亦娟,硕士,研究方向为鱼类病害防治。
中图分类号:S941
文献标识码:A
文章编号:1001-991X(2016)04-0056-05
doi:10.13302/j.cnki.fi.2016.04.014
