微流控技术在法医DNA快速检验方面的应用
2016-03-29韩俊萍李彩霞
韩俊萍,孙 敬,欧 元,叶 健,刘 耀,,李彩霞
(1.中国人民公安大学,北京100038;2.公安部物证鉴定中心北京市现场物证检验工程技术研究中心,北京100038;3.公安部物证鉴定中心法医遗传学公安部重点实验室,北京100038)
微流控技术在法医DNA快速检验方面的应用
韩俊萍1,孙敬2,3,欧元2,3,叶健2,3,刘耀1,2,3,李彩霞2,3
(1.中国人民公安大学,北京100038;2.公安部物证鉴定中心北京市现场物证检验工程技术研究中心,北京100038;3.公安部物证鉴定中心法医遗传学公安部重点实验室,北京100038)
摘要:微流控芯片技术因其微型化、自动化、高通量、集成化、快速等优势使得实验室研究产生革命性的变化,并在生物化学、医学等诸多领域得到广泛应用,但目前还没有基于微流控芯片技术的国产全集成自动化DNA分析仪。该文总结微流控技术在DNA提取、PCR扩增、电泳分离等DNA检验流程方面的研究现状与进展,尤其是在法医DNA快速检验方面的研究进展,同时介绍国内外全集成式DNA分析的研究状况。全集成与功能化是目前微流控技术研究的主流方向。未来,以微流控芯片为主导的全自动、便携式、集成化的DNA分析系统,将使得法医DNA检验从实验室走进案件现场甚至日常生活,实现真正的快速即时检验。
关键词:微流控芯片技术;DNA快速检验;综述;全集成
0 引言
自20世纪90年代以来,PCR-STR分型技术以其特异性好、检测灵敏度高、能复合多位点扩增等优点成为第二代法医DNA分型技术的核心。传统的法医DNA检验过程包括生物检材提取、DNA提取和定量、PCR复合扩增、毛细管电泳等,整个过程大约需8~10h[1],不仅耗时耗力,须购置特定的实验仪器,大多步骤以及反应之间的转换需手工操作,而且需要专业人员进行操作。随着DNA检验技术的推广应用,DNA物证检验量迅速增长,在我国乃至世界范围内,因检验处理能力不足导致物证大量积压的现象普遍存在,同时一些大案要案常需要在短时间内提供检验结果,为案件快速处置、侦查诉讼等提供及时的线索和证据。因此,要从根本上解决日益紧迫的DNA物证检验量所带来的压力,实现DNA检验全部流程的高通量、集成化和自动化是必然选择。从20世纪90年代逐渐兴起的微流控芯片技术具有体积小、样本和试剂消耗少、分析成本低、分析速度快、易于实现操作流程集成化和自动化等诸多优势[2],为实现法医DNA快速分析开辟了一条新途径。
1 微流控芯片特点
微流控芯片分析系统,即微全分析系统(micro total analysis systems,μTAS),由于采用微机电技术,可在一块几平方厘米的芯片上集成实验室分析的各种操作与功能。微流控芯片技术的优势在于多种学科交叉,如将分析化学、微机电加工与生物学、医学等交叉,能够实现从样品处理到检测与分析的整体微型化、集成化、自动化、便携化、高通量检测等目标,被广泛用于临床检验、新药合成与筛选、生物医学中人类基因与疾病关系研究,以及环境检测、食品卫生安全、刑事科学、军事科学及国防等涉及化学成分分析的领域[3]。
2 微流控芯片研究现状及进展
诸多学者从微流控技术角度出发,对涉及DNA快速检验,包括芯片DNA提取、芯片PCR扩增、毛细管芯片电泳及集成式芯片等各个方面进行了研究。
2.1芯片DNA提取技术
首先,芯片DNA提取技术方面,传统的DNA提取方法需要多次震荡、离心、转移等,操作费时,不易整合到芯片上,更不适于DNA的快速检验。早在20世纪90年代末,有学者就提出了基于芯片的硅柱固相提取DNA方法[4],将硅珠填充在反应腔室中或在芯片表面沉积一层二氧化硅,通过洗脱液的洗脱在短时间内即可得到纯度较高的DNA;但是,由于芯片装置复杂,加工成本较高,提取效率不易评估等缺点故而无法满足法医实际工作的需求。Duarte等[5]研发出基于固相萃取原理的玻璃材质DNA提取芯片,利用二氧化硅微球、磁性微球等介质作为DNA的固相载体填充于芯片微沟道中,如图1所示。磁性微球构成的动态捕获层能够实现对精斑、血液等生物样品中DNA的提取与纯化,从0.6μL全血中提取DNA的回收率超过60%。但是,玻璃芯片加工制作存在工艺复杂、成本高等缺点,限制了其广泛应用,故价格低廉、加工方便的材料成为研究者们的理想选择,各种聚合物基底[6]如聚甲基丙烯酸甲酯(PMMA)、聚碳酸酯(PC)等已经被用于构建DNA提取系统。国内,刘惯超等[7]应用PMMA芯片制作了非填充式DNA提取芯片,从血中提取DNA且能够满足后续PCR的需要。王聿佶等[8]研究了PDMS芯片DNA微分析系统,将磁珠固相提取技术与微流控芯片相结合,成功完成大肠杆菌热裂解、DNA提取至PCR扩增的全过程,为单芯片上集成多功能提供了可能。
上述微流控芯片的固相提取方法原理都是以二氧化硅微球为载体,采用高离液盐进行DNA吸附、有机溶剂洗脱,最后使用低离子缓冲液洗脱DNA。由于提取过程中采用诸如异硫氰酸胍等离液盐及有机溶剂等,其残留将影响下游PCR扩增,因此不利于微流控集成PCR。为了避免这一问题,有研究者开发了其他在芯片上的提取方法,例如基于pH诱导的静电吸附DNA提取[9]、基于UV活化的聚碳酸酯表面的DNA提取[10]、基于纳米多孔过滤膜的DNA提取[11]。
2.2芯片PCR扩增技术
PCR芯片根据其液体流动方式可分为微反应腔式PCR芯片(micro-chamber PCR chip,MC-PCR)和连续流动式PCR芯片(continuous flow PCR microchip,CF-PCR)。其中,微反应腔PCR芯片实际上是传统PCR的微型化,将反应混合物固定在微反应池内,通过外部对其不断加热与制冷来实现温度循环,该种芯片具有体积小,结构简单,易于制作成一次性、集成度高、易于整合其他功能芯片的特点。连续流动式PCR芯片,是将反应混合物于3个恒温区内连续流动,每流过3个温区即完成一次扩增,具有反应速度快、扩增时间短的特点。
Kopp等[12]在1998年首次报道了一种玻璃连续流动型PCR芯片,在90s内成功实现对176bp的DNA片段的扩增。早期的连续流动型PCR芯片由玻璃或硅片制成,为了降低成本,提高芯片的整体性能,有研究者研制出塑料-ITO玻璃[13]结构的连续流动式PCR芯片,实现直接在片荧光检测,简化检测步骤。此外,有以微型蠕动泵、注射泵等机械力,或电磁力作为连续流动PCR芯片的驱动方式。例如Bu等[14]研究出一种基于硅-玻璃材料,集成3对Pt微加热器和温度传感器,采用压电蠕动泵驱动方式,使得反应液在95,72,55℃3个温区往复运动,加热或冷却不到1s即能达到设定温度。由此可见,连续流控式芯片是通过时间和空间的转换而实现PCR扩增,反应速度取决于样品的载入速度,在每个温区停留时间取决于管道的路径设计,可以优化这些参数而实现快速高效的扩增。
为了缩短PCR反应时间,同时能够实现高通量PCR,且便于集成化,诸多学者研制出微反应腔式PCR芯片。在高通量扩增和高灵敏度检测方面,比较典型的是Matsubara Y等[15]制作的具有1248个微反应腔室的PCR阵列芯片,该芯片每个微腔体积仅为40nL,只需0.4拷贝的模板浓度即可实现对β-actin、SRY、RhD等基因的扩增,从而证实芯片PCR适于进行大批量生物样品高灵敏扩增检测。国内,吴志勇等[16]利用ITO玻璃制作了简单低价的微池型PCR芯片,以自温度传感方法稳定控温,对λDNA的一个233bp片段进行扩增,并实现8个PCR腔室同时扩增。但是,由于温度循环仍依赖于温控系统的加热和冷却速率,故扩增速度的大幅提高仍受限制,同时存在温控系统结构复杂、体积较大的缺点,也限制了其应用。
提高芯片温度控制效率是实现芯片快速PCR的关键,采用热风循环、非接触式红外辐射等加热方式,或通过微机电技术加工小型微加热器和温度传感器等方式能够提供更快的升降温速率。液滴PCR技术也为微流控芯片快速PCR的发展带来了新的曙光,有研究[17]采用微升体积的液滴在铝膜芯片上建立了一个简单实时的微升样本的液滴PCR体系,通过采用基于液滴的循环热水方式和熔解曲线的实时分析在3.5min内完成40个循环扩增,与传统PCR方法相比,显著缩短扩增时间。
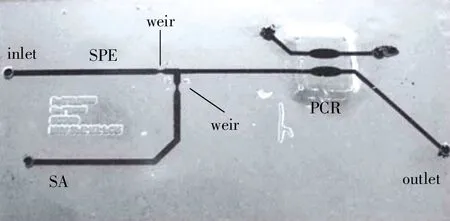
图2 SPE-PCR装置图

图3 红外PCR系统的组装模具照片
由上述可以看出芯片PCR已广泛应用于生物、化学、医学等领域,其在法医DNA领域的应用也日益增多,Belgrader等[18]最早报道将微流控芯片PCR应用到法医STR分析领域,构建了PCR芯片和实时荧光检测固态光学系统的微型热循环仪,其扩增速度明显快于传统PCR仪。通过水凝胶制作固相封装微珠技术预先包埋反应试剂,并结合准确的微流体计量和分配方法能够有效进行扩增,同时有利于与上游样本处理及下游电泳检测相集成[19]。此外,具有代表性的研究有(如图2所示),2011年Landers小组以非接触式的红外加热方式进行热循环扩增,结合SpeedSTARTMHS DNA聚合酶,在45min内完成16个STR位点扩增[20]。Mathies小组则以接触式温度控制方式实现芯片上的PCR扩增,并在芯片上将PCR与毛细管电泳(capillary electrophoresis,CE)结合[21],证明了芯片PCR-CE快速检测的可行性和快速灵敏检测的潜力。此外,有学者也将DNA提取和PCR扩增两个步骤成功集成于一张芯片,如Lounsbury等[22]以一次性使用的PMMA塑料设计加工芯片,通过流体控制密封阀并结合红外加热系统,能够在42min内完成从口腔拭子或全血样本进行DNA制备和PCR扩增过程,这种塑料集成式的微装置显示出其在临床即时诊断及法医DNA快速分析等方面应用的可能性。为了实现多个样本的同时扩增,Lounsbury等[23]在设计的PMMA多通道扩增芯片上,利用快速DNA酶和红外扩增系统(如图3所示),39min就能够同时完成最多7个样本的STR扩增,不仅提高了检测通量,而且缩短了DNA分型时间,同时降低了每个样本的检测成本,更体现出微流控技术在法医DNA快速分析中的优势。
2.3毛细管芯片电泳技术
毛细管芯片电泳技术,早期主要集中在芯片毛细管电泳的进样方式、流体控制及影响分离柱效的因素等基础性研究工作中。毛细管电泳芯片由于尺寸小能够施加较高场强,因而其分离速度较普通毛细管电泳快很多,在几秒钟内就能完成样品的分离;但如果电泳芯片仅有一条分离管道,其检测通量无法满足大批量样品分离分析的需求;因此,微阵列毛细管电泳芯片的研究受到越来越多的关注。Mathies小组研究出一种集合96个分离管道于1张如CD光盘的微流控阵列毛细管电泳芯片,2min即可平行检测96个DNA片段[24]。Emrich等[25]研制出一个半径仅为8 cm的圆盘上集成了384个通道的毛细管电泳芯片,可于325s内完成384份样品检测,检测速度与通量均有显著提高,也进一步显示出微流控技术在快速分析方面的巨大优势。
由于芯片毛细管电泳具有样品消耗少、分析速度快、灵敏高效等优点,特别适于法医DNA快速分析的需求。如Ehrlich实验室利用长为20cm玻璃材质的微阵列毛细管电泳芯片[26],在40 min内同时分离16个PowerPlex16试剂盒的扩增产物,分型成功率达95.8%。Mitnik[27]报道了利用毛细管电泳芯片-激光诱导的荧光检测系统在20 min内分离8个STR基因座,单碱基分离度为0.75~1,该体系重复性良好,后续将集成样本自动导入模块并拓展以实现高通量多管道同时分析。如图4所示,Yeung等[28-29]构建的高通量微阵列毛细管电泳芯片30 min内实现了96个微管道同时进行16个STR位点的分离检测,进样体积仅需1nL,并且检测时间短于传统的商业化电泳仪,充分证明了毛细管电泳芯片在法医STR检测方面的能力和优势[29]。当然,微阵列毛细管电泳装置不仅能应用于基因组DNA的快速分离,也能够进行线粒体DNA测序,分辨率达到1 bp,准确度达99%[30]。为了降低使用成本,防止样品间发生交叉污染,杨茜等[31]构建了一次性使用的PMMA毛细管电泳芯片,采用双通道共聚焦激光诱导荧光检测方法,在3min内分离出两个STR位点的等位基因分型标准物。Shi等[32]构建了塑料材质的微整列电泳平台,在长4.5 cm的微管道中10 min内完成对4个STR基因座的等位基因分型标准物的分离,单碱基分辨率达0.62。由于电泳得到未知样本的分型需要与等位基因分型标准物进行比对才能确定,因此单通道电泳芯片无法满足这一要求,需要研制多通道同时检测的电泳芯片。Mathies实验室搭建了具有4通道的微阵列芯片电泳装置[33](见图5),在有效分离长度为10 cm的芯片上实现9个STR基因座的分离,该装置的检测限为25个拷贝。2010年,同一实验室又开发出集成PCR扩增的便携式共聚焦荧光扫描的多通道毛细管电泳检测平台[34],能够在分离长度为7cm的芯片上同时完成96个样本的检测,检出限为20pmol/L。
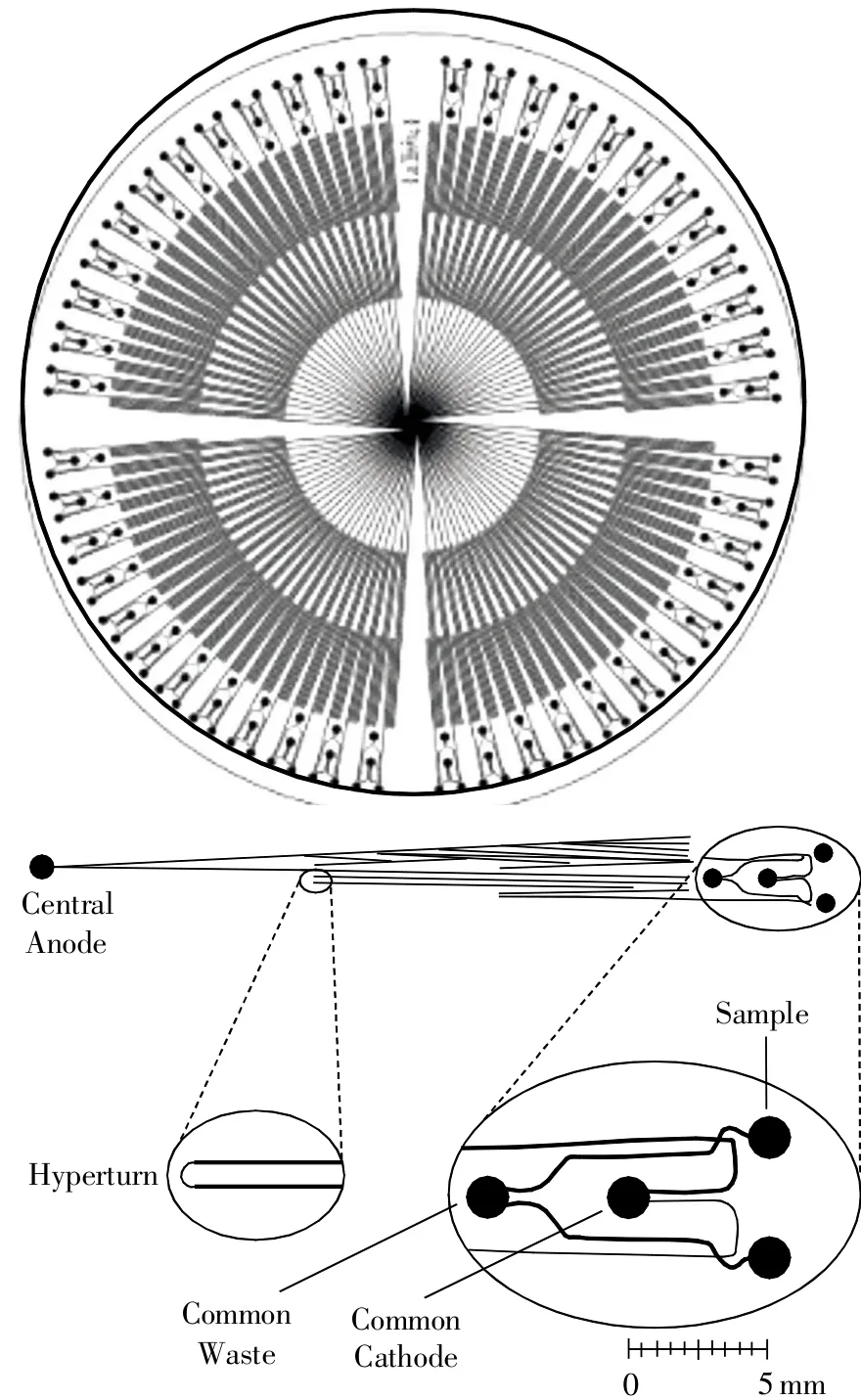
图4 96通道微阵列电泳芯片结构图
目前,芯片毛细管电泳已从实验研究阶段逐步向产业化方向发展,已上市的仪器如美国Aligent公司的5100 Automated Lab-on-a-chip Platform和2100 BioAnalyzer System、Caliper公司的LabChipRGX Touch HT Capillary Electrophoresis System等,能够实现对DNA、RNA、蛋白质等高通量的分离分析。
2.4集成式芯片
在集成式芯片研究方面,尽管将法医DNA分析全流程完全集成于一体存在很大挑战,但是一些研究者已尝试利用微流控系统将各种步骤与芯片毛细管电泳相结合[35]。如Delphine等[36]构建了用于法医STR快速分析的自动进行PCR扩增和芯片电泳的系统,该体系基于一次性使用的塑料芯片,以非接触式红外加热方式45min完成扩增,在长度为7cm的电泳芯片上15min完成电泳分离。Bienvenue等[37]成功制作了集成样本DNA的固相提取和PCR-STR位点复合扩增的芯片,通过注射泵作为压力驱动对全血和精斑样本提取DNA并纯化,然后在线完成PCR扩增,但产物电泳检测仍然在传统的毛细管电泳仪上完成。Hagan等[20]设计的集固相提取和PCR于一体的STR分型装置,采用SpeedSTARTM HS DNA聚合酶并结合红外加热方式,45min完成对口腔拭子的提取及16个STR位点PCR扩增,产物仍需在芯片外进行检测分析。季旭等[38]设计并制作了一种集成微池PCR和毛细管电泳的生物芯片,实现了PCR扩增、毛细管电泳分离和检测的单片集成。但是,由于样品是在微反应池内完成的扩增,PCR产物需要采取一定的手段才能将样品引入毛细管电泳沟槽中。Liu等[39]于2007年开发出世界上第一款用于法医DNA检验的集成式微系统。该系统将PCR与毛细管电泳集成在一块芯片上,并具有与芯片相配套的检测控制系统。通过与佛罗里达州棕榈滩郡警察局合作,成功实现了在模拟犯罪现场对DNA进行快速分型检验[40]。
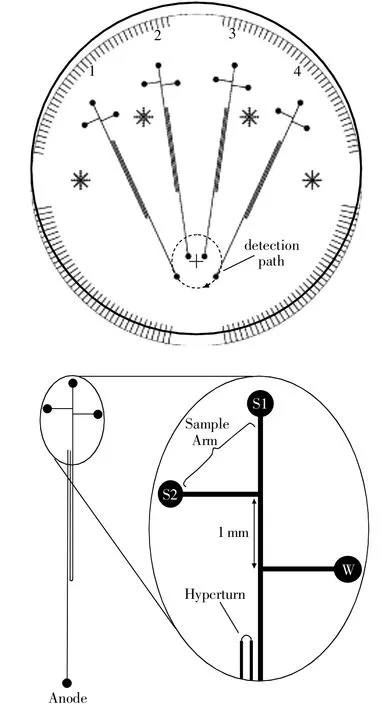
图5 4通道捕获-微流控电泳芯片设计图
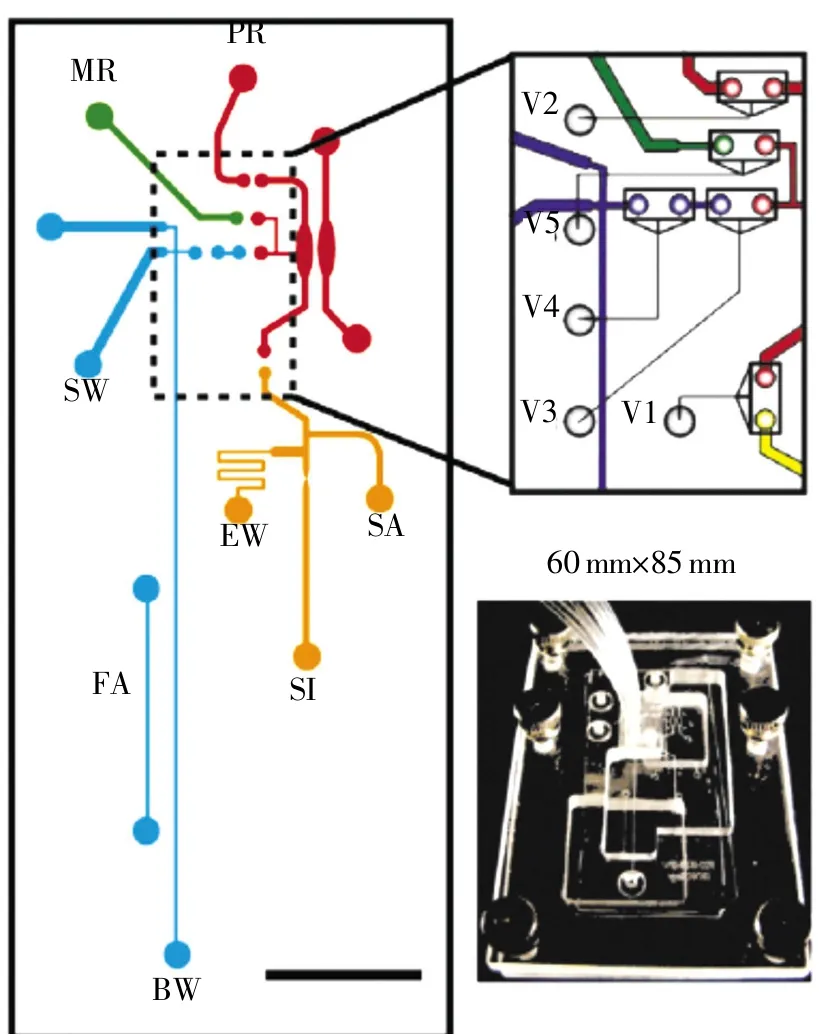
图6 病原体检测的全集成芯片
上述微流控芯片仅仅完成DNA检验流程中的一个或两个步骤,其他步骤还需要传统实验室技术的辅助,无法实现真正的集成化与自动化,因此,只有将各种微流控芯片技术有机结合,才能实现“样品入-结果出”的整合目标,最大限度地减少人工操作。2006年,Easley等[41]首次将“样本入-结果出”式的微流控芯片用于来自血液样本的炭疽杆菌的基因检测,芯片结构如图6所示,利用该集成系统进行固相提取,PCR扩增,电泳分离实现检测分析,但由于只能单通道检测且分辨率较低还无法用于法医STR分析。Hopwood等[42]报道了一套能够从口腔拭子样本得到STR分型的全集成微流控系统,整个过程无须人工干预,但样本处理过程复杂,耗时4h仅能完成一个样本检测,而且现有软件尚无法对所有产物峰进行等位基因标记。Liu等[43]于2011年将DNA捕获、扩增、纯化以及毛细管电泳全部集成在一块微流控芯片上,实现了3 h内完成对口腔拭子STR分型检验,该款芯片与以往相比,集成度有进一步提高。2014年,Delphine等[44]在前期工作基础上,成功研发出用于法医个体识别的全集成式的微流控芯片,芯片结构如图7所示,该芯片由塑料制成,包括基因分型全过程:一种独特酶反应液的DNA制备、红外非接触式PCR扩增及高分辨率的电泳分离,并证明了2h能够从口腔拭子和FTA卡样本得到18个STR基因座分型,且检测结果与传统方法完全一致。
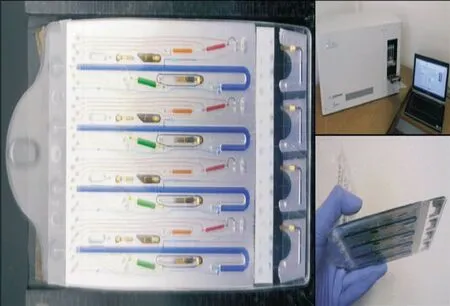
图7 “样本入-结果出”式全集成流程及结构图
3 结束语
最近,一些公司也陆续推出商业化的全自动DNA分型检测仪器。如2013年,美国IntegenX公司全球首家推出RapidHIT 200 DNA快速检测仪,利用PowerPlex16HS试剂盒,90 min内即可同时完成5~7份诸如血斑、唾液斑等生物样本的DNA检验,其分型结果可与DNA数据库进行比对[45-49]。该款仪器最新升级后能够与GlobalFiler Express试剂盒兼容使用,并行检测7份样本,同时也验证了其对大量样本(150份口腔拭子)检测的准确性及检测灵敏度(37.5ng)[50]。同年,GE与Network Biosystems公司合作也推出了DNAScan现场快速检验仪,85min内可同时完成5份生物样本的16个基因座的DNA检验,该仪器包含能够自动基因分型的专家系统及RFID追踪功能,并对其各个模块的稳定性、鲁棒性,样本的适应性,检测灵敏度等性能进行了验证[51]。2014年,LGC实验室研发的ParaDNA Screening系统通过样本收集器同时进行4份样本的制备,采用screening模块对2个STR位点和性别位点进行PCR扩增,通过探测HyBeacon探针的荧光强度变化得到DNA检测值,根据检测值来判断得到STR分型的可能性,整个过程仅需75min。Dawnay等[52]验证了ParaDNA Screening系统的灵敏度、重复性、准确性及抗抑制物的能力,同时测试了其在处理模拟检材时的性能。Ball等[53]比较了ParaDNA Screening系统和传统STR试剂盒对381份样本的检测情况,分型的一致性达到98.4%,表明该系统能够有效辅助法医DNA人员的现场检测。上述用于法医STR快速分析的3款商业化全集成DNA分析仪的具体[54]比较如表1所示。虽然以上系统均以微流控技术为核心,将提取、扩增和电泳均整合在一台仪器上,但仍然存在一些缺点,如微流控芯片结构复杂,成本高,无法实现推广应用;芯片的适用性有限,只能处理特定类型的样品;仪器体积笨重,无法实现便携化;只是部分利用微流控技术,没有将微全分析系统的优势完全发挥出来等。
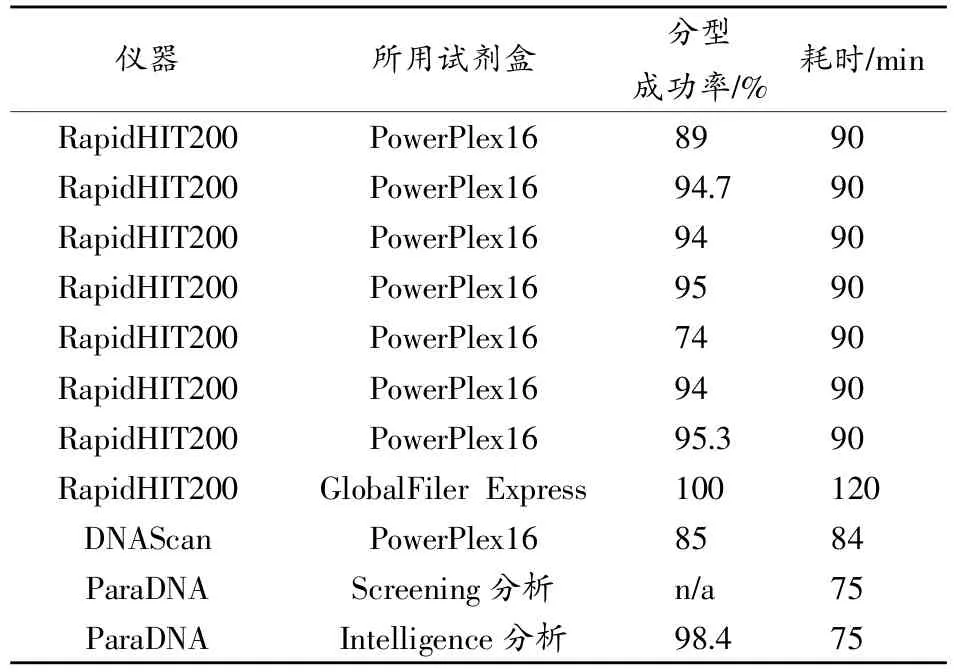
表1 商业化全集成DNA分析仪的比较[54]
微流控芯片作为一种革命性的技术平台,主要的发展趋势表现在外观尺寸由实验室桌面型或大型设备向便携化、手持式发展;检测模式由依赖实验室检测向现场即时检测发展;应用领域由生物化学、医疗诊断向食品安全、环境检测等领域扩展。近几年微流控芯片技术在DNA快速检测方面取得了突破性进展,引起产业界的很大关注,国外推出的3款商业化的快速检验仪器,以满足法医DNA现场即时检验的需求,但国内尚属空白,因此,我们期待我国科研人员加强产业化意识,积极革新技术,自主开发一款适于我国DNA快速检验的低成本、高通量、便携式的现场快速检测仪器,以提升在全集成式DNA快速检验的国际竞争力。
参考文献
[1] BUTLER J M. Forensic STR typing:biology,technology and genetics of STR markers[M]. 2nd ed. New York:Elsevier,2005:207-211.
[2]方肇伦,方群.微流控芯片发展与展望[J].现代科学仪器,2001(4):3-6.
[3]何林.面向微流控芯片的微量血清分离方法的研究[D].长春:中国科学院长春光学精密机械与物理研究所,2006.
[4] TIAN H,HUHMER A F,LANDERS J P. Evaluation of silica resins for direct and efficient extraction of DNA from complex biological matrices in a miniaturized format[J]. Anal Biochem,2000,283(2):175-191.
[5] DUARTE G R M,PRICE C W,LITTLEWOOD J L,et al. Characterization of dynamic solid phase DNA extraction from blood with magnetically controlled silica beads[J]. Analyst,2010,135(3):531-537.
[6] REEDY C R,PRICE C W,SNOEGPWSLO J,et al. Solid phase extraction of DNA from biological samples in a post-based,high surface area poly(methyl methacrylate)(PMMA)microdevice[J]. Lab Chip,2011,11(9):1603-1611.
[7]刘惯超,肖宏,李荔,等.溶胶-凝胶法制作塑料基WDNA提取芯片以及应用于从人血中提取DNA[J].材料科学与工程学报,2007,25(1):122-124.
[8]王聿佶,陈翔,曹慧敏,等.一种新型微流体DNA提取芯片的研究[J].微纳电子技术,2007(9):853-856.
[9] CAO W,EASLEY C J,FERRANCE J P,et al. Chitosan as a polymer for pH-induced DNA capture in a totally aqueous system [J]. Anal Chem,2006,78(20):7222-7228.
[10] WITEK M A,LLOPIS S D,WHEATLEY A,et al. Purification and preconcentration of genomic DNA from whole cell lysates using photoactivated polycarbonate(PPC)microfluidic chips [J]. Nucleic Acids Res,2006,34(10):74.
[11] KIM J,GALE B K. Quantitative and qualitative analysis of a microfluidic DNA extraction system using a nanoporousAlO(x)membrane[J]. Lab Chip,2008,8(9):1516-1523.
[12] KOPP M U,MELLO A J,MANZ A. Chemical amplification:continuous flowPCRon chip [J]. Science,1998,280(5366):1046-1048.
[13] FUKUBA T,YAMAMOTO T,NAGANUMA T,et al. Microafbrieated flow-through device for DNA amplification -towards in situ gene analysis [J]. ChemEng J,2004,101(1-3):151-156.
[14] BU M Q,MELVIN T,ENSELL G,et al. Design and theoretical evaluation of a novel microfluidic device to be used for PCR[J]. J Micromech Microen,2003,13(4):125-130.
[15] MATSUBARA Y,KERMAN K,KOBAYASHI M,et al. Microchamber array based DNA quantification and specific sequence detection from a single copy via PCR in nanoliter volumes [J]. Biosens Bioelectron,2005,20(8):1482-1490.
[16]吴志勇,田晓溪,渠柏艳,等.透明导电玻璃(ITO)基材自加热传感静态芯片聚合酶链反应(PCR)[J].高等学校化学学报,2007,28(12):2259-2263.
[17] TERAZONO H,MATSUURA K,KIM H,et al. Homogenous measurement during a circulation-water-based ultrahigh -speed polymerase chain reaction and melting curve analysis device[J]. Jpn J Appl Phys,2014,53(6):6-8.
[18] BELGRADER P,SMITH J M,WEEDU V W,et al. Rapid PCR for identity testing using a battery-powered miniature thermal cycler [J]. JForensic Sci,1998,43(2):315-319.
[19] ESTES M D,YANG J,DUANE B,et al. Optimization of multiplexed PCR on an integrated microfluidic forensic platform for rapid DNA analysis [J]. Analyst,2012,137 (23):5510-5519.
[20] HAGAN K A,REEDY C R,BIENVENUE J M,et al. Avalveless microfluidic device for integrated solid phase extraction and polymerase chain reaction for short tandem repeat(STR)analysis [J]. Analyst,2011,136(9):1928-1937.
[21] LAGALLY E T,MEDINTZ I,MATHIES R A. Singlemolecule DNA amplification and analysis in an integrated microfluidic device [J]. Anal Chem,2001,73(3):565-570.
[22] LOUNSBURY J A,KARLSSON A,MIRANIAN D C,et al. From sample to PCR productin under 45 min:A polymeric integrated microdevice for clinical and forensic DNA analysis[J].Lab Chip,2013,13(7):1384-1393.
[23] LOUNSBURY J A,LANDERS J P. Ultrafast amplification of DNA on plastic microdevices for forensic short tandem repeat analysis [J]. J Forensic Sci,2013,58(4):866-874.
[24] SHI Y,SIMPSON P C,SCHERER J R,et al. Radial capillary array electrophoresis microplate and scanner for high-performance nucleic acid analysis[J]. Anal Chem,1999,71(23)::5354-5361.
[25] EMERICH C A,TIAN H J,MEDINTZ I L,et al. Microfabricated 384-lane capillary array electrophoresis bioanalyzer for ultrahigh-throughput genetic analysis[J]. Anal Chem,2002,74(19):5076-5083.
[26] GOEDECKE N,MCKENNA B,EL-DIFRAWY S,et al. A high -performance multilane microdevice system designed for the DNA forensics laboratory[J]. Electrophoresis,2004,25(10-11):1678-1686.
[27] MITNIK L,CAREY L,BURGER R,et al. Highspeed analysis of multiplexed short tandem repeats with an electrophoretic[J]. Electrophoresis,2002,23(5):719-726.
[28] YEUNG S H,GREENSPOON S A,MCGUCKIAN A,et al. Rapid and high-throughput forensic short tandem repeat typing using a 96 -lane microfabricated capillary array electrophoresis microdevice [J]. J Forensic Sci,2006,51(4):740-747.
[29] GREENSPOON S A,YEUNG S H,JOHNSON K,et al. A forensic laboratory tests the Berkeley microfabricated capillary array electrophoresis device [J]. J Forensic Sci,2008,53(4):828-837.
[30] YEUNG S H,MEDINTZ I L,GREENSPOON S A,et al. Rapid determination of monozygous twinning with a microfabricated capillary array electrophoresis genetic -analysis device[J]. Clin Chem,2008,54(6):1080-1084.
[31]杨茜,熊强,姜成涛,等.基于可弃型低成本PMMA电泳芯片的微型DNA分析系统[J].生物化学与生物物理进展,2009,36(4):506-511.
[32] SHI Y,ANDERSON R C. High -resolution single -stranded DNA analysis on 4.5cm plastic electrophoretic microchannels [J]. Electrophoresis,2003,24(19 -20):3371-3377.
[33] YEUNG S H,LIU P,DEL BUERNO N,et al. Integrated sample cleanup -capillary electrophoresis microchip for high-performance short tandem repeat genetic analysis[J]. Anal Chem,2009,81(1):210-217.
[34] SCHERER J R,LIU P,MATHIES R A. Design and operation of a portable scanner for high performance microchipcapillaryarray electrophoresis [J]. Rev Sci Instrum,2010,81(11):105-113.
[35] NJOROGE S K,CHEN H W,WITEK M A,et al. Integrated microfluidic systems for DNA analysis [J]. Top Curr Chem,2011(304):203-260.
[36] DELPHINE L R,ROOT B E,REEDY C R,et al. DNA analysis using an integrated microchip for multiplex PCR amplification and electrophoresis for reference samples[J]. Anal Chem,2014,86(16):8192-8199.
[37] BIENVENUE J M,LEGENDRE L A,FERRANCE J P,et al. An integrated microfluidic device for DNA purification and PCRamplificationof STR fragments[J]. Forensic SciInt Genet,2010,4(3):178-186.
[38]季旭,刘理天.一种集成PCR反应室与CE的生物芯片的研究[J].仪器仪表学报,2003,24(4):201-202.
[39] LIU P,SEO T S,BEYOR N,et al. Integrated portable polymerase chain reaction -capillary electrophoresis mi -crosystem for rapid forensic short tandem repeat typing[J]. Anal Chem,2007,79(5):1881-1889.
[40] LIU P,YEUNG S H,CRENSHAW K A,et al. Realtime forensic DNA analysis at a crime scene using a portable microchipanalyzer[J]. Forensic SciInt Genet,2008,2(4):301-309.
[41] EASLEY C J,KARLINSEY J M,BIENVENUE J M,et al. A fully integrated microfluidic genetic analysis system with sample-in-answer-out capability [J]. Proc Natl Acad Sci USA,2006,103(51):19272-19277.
[42] HOPWOOD A J,HURTH C,YANG J,et al. Integrated microfluidic system for rapid forensic DNA analysis: sample collection to DNA profile [J]. Anal Chem,2010,82(16):6991-6999.
[43] LIU P,LI X,GREENSPOON S A,et al. Integrated DNA purification,PCR,sample cleanup, and capillary electrophoresis microchip for forensic human identification[J]. Lab Chip,2011,11(6):1041-1048.
[44] DELPHINE L R,ROOT B E,HICKEY J A,et al. An integrated sample -in-answer -out microfluidic chip for rapid human identification by STR analysis [J]. Lab Chip,2014,14(22):4415-4425.
[45] JOVANOVICH S,BOGDAN G,BELCINSKI R,et al. Developmental validation of a fully integrated sampleto-profile rapid human identification system for processing single-source reference buccal samples [J]. Forensic SciInt Genet,2015(16):181-194.
[46] GANGANO S,ELLIOTT K,ANORUO K,et al. DNA investigative lead development from blood and saliva samples in less than ?two hours using the RapidHITTM Human DNA Identification System [J]. Forensic SciInt Genet Suppl Ser,2013,4(1):43-44.
[47] VERHEIJ S,CLARISSE L,BERGE M D,et al. Rapid-HITTM200:a promising system for rapid DNA analysis[J]. Forensic SciInt Genet Suppl Ser,2013,4(1):254-255.
[48] LARUE B L,MOORE A,KING J L,et al. An evaluation of the RapidHITRsystem for reliably genotyping reference samples [J]. Forensic SciInt Genet,2014(13):104-111.
[49] HOLLAND M,WENDT F. Evaluation of the RapidHIT TM 200,an automated human identification system for STR analysis of single source samples [J]. Forensic SciInt Genet,2015(14):76-85.
[50] HENNESSY L K,MEHENDALE N,CHEAR K,et al. Developmental validation of the GlobalFilerRexpress kit a 24-marker STR assay,on the RapidHITRsystem[J]. Forensic SciInt Genet,2014(13):247-258.
[51] TAN E,TURINGAN R S,HOGAN C,et al. Fully integrated,fully automated generation of short tandem repeat profiles[J]. Invest Genet,2013(4):16.
[52] DAWANY N,STAFFORD-ALLEN B,MOORE D,et al. Developmental validation of the ParaDNARscreening system-a presumptive test for the detection of DNA on forensic evidence items[J]. Forensic SciInt Genet,2014(11):73-79.
[53] BALL G,DAWNAY N,STAFFORD-ALLEN B,et al. Concordance study between the ParaDNARIntelligence Test, a rapid DNA profiling assay, and a conventional STR typing kit(AmpFlSTRRSGM PlusR)[J]. Forensic SciInt Genet,2015(16):48-51.
[54] ROMSOS E L,VALLONE P M. Rapid PCR of STR markers:Applications to human identification[J]. Forensic SciInt Genet,2015,18(4):90-99.
(编辑:莫婕)
Application of microfluidics technology in DNA rapid testing of forensic science
HAN Junping1,SUN Jing2,3,OU Yuan2,3,YE Jian2,3,LIU Yao1,2,3,LI Caixia2,3
(1. People’s Public Security University of China,Beijing 100038,China;2. Beijing Engineering Research Center of Crime Scene Evidence Examination,Institute of Forensic Science,Beijing 100038,China;3. Key Laboratory of Forensic Genetics,Institute of Forensic Science,Ministry of Public Security,Beijing 100038,China)
Abstract:Miniature,automatic and integrated with high throughput and rapid analysis,the microfluidic chip technology has brought revolutionary changes in laboratory experimentation in recent years and has been widely used in many research-based field,such as biochemistry and medicine. However,microfluidics is not yet introduced into home -made totally -integrated automation DNA analyzers. This paper has summarized the applications of microfluidics in DNA rapid testing,including DNA extraction,PCR amplification and electrophoresis separation,especially the advance of forensic DNA rapid detection. In addition,it also discussed the research state of the totally-integrated DNA analysis at home and abroad. Currently,full integration and versatility are the mainstream direction of microfluidic technology research. With the help of this system,rapid and real-time forensic DNA testing will not only be conducted in laboratories,but also at crime scenes and even in everyday lives.
Keywords:microfluidic chip technology;DNA rapid testing;summary;full integration
通讯作者:刘耀(1937-),男,山西河曲县人,研究员,研究方向为毒物毒品分析。
作者简介:韩俊萍(1986-),女,山西太原市人,博士研究生,主要从事法医遗传学相关方面研究。
基金项目:中央级公益性科研院所基本科研业务专项(2015JB005);公安部技术研究计划资助项目(2014JSYJA011)
收稿日期:2015-07-02;收到修改稿日期:2015-08-10
doi:10.11857/j.issn.1674-5124.2016.01.013
文献标志码:A
文章编号:1674-5124(2016)01-0053-08
