我国近海藻华灾害现状、演变趋势与应对策略*
2016-03-27
1 中国科学院海洋研究所 青岛 266071
2 中国科学院烟台海岸带研究所 烟台 264003
我国近海藻华灾害现状、演变趋势与应对策略*
于仁成1刘东艳2
1 中国科学院海洋研究所 青岛 266071
2 中国科学院烟台海岸带研究所 烟台 264003

有害藻华是近海常见的灾害性生态异常现象,不仅包括微藻形成的“赤潮”和“褐潮”,也包括大型藻类形成的“绿潮”。在许多海域,有害藻华问题一旦出现,就会持续很长一段时间,对海水养殖、生态安全和人类健康构成威胁。在我国,有害藻华已成为一类突出的海洋生态灾害问题。渤海海域、长江口及其邻近海域和南海近岸海域是 3 个典型的赤潮高发区,大规模暴发的赤潮对海水养殖业造成了严重破坏,也威胁到海域生态安全和人类健康。近期在南黄海和渤海海域还出现了绿潮和褐潮等灾害性有害藻华现象,受到高度关注。综合分析我国近海的有害藻华问题可以看出,我国近海藻华原因种呈现出多样化、有害化和小型化的演变趋势,这给藻华的监测和管理带来了许多困难。为有效防控有害藻华,有必要加强针对有害藻华的基础研究,阐明藻华原因种的多样性状况、藻华发生与生态系统健康的关系、藻华的演变趋势及其驱动因子、藻华演变可能造成的生态效应等基础问题,同时,应进一步加强对藻华的观测预警和控制防范能力。
有害藻华,赤潮,绿潮,褐潮DOI 10.16418/j.issn.1000-3045.2016.10.005
藻华灾害是由微藻或大型藻类快速增殖或聚集形成有害藻华(Harmful Algal Blooms,HAB)而引起的生态灾害。海洋中常见的有害藻华现象包括由微藻形成的赤潮(red tide)、“褐潮”(brown tide),以及由大型绿藻形成的“绿潮”(green tide)等。形成有害藻华的藻类能够通过多种途径,如产生毒素、损伤海洋生物鳃组织、改变水体理化环境等危害海洋生物生存,或使生物染毒,从而危及海水养殖、人类健康和生态安全。因此,有害藻华常被作为一类海洋生态灾害问题进行研究和防控。有害藻华现象常见于近岸的河口、海湾等区域,许多有害藻华现象一旦出现,就会演化成常态化的现象,可持续发生数年甚至数十年。以绿潮为例,在法国布列塔尼近岸海域,绿潮已持续发生 30 多年[1];意大利威尼斯潟湖的绿潮也持续暴发将近 20 年才逐渐消失[2]。近年来,随着人类活动和气候变化对海洋环境的影响持续加剧,有害藻华的影响海域不断扩展,对沿海地区养殖业可持续发展、人类健康及海洋生态安全构成了严重威胁,已经成为一类全球性的生态灾害问题。针对有害藻华成因和危害的研究也成为当今海洋科学研究的前沿领域之一。
在我国,有害藻华是最为突出的海洋生态灾害问题之一[3,4],有害藻华的研究和监测工作备受关注。从 20 世纪 70 年代至今,在科技部、国家自然科学基金委、中科院、国家海洋局等单位支持下,围绕我国近海有害藻华的形成机制、危害机理、监测技术和防控对策等方面的研究工作一直在进行。我国近海设有 30 多个赤潮监控区,针对赤潮发生情况进行常规监测。但是,我国近海的有害藻华问题仍然非常严峻,有害藻华的发生频率和影响范围都有上升趋势,造成了巨大的经济损失和社会影响。
1 我国近海藻华灾害现状
1.1 我国近海的赤潮灾害
在我国近海,渤海周边海域、东海长江口邻近海域和南海近岸海域是 3 个典型的赤潮高发区。
在渤海周边海域,辽东湾、莱州湾和渤海湾 3 个海湾的赤潮问题最为严峻,历史上曾多次暴发大规模赤潮[5]。渤海是重要的经济动物产卵场和育幼场,在近岸海域有许多重要的海水养殖区,赤潮对渤海的海水养殖业造成了巨大破坏。1989 年,河北黄骅市发生裸甲藻(Gymnodinium sp.)赤潮,对渤海湾一带的对虾养殖业造成了毁灭性打击,直接经济损失达 2.4 亿元;1998 年渤海的叉状角藻(Ceratium furca)赤潮,严重破坏了辽宁、河北、山东和天津的水产养殖业,造成了约 1.2 亿元的经济损失。2004—2006 年,渤海湾连年暴发大规模棕囊藻(Phaeocystis sp.)赤潮,但未对养殖业造成显著的危害效应。近年来,渤海秦皇岛近岸海域多次记录到抑食金球藻(Aureococcus anophagefferens)形成的褐潮,严重损害了该海域的扇贝养殖业。尤为严峻的是,近年来渤海周边海域多次记录到有毒藻类形成的赤潮,养殖贝类染毒情况也非常常见,对海产品消费者健康构成潜在威胁。1998 年,能够产生腹泻性贝毒毒素(Diarrhetic Shellfish Toxins, DSTs)的鳍藻(Dinophysis spp.)与叉状角藻共同形成赤潮,赤潮之后在贝类中检测到了腹泻性贝毒毒素成分[6];2006 年,在山东长岛海域记录到能够产生麻痹性贝毒毒素(Paralytic Shellfish Toxins, PSTs)的亚历山大藻(Alexandrium spp.)赤潮,导致大量网箱养殖鱼类死亡。
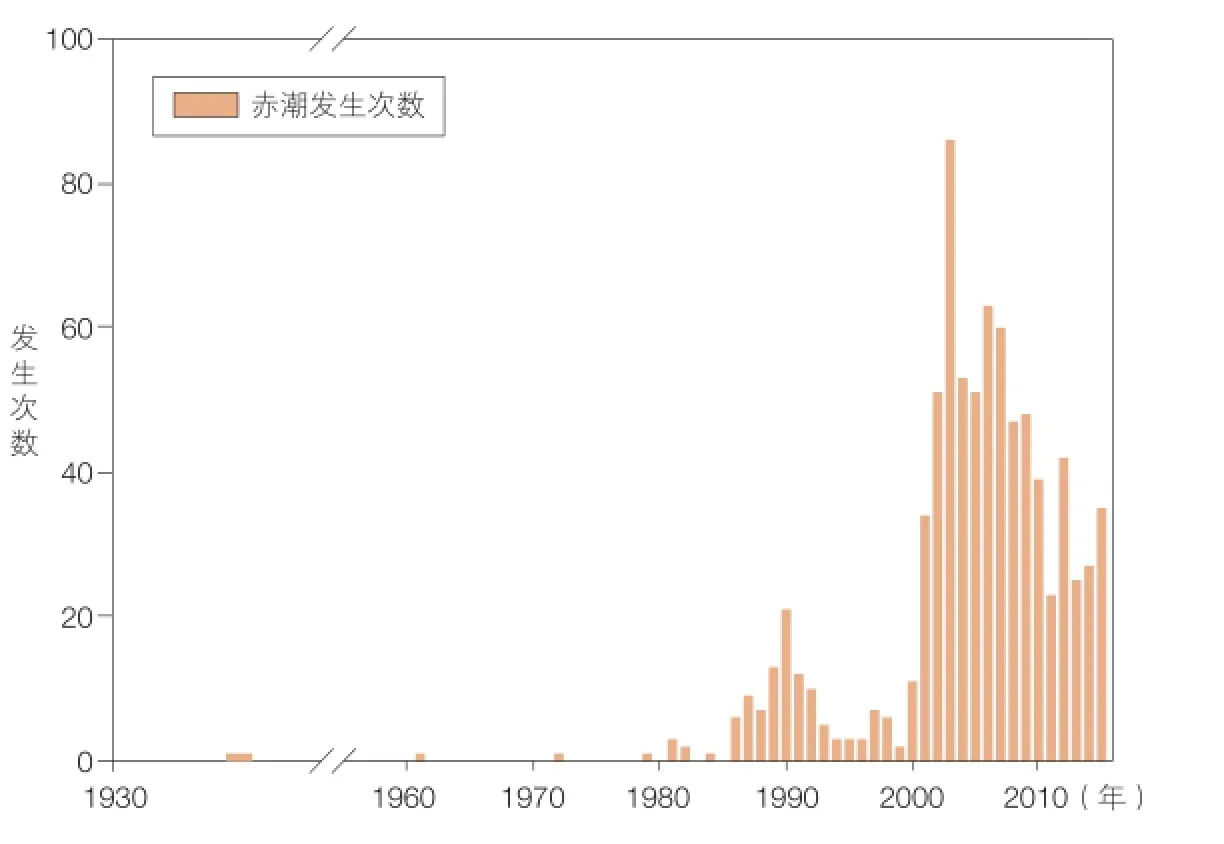
图1 东海海域赤潮发生次数
东海海域是我国近海赤潮发生次数最多的海域。该海域的赤潮主要出现在春、夏季,每年的 5—8 月份是赤潮高发期。自 2000 年以来,东海长江口邻近海域赤潮发生频率急剧上升(图 1),大规模赤潮频繁暴发,影响面积最大可达上万平方公里。特别令人关注的是,该海域的赤潮优势种以东海原甲藻(Prorocentrum donghaiense)、米氏凯伦藻(Karenia mikimotoi)和亚历山大藻(Alexandrium spp.)等有毒有害甲藻为主,对养殖业发展、人类健康和生态安全都造成了严重威胁[7]。2005 年发生在长江口邻近海域的米氏凯伦藻赤潮,导致南麂岛附近大量养殖鱼类死亡,直接经济损失超过 3 000 万元。2012 年福建沿海大规模米氏凯伦藻赤潮造成养殖鲍大量死亡,初步估算经济损失超过 20 亿元,这也是我国历史上有害藻华造成经济损失最为严重的一次。此外,在长江口邻近海域多次观测到高密度的有毒亚历山大藻和有毒鳍藻,其中亚历山大藻细胞密度可达104—105个细胞 /L,达到赤潮水平。对赤潮期间采集的浮游植物和贝类样品进行分析,能够检测到麻痹性贝毒毒素、腹泻性贝毒毒素等多类藻毒素。
南海近岸海域也是我国近海赤潮高发区之一,有记录的赤潮次数仅次于东海海域。南海海域的赤潮多数出现在大鹏湾、大亚湾、深圳湾等海湾及珠江口附近海域。南海海域以往记录的赤潮现象规模不大,但自 20 世纪 90 年代以来,大规模赤潮开始出现,其中尤以棕囊藻形成的赤潮特别令人关注。1997 年11—12月,广东饶平柘林湾发生大规模棕囊藻赤潮,造成大量养殖鱼类死亡,经济损失超过 7 000 万元。1999 年,饶平海域再次发生棕囊藻赤潮,面积超过 3 000 km2。在广西北部湾海域,近年来也连年暴发大规模棕囊藻赤潮。2014 年和 2015 年冬季广西近岸海域的棕囊藻赤潮影响区覆盖了防城港附近海域、钦州湾和北海附近海域。由于赤潮期间棕囊藻可以形成直径达 2—3 cm 的囊状群体,能够堵塞过滤网具,对沿海地区核电设施冷源系统安全构成了潜在威胁。
1.2 黄海海域的绿潮灾害
与渤海、东海和南海相比,黄海海域的赤潮问题并不严重。但是,从 2007 年以来,黄海连年暴发由大型绿藻浒苔(Ulva prolifera)形成的大规模绿潮(图 2),至今已连续 10 年(图 3)。绿潮期间,绿藻覆盖海域面积最大超过 1 000 km2,规模堪称世界之最。绿潮后期大量漂浮绿藻在沿海一线堆积,仅 2008 年一年青岛市政府就从沿海一线清理了超过 100 万吨绿藻。由于堆积的绿藻腐烂后会产生 H2S 和 NH3等有毒气体,污染空气和海水,甚至会导致生物窒息,因此,绿潮对沿海地区旅游景观和海水养殖造成了巨大影响。2008 年黄海绿潮登陆山东半岛后,堆积在养殖池塘里的浒苔腐烂使水质恶化,重创了乳山、海阳、胶南和日照等地的海参养殖、鲍鱼养殖、扇贝筏式养殖、滩涂贝类养殖等产业,造成地方水产养殖业高达 8 亿元人民币的重大经济损失[8]。2009 年,黄海绿潮的暴发也造成了高达 6.4 亿元的经济损失。绿潮不仅威胁沿海地区景观和养殖业,对海域自然环境的影响也极为令人关注。绿藻在生长和死亡分解过程中会吸收或释放营养物质,改变水体生源要素的生物地球化学循环过程,甚至有可能引起浮游植物藻华,造成次生灾害[9]。

图2 黄海海域的浒苔绿潮
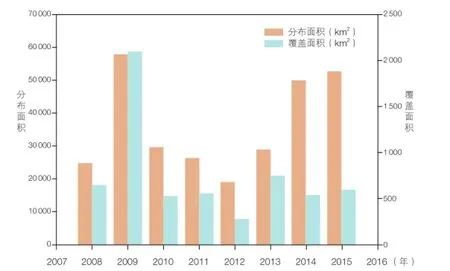
图3 黄海海域绿潮分布面积和覆盖面积变动情况
针对连年暴发的绿潮问题,如何及时、准确地监测和预测绿潮发生情况,积极应对绿潮灾害是迫切需要解决的问题。目前,我国卫星遥感技术已经实现了对绿潮灾害的大范围、同步、快速监测[10](图 4)。在黄海浒苔暴发期间,我国风云 MERSI、环境 HJ/CCD 和北京 1号等卫星数据都已应用于绿藻漂移路径监测[11]。然而,对于绿潮的发生和发展态势,仍缺少可用于预测的数值模式。在绿潮应对方面,主要依靠被动的人工和机械打捞,尽管打捞的绿藻可用于资源化利用[12],但只能部分弥补绿潮导致的经济损失,如何从源头控制绿潮发生仍然是当务之急。

图4 2008年黄海绿潮灾害的遥感监测[10]
1.3 黄、渤海海域的褐潮灾害
褐潮是我国黄、渤海海域近年来新出现的一类有害藻华现象。2009 年夏,在渤海秦皇岛近岸海域出现了一种独特的有害藻华现象,藻华发生期间,养殖的海湾扇贝出现了摄食率降低、生长停滞甚至大量死亡现象,造成了很大的经济损失。自此以后,类似的有害藻华现象连年出现。2010 年,藻华影响海域面积达 3 350 km2,造成 2 亿多元的经济损失。由于藻华原因种(形成有害藻华的藻种)细胞微小、脆弱且不易保存,难以通过形态学特征进行鉴定。因此,该藻华只能被笼统地称作“微微型藻藻华”。通过色素分析发现,藻华发生期间浮游植物中含有 19-丁酰氧基岩藻黄素(But-fuco)、岩藻黄素(Fuco)、硅甲藻黄素(Diad)和叶绿素a[13];分子生物学研究发现,在利用真核生物通用引物构建的克隆文库中,一种海金藻——抑食金球藻占有重要优势。综合色素特征与分子生物学分析结果可以确认,抑食金球藻是藻华的主要原因种[13]。这一由抑食金球藻形成的有害藻华,亦即国际上密切关注的“褐潮”,在我国还是首次记录。除渤海秦皇岛近岸海域之外,2011年北黄海桑沟湾海域也出现了类似的“褐潮”现象。
“褐潮”现象此前仅在美国东海岸和南非有过报道,这是一类典型的生态系统破坏性有害藻华(Ecosystem Disruptive Algal Blooms, EDABs)。在美国东海岸,“褐潮”的出现曾导致贝类资源衰退和海草床退化,引起了学界的密切关注[14]。黄、渤海近岸海域是我国重要的贝类养殖区,也是许多重要海洋经济动物的产卵场和育幼场。由于抑食金球藻的毒性效应,褐潮的出现极有可能进一步破坏近岸水域的生态功能,影响生态系统健康和养殖业的持续发展。秦皇岛岸海域和桑沟湾海域均邻近 M2 分潮无潮点[15],水体相对稳定;贝类养殖区的大量筏架阻滞了海水流动,进一步提高了海水的稳定性,这是褐潮在上述海域出现的重要原因。但是,“褐潮”在黄、渤海沿岸海域突然暴发的原因目前并不清楚。
2 我国近海藻华灾害的演变趋势
2.1 我国近海藻华灾害的演变特征
近年来,我国近海有害藻华呈现出明显的演变趋势,有害藻华发生频率持续上升、影响区域不断扩展。20 世纪 90 年代之前,我国近海有记录的赤潮次数很少,赤潮影响范围也很小,很少超过几百平方公里;2000 年以后,每年记录的赤潮次数都在 50—80 次之间,赤潮面积可达数千甚至上万平方公里,持续时间可以长达一个月以上。除此之外,藻华原因种也出现了明显变化,呈现出“多样化、有害化和小型化”的演变趋势。
我国近海藻华原因种的“多样化”趋势非常明显。在近海海域不仅有微藻形成的赤潮和褐潮,还出现了由大型藻类形成的绿潮。对微藻而言,我国近海常见的藻华原因种涵盖了硅藻类、甲藻类、蓝藻类、隐藻类、定鞭藻类、针胞藻类和海金藻类等许多微藻类群。对长江口邻近海域有害藻华的研究表明,2000 年后该海域的赤潮原因种出现了明显变化,除骨条藻(Skeletonema spp.)等硅藻之外,许多大规模赤潮是由东海原甲藻、米氏凯伦藻和亚历山大藻等甲藻形成[7]。在渤海和南海海域,一些以往没有记录的藻种,如抑食金球藻和棕囊藻等也多次形成有害藻华。
我国近海藻华原因种也呈现出“有害化”的演变趋势。由于甲藻等鞭毛藻类能够产生高活性的毒性物质,对海洋生物甚至人类健康具有毒性效应,因此,随着甲藻等鞭毛藻类形成的赤潮不断增多,对海水养殖业发展的威胁也在不断增加。目前,在我国近海记录的有毒藻种越来越多,在许多海域检测到了麻痹性贝毒毒素、大田软海绵酸(Okadaic Acid, OA)、鳍藻毒素(Dinophysis Toxins, DTXs)、扇贝毒素(Pectenotoxins, PTXs)、虾夷扇贝毒素(Yessotoxins, YTXs)、氮杂螺环酸类毒素(Azaspiracid, AZA)和环亚胺类毒素(Gymnodimine, GYM 和 Spirolide, SPX)等藻毒素,养殖贝类沾染藻毒素的问题屡见不鲜,因食用染毒贝类导致的中毒事件也时有发生。2008 年,江苏连云港报道了一起因食用沾染麻痹性贝毒毒素的蛤蜊引起的中毒事件,有 7 人中毒、 1 人死亡。2011 年 5 月,在浙江宁波和福建宁德地区超过 200 人因食用贻贝中毒,事后在贻贝中检测到了高含量的大田软海绵酸和鳍藻毒素,样品毒性超出腹泻性贝毒食品安全标准 40 多倍[16]。2016 年 4 月底,在秦皇岛地区发生了一起因食用贻贝导致的中毒事件,导致多人中毒,检测结果表明贻贝中麻痹性贝毒毒素含量远超贝类食用安全标准。藻华原因种的“有害化”不仅会威胁人类健康,还会危及海洋生态安全。研究发现,东海原甲藻赤潮期间,浮游动物关键种中华哲水蚤(Calanus sinicus)的产卵率会显著降低,种群密度明显下降[17],这有可能改变海洋中的基础食物链,导致近海生态系统结构和功能的变化。自 21 世纪初以来,随着我国近海大规模甲藻赤潮的增加,我国近海出现了大型水母旺发成灾现象,这也在一定程度上与基础饵料生物种类和组成的变化有关。
近年来,藻华原因种的“小型化”趋势也非常突出。棕囊藻和抑食金球藻等藻华原因种的藻细胞都非常小。尽管棕囊藻在赤潮暴发期间可以形成直径达数厘米的囊状群体,但其细胞大小仅有 5—8 µm;而抑食金球藻细胞大小仅有 2—3 µm。如此细微的藻细胞,给基于形态学手段的有害藻华研究和监测工作造成了很大困扰。
2.2 我国近海藻华灾害演变的驱动因素
对于我国近海有害藻华的演变,人类活动影响导致的近海环境改变应当是主要原因。许多研究表明,有害藻华的出现与营养盐污染引起的海域富营养化之间存在密切关联。在近岸寡营养海域,通常以海草或底栖多年生大型藻类为主;随着海域富营养化程度不断增加,初级生产者逐渐演变为快速生长的附生性大型藻类;在富营养化严重的海域,则会出现绿潮或赤潮等有害藻华现象。随着我国沿海地区人口聚居和社会经济的快速发展,以及大型河流流域化肥施用量的急剧上升,大量营养物质经由不同途径进入海洋,致使我国近海部分海域富营养化程度不断加剧,海水中营养盐浓度持续上升,这在长江口等河口区尤为明显。伴随着营养盐浓度上升,富营养化海域还出现了高氮磷比、高氮硅比等营养盐结构性改变。许多研究表明,在营养盐失衡条件下甲藻往往更具竞争优势,因此,近海营养盐的结构性改变很可能导致甲藻类赤潮增加,从而加剧有害藻华问题。此外,有机态氮、磷营养物质浓度的增加也是一个特别令人关注的问题,在渤海秦皇岛近岸海域,海滨城市化和近岸海域养殖活动使得水体中有机氮浓度显著上升,这也是“褐潮”在此海域暴发的重要诱因之一。
除富营养化之外,人类活动对近海生境的改变也是有害藻华问题不断加剧的一项重要原因。对黄海海域绿潮的研究发现,苏北浅滩养殖区是黄海绿潮早期发展的重要区域[10,17,18]。苏北浅滩是我国重要的紫菜养殖基地,养殖面积达上万公顷,而浒苔是附生在紫菜养殖筏架上的一种污损性绿藻。大量养殖筏架为苏北浅滩区的浒苔提供了重要的附着基,浒苔在冬季附着到紫菜养殖筏架上,随着春季温度上升开始大量增殖,生物量可达数千吨。养殖结束后,大量污损绿藻废弃入海,成为黄海大规模绿潮的源头。
除人类活动对近海环境的改变之外,气候变化也是影响有害藻华发生的重要因素。在全球变暖背景下,我国近海海水增温现象非常突出,有可能改变藻类在我国近海的分布状况。另一特别值得关注的问题是,厄尔尼诺和拉尼娜等局部海域气候事件可能改变局部海域海流强弱、水体层化状况甚至营养盐的输送通量,从而间接影响有害藻华的分布、动态甚至危害效应。但在这一方面,目前的认识仍然非常有限,需要更加深入的研究工作。
3 我国近海藻华灾害的应对策略
对于我国近海快速变化的有害藻华问题,我们的认识仍然比较肤浅,亟需加强对藻华灾害形成及演变机理的研究。为什么我国近海海域会出现如此多样化的有害藻华问题?有害藻华的发生是否指示着我国近海生态环境的退化?各类有害藻华现象之间是否存在竞争、演替关系?我国近海的有害藻华未来又会如何演变?这种演变是否会对海洋生态系统健康和沿海地区社会经济发展造成影响?这些问题需要通过开展系列基础研究,从根本上揭示我国近海藻华原因种的多样性状况、不同藻种的适应策略、环境因子在藻华生消过程的调控作用、藻华灾害对生态系统的危害途径与机制等,才有可能作出科学的回答。
针对多样化的藻华灾害问题,需要提升对有害藻华的监测和预警能力。但是,我国近海藻华原因种的多样化和小型化演变趋势对有害藻华的监测和预警提出了更高的要求。需要充分利用宏观的遥感观测技术,并结合分类学、分析化学和分子生物学等领域的各种技术手段,不断推进原位观测技术在有害藻华研究中的应用,充分发挥数值模拟方法在有害藻华研究和预测中的潜力,提升对有害藻华的监测和预警能力。
针对藻华灾害的危害效应,需要不断提高对藻华灾害的防控能力。近海不断出现的有害藻华现象,对海水养殖业发展、人类健康、旅游景观、生态安全,乃至沿海大型设施的安全运行都构成了一定的威胁,亟需有效的控制技术和应对策略。目前,基于改性粘土方法的应急处置技术在我国近海赤潮、褐潮的控制中得到有效应用,对近海旅游景观、海水养殖和沿海大型设施安全运行起到了积极的作用。但是,从长期来看,仍需要针对我国近海环境的改变,从富营养化控制和生境保护等不同角度,减少有害藻华事件,防范有害藻华的危害效应。
1 Morand P, Merceron M. Macroalgal population and sustainability. J. Coast. Res., 2005, 21(5): 1009-1020.
2 Sfriso A, Marcomini A. Macroalgal harvesting and biomass control, benefits and problems: The lagoon of Venice as study case. In: Dion P and Schramm W (eds) COST Action 49–Use of marine primary biomass. Pleubian, France, 1996: 67-78.
3 苏纪兰. 中国的赤潮研究. 中国科学院院刊, 2001, 16(5): 339-342.
4 周名江, 朱明远, 张经. 中国赤潮的发生趋势和研究进展. 生命科学, 2001, 13(2): 54-59.
5 林凤翱, 卢兴旺, 洛昊, 等. 渤海赤潮的历史、现状及其特点.海洋环境科学, 2008, 27(增2): 1-5.
6 刘宁, 潘国伟, 李春盛, 等. 辽东湾赤潮污染海区贝类软海绵酸的染毒情况调查分析. 中国公共卫生, 1999, 15(3): 209-210.
7 周名江, 朱明远. “我国近海有害赤潮发生的生态学、海洋学机制及预测防治”研究进展. 地球科学进展, 2006, 21(7): 673-679.
8 Ye N, Zhang X, Mao Y, et al. “Green tides” are overwhelming the coastline of our blue planet: taking the world’s largest example. Ecol. Res., 2011, 26: 477-485.
9 Valiela I, McClelland J, Hauxwell J, et al. Macroalgal blooms in shallow estuaries: controls and ecophysiological and ecosystem consequences. Limnol. Oceanogr., 1997, 42: 1105-1118.
10 Liu D Y, Keesing J K, Xing Q, et al. The world’s largest greentide caused by Porphyra aquaculture. Mar. Pollut. Bull., 2009, 58: 888-895.
11 曾韬, 刘建强. “北京一号”小卫星在青岛近海浒苔灾害监测中的应用. 遥感信息, 2009, (3): 34-37.
12 Cai C E, Yao B, Shen W R, et al. Determination and analysis of nutrition compositions in Enteromorpha clathrata. J. Shanghai Ocean Uni., 2009, 18: 155-159.
13 Lomas M W, Gobler C J. Aureococcus anophagefferens research: 20 years and counting. Harmful Algae, 2004, 3(4): 273-277.
14 Yao Z, He R, Bao X, et al. M2 tidal dynamics in Bohai and Yellow Seas: a hybrid data assimilative modeling study. Ocean Dynamics, 2012, 62: 753-769.
15 Li A F, Ma J G, Cao J J, et al. Toxins in mussels (Mytilus galloprovincialis) associated with diarrhetic shellfish poisoning episodes in China. Toxicon, 2012, 60(3): 420-425.
16 Lin J N, Yan T, Zhang Q C, et al. In situ detrimental impacts of Prorocentrum donghaiense blooms on zooplankton in the East China Sea. Mar. Pollut. Bull., 2014, 88(1-2): 302-310.
17 Liu D Y, Keesing J K, He P M, et al. The world’s largest green tides in the Yellow Sea, China: formation and implications. Estuar Coast Shelf Sci., 2013, 129: 2-10.
18 Zhou M J, Liu D Y, Anderson D M, et al. Introduction to the special issue on green tides in the Yellow Sea. Estuar. Coast. Shelf Sci., 2015, 163: 3-8.
于仁成中科院海洋所研究员,博士。1971年出生,山东即墨人,主要从事海洋环境生物学和有害赤潮研究。E-mail: rcyu@qdio.ac.cn
Yu Rencheng Ph.D., was born in 1971 in Shandong Province, Professor of the Institute of Oceanology, Chinese Academy of Sciences. Research interests are marine environmental biology and harmful algal blooms. E-mail: rcyu@qdio.ac.cn
Harmful Algal Blooms in the Coastal Waters of China: Current Situation, Long-term Changes and Prevention Strategies
Yu Rencheng1Liu Dongyan2
(1 Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2 Yantai Institute of Coastal Zone Rearch, Chinese Academy of Sciences, Yantai 264003, China)
Harmful algal bloom (HAB) is an abnormal marine ecological phenomenon, which often associates with disastrous economic or ecological consequences. Typical HAB events include not only “red tides” or “brown tides” formed by microalgae, but also “green tides”formed by some macroalgal species. Once HABs appear in some regions, they would last for a long time and lead to severe impacts on mariculture industry, marine ecosystems, even the health of human-beings. In China, HABs are among the most serious marine ecological problems. Red tides, brown tides, and green tides have been all reported in the coastal waters of China. The Bohai Sea, the Changjiang River estuary and its adjacent waters, and the coastal waters along the South China Sea are identified as three most notable regions for the occurrence of red tides. In the Bohai Sea, large-scale red tides of Gymnodinium sp., Ceratium furca and Phaeocystis sp., as well as the recently identified brown tides of Aureococcus anophagefferens, led to severe impacts on the mariculture industry and huge economic loss. Toxic algal blooms of Dinophysis spp. and Alexandrium spp. were also reported. In the Changjiang River estuary and its adjacent waters, large-scale blooms formed by dinoflagellates Prorocentrum donghaiense, Karenia mikimotoi and Alexandrium spp. started to appear from the beginning of the 21 century and also led to tremendous impacts. A single bloom event of K. mikimotoi along the coast of Fujian Province in 2012 led to economic loss around 2 billion RMB. In the coastal waters of the South China Sea, the intensive blooms of Phaeocystis not only damaged the mariculture industry, but also posed potent threats on the operation of cooling systems of power plant. For the HABs recorded in China, it was also noticed that the bloom-forming species are getting more and more diversified over the last two decades. Besides the microalgal blooms formed by diatoms, dinoflagellates, haptophytes, cyanobacteria, cryptophytes, raphidophytes, and pelagophytes, blooms of macroalgae also occurred widely along the coast of China. More importantly, there are more and more blooms formed by toxic microalgal species, such as Alexandriumspp. and Dinophysis spp. Phycotoxins, such as paralytic shellfish toxins and diarrhetic shellfish toxins, are often detected from phytoplankton and shellfish samples. Besides, the cell size of bloom-forming species are getting smaller. Cell size of some bloom-forming species, such as Phaeocystis spp. and A. anophageffererns, is only about several micrometers, which make it difficult to carry out the routine monitoring based on traditional morphological approaches. The increasing severity of HABs in the coastal waters of China has a close relationship with the intensified eutrophication, especially in the estuaries and bays. Besides, the alteration of natural habitat by mariculture industry and other anthropogenic activities also contributes to the occurrence of some HAB events, such as the green tides in the southern Yellow Sea. Other factors like climate change also influence the distribution, dynamics, and impacts of HABs in the coastal waters of China directly or indirectly, through the effects on water temperature, stratification, and currents. However, such effects are still poorly understood compared to those of land-based anthropogenic activities. Base on the analysis of current situation and long-term changes of HABs in China, it is proposed to further strengthen the basic researches on HABs to answer some important questions, such as the diversity of bloom-forming species, the relationship between HABs and health of marine ecosystems, the trend of long-term changes of HABs and the major driving forces, and the economic and ecological consequences of HABs in the future. Meanwhile, observation system on HABs should be enhanced to improve the capabilities on prediction and early-warning of HABs, using both remote sensing and in situ real-time observation instruments based on molecular biological and morphological approaches. The techniques of modified clay have been successfully applied to control some HAB events in China, however, measures on controlling eutrophication and land-based pollution are still needed to prevent the HABs in the long run.
harmful algal bloom, red tide, green tide, brown tide
*资助项目:中科院战略性先导科技专项(XDA110203 04),基金委山东省联合项目(U1406403),青岛海洋科学与技术国家实验室鳌山科技创新计划项目(2016A SKJ02),国家重点基础研究发展计划“973”项目(2 010CB428700)
修改稿收到日期:2016年10月13日
