酒石酸美托洛尔双层漂浮型脉冲释药片制备及其体外释药行为研究
2016-03-27张丹霞
张丹霞
(广东省深圳市宝安区人民医院,广东 深圳 518101)
酒石酸美托洛尔双层漂浮型脉冲释药片制备及其体外释药行为研究
张丹霞
(广东省深圳市宝安区人民医院,广东 深圳 518101)
目的 制备用于时辰治疗心绞痛的酒石酸美托洛尔漂浮型脉冲释药片,并探讨其体外释药机制。方法 采用混合粉末直接压片法制备双层片,以崩解时间和溶出度为指标,筛选酒石酸美托洛尔速释片芯的崩解剂,优选最佳漂浮层处方。以体外释药试验考察对时滞的影响。结果 优选的处方和工艺条件:交联聚维酮作为片芯崩解剂,用量为8%;包衣层处方中羟丙甲基纤维素作为凝胶材料,乳糖作为致孔剂,用量比为4∶1,漂浮层以聚羧乙烯30%,羟丙甲基纤维素36.3%,碳酸氢钠33.7%组合最优。体外释放试验表明,酒石酸美托洛尔双层漂浮型脉冲释药片经6 h滞后期药物脉冲释放。结论 酒石酸美托洛尔双层漂浮型脉冲释药片可达到瞬时起漂并持续到预定时滞期后脉冲释药,能满足时辰治疗学、治疗心绞痛的需求。
酒石酸美托洛尔;双层漂浮;脉冲释药;时滞
漂浮型脉冲释药系统(floating pulsatile drug delivery system,FPDDS)是集漂浮脉冲与脉冲于一体[1],旨在延长制剂的胃滞留,使其在一定时滞期后于胃或小肠远端完全释放的释药系统,特别适用于心血脑管病等具有昼夜节律性疾病的时辰药理学的临床用药要求[2-4]。美托洛尔(metoprolol)是目前临床最常使用的β肾上腺素受体阻滞剂(β blockers)[5],具有独特的维持Cx43去磷酸化状态而发挥抗心肌细胞凋亡作用[6-7],临床常用于原发性高血压、心绞痛治疗。本研究中把美托洛尔当作模型药物,采用压制包衣法制备美托洛尔双层漂浮型脉冲释药系统[8],通过体外溶出试验优选处方,并探讨其释药机制。
1 仪器与试药
1.1 仪器
DU640型紫外分光光度计(北京普析通用仪器有限公司);TDP型单冲式压片机(北京国药龙立科技有限公司);ZRS-8G型智能溶出试验仪(天津天大天发科技有限公司);SE3001 F型电子天平(奥豪斯仪器<上海>有限公司);标准筛(浙江省上虞市纱筛厂)等。
1.2 试药
酒石酸美托洛尔(湖北远成药业有限公司,批号20131205,纯度99.2%);羟丙甲基纤维素(HPMC,型号K4M)、交联聚维酮(PVPP)等均为上海卡乐康包衣技术有限公司产品;交联羟甲基纤维素钠(CCNa,武汉金诺化工有限公司);乳糖(德国美剂乐公司);聚羧乙烯(Carbopol,美国诺参化工有限公司);其他试剂均为分析纯。
2 方法与结果
2.1 美托洛尔双层漂浮型脉冲释药法的制备[8]
2.1.1 处方
含药速释片芯:25 mg美托洛尔与崩解剂、微粉、硅胶、微晶纤维素,适量混合均匀,采用6 mm冲模粉末连接压片(每片0.1 g,硬度40 N)。包衣层:将HPMC K4M辅料与乳糖充分混合,备用,用量为0.1 g(1片)。漂浮层将Carbopol HPMC与NaHCO3按一定比例混合均匀备用,每片0.1 g。
2.1.2 工艺[9]
将制备用原辅料分别粉碎过筛,按2.1.1项下处方配料,将漂浮层物料混匀填充于10 mm冲模中轻压使平整,将拌匀包衣层物料取一半置冲模中,再把已压好的速释片芯置物料中央,再将剩余的半量包衣层的物料加入冲模中,铺平,调整压力压片(每片 0.3 g,硬度40~50 N)。
2.2 样品体外释放度测定
2.2.1 含量测定方法[9]
采用紫外光光度法测定美托洛尔含量。
辅料干扰试验:称取处方量的各辅料置100 mL容量瓶中,加一定量的水超声溶解定容。同法称取处方量美托洛尔25 mg与辅料稀释同样倍数,用0.45 μm的微孔滤膜滤过,取续滤液于200~400 nm波长范围进行紫外扫描。结果美托洛尔在224.274 nm波长处均有最大吸收。由于辅料在224 nm波长处有干扰,在274 nm波长处无干扰,故将274 nm定为美托洛尔的检测波长。
标准曲线绘制:称取干燥恒重的美托洛尔50 mg,精密称定,置50 mL容量瓶中,加适量水超声溶解,稀释至刻度,摇匀,精密吸取0.1,0.5,2.0,5.0,8.5,10.0 mL分别置50 mL容量瓶中,用水定容,摇匀,作为标准溶液测定。以水为空白,在274 nm波长处测定吸光度(A),以 A对质量浓度(C)进行线性回归,得标准曲线方程A=3.836 C+0.032,r=0.999 3(n=6)。结果表明,美托洛尔检测质量浓度在2.0~200 μg/mL范围内与吸光度线性关系良好。
2.2.2 体外释放度测定[10-11]
按2010年版《中国药典(二部)》附录ⅩC释放度测定法节三法[9]操作,释放介质为 0.1 mol/L的 HCl 900 mL,温度为(37±0.5)℃,转速为100 r/min,于规定时间取样5 mL,0.45 μm微孔滤膜滤过,同时补充同温等体积的新鲜介质,采用紫外线分光光度法测定光密度(A),按照上述标准曲线计算药物的累积释放百分率。
2.3 多层处方用料的组合筛选
2.3.1 处方因素对制剂体外释药的影响
含药速释片芯用崩解剂的选择:分别以 PVPP,CCNa,低取代羟丙纤维素(L-HPC)和羟甲基淀粉钠(CMS-Na)作为崩解剂,每片用量均为8%,制备片芯,按2.2.2项下操作测定片芯的溶出度,见图1 A。
包衣层处方用料因素考察:处方因素和水平主要乳糖致孔剂占衣膜比例(10%,20%,30%,40%)和衣膜的用量(80,100,120,140 mg),其体外释药情况见图1 B至图1 D。
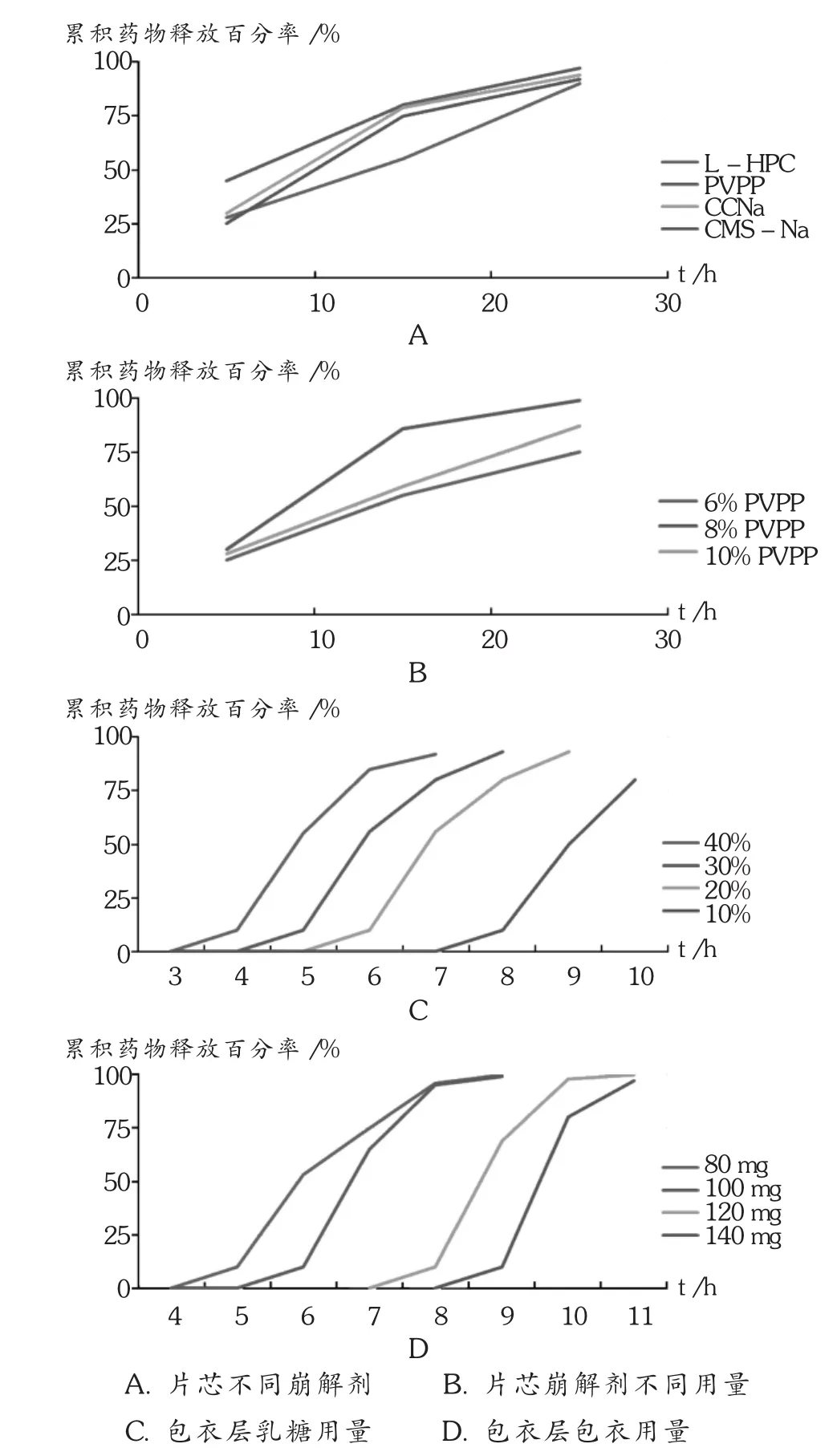
图1 处方因素对制剂体外释药的影响(n=3)
结果:片芯采用PVPP为崩解剂,以8%PVPP用量时其崩解时限最短,溶出速率最快,色衣层的衣膜用量100 mg乳糖占20%时,其释药时滞能达到(或等于)6 h,最为适中。
2.3.2 漂浮层处方筛选与漂浮性能考察
选用Carbopol,HPMC K4M,NaHCO3为原材料,分别设计试验优选。以起漂浮时间和漂浮时滞为考察指标,反复设计试验考察,并经数学理论拟合[8,12],结果Carbopol 30 mg,HPMC K4M 36.3 mg,NaHCO333.7 mg,共100 mg(0.1 g)的处方最优。将其投入0.1 mol/L HCl介质中,起漂浮时间不超过1 min,持续漂浮时间不少于12 h,该处方最适中,片剂硬度为40~50 N。
2.3.3 处方工艺的重复性试验
美托洛尔双层漂浮型脉冲释药片的最佳处方工艺条件:以PVPP为速释片芯崩解剂,每片用量的8%为宜;包衣处方中HPMC K4M与乳糖用量比为4∶1,即80 mg∶20 mg,以每片 100 mg为宜;漂浮层最佳处方Carbopol 30%,HPMC K4M 36.3%,NaHCO333.7%,以每片100 mg为宜;工艺上采用粉末直接压制包衣片剂硬度40~50 N。照此处方工艺重复了批复验,每片为0.3 g。体外释放度考察结果,起漂浮时间均为1 min左右,美托洛尔大量释药均在6 h后开始,但在2 h内释放达90%,详见图2。可见,3批试制样品起漂浮时间、时滞期和时滞后的释药情况均无明显差异(P>0.05),表明处方工艺重复性良好。
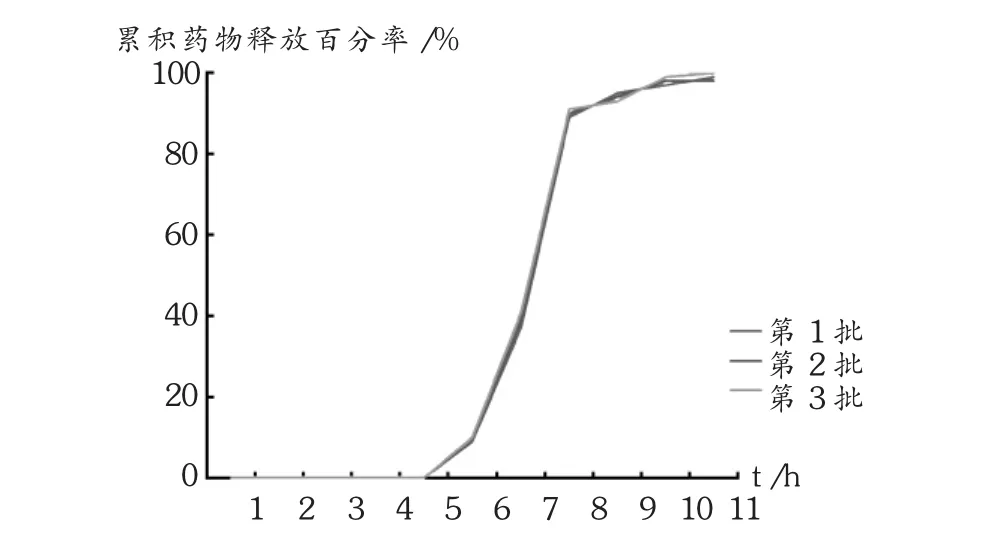
图2 美托洛尔双层漂浮型脉冲释药片的体外释药曲线
3 讨论
漂浮型脉冲片能在疾病症状出现前使血液中的药物浓度达到最大,即在病发前提供最大的释药,且能在方便时服用。普通释药片在胃肠道转运及消化液的影响下,存在释药时滞变异大等问题。理想的制剂应在初期(即时滞期)为少量或无释药阶段,时滞后药物脉冲释放为第二阶段,要保证稳定重现的时滞和时滞后脉冲释放是此类给药系统制备的关键及难点。
本研究中以美托洛尔为模型药制备双层漂浮型脉冲释药片,考察结果显示,其起漂浮时间为1 min左右,美托洛尔大量释药在时滞6 h后,且在2 h内脉冲释放达90%,能满足变异型心绞痛患者易于后半夜、清晨发作的时辰用药要求[13-14]。因为2 h内脉冲释药90%已达美托洛尔靶剂量的用药要求[15]。患者只需在睡前用药,便可预防半夜或清晨发病。
本研究中制剂由速释溶片、外包衣层、漂浮层3部分组成,均通过体外释放度、崩解时限的测定筛选。因为PVPP有很强的膨胀性和高的毛细管效应,故选择其作为速释片芯的崩解剂,因其能迅速将水分吸入到药片中,使药片膨胀压力增加,当张力超过药片的强度时,瞬时崩解,迅速释药。胃滞“脉冲释药”外包衣层以HPMC K4M为主,配合致孔剂乳糖来调节衣膜层的溶蚀速度率及其释药速率,采用干粉末直接压制包衣[11],硬度为40~50 N。该衣膜与人工胃液接触后水化形成凝胶层,控制药物的释放;漂浮层中的NaHCO3与胃液(酸液)接触后,反应生成的CO2滞留在凝胶中;双层片的漂浮层迅速膨胀,漂浮到(胃的)液面上方。由于漂浮层的溶蚀是逐步进行的,这就保证了一定的漂浮时滞。而HPMC K4M吸水溶胀后具有生物黏附性,使片剂黏附在胃黏膜上,这就延长了制剂在胃中的滞留(实测为6 h)。这段时间内片芯吸水膨胀到一定程度会胀破衣膜凝胶层,崩解释药就达到了预定时滞期(即6 h后)脉冲释药,从而达到时辰治疗的目的[14]。
[1]Patel JK,Dalvadi HP,Shah DP.Time and/or site specific drug deli-very of floating pulsatile release delivery system[J].Sys Rev Pharm,2011,2(1):59-65.
[2]Massin MM,Maeyns K,Withofs N,et al.Circadian rhythm of heart rate and heart rate variablity[J].Arch Dis Child,2000,83(2): 179-182.
[3]张 玫.不同服药时间对心绞痛患者预后的影响[J].华北煤炭医学院学报,2009,11(4):511-512.
[4]马安翠,杨建琴.时辰药理学与临床用药[J].大理学院学报,2008,7(6):3-5.
[5]梁 庆,黄敏坚,邝素华,等.美托洛尔对心力衰竭大鼠血流动学及 Bcl-2、Bax蛋白表达的影响[J].广东医学,2015,36(12):1 829-1 833.
[6]梁 庆,李自成,邝素华,等.美托洛尔抑制NE诱导的大鼠心肌细胞凋亡及缝隙连接蛋白43的磷酸化[J].中国病理生理杂志,2013,29(11):2 024-2 029.
[7]梁 庆,李自成,邝素华,等.美托洛尔对心力衰竭大鼠心肌细胞磷酸化缝隙链接蛋白43表达及心肌细胞凋亡的影响[J].中国病理生理杂志,2013,29(8):1 352-1 357.
[8]冉茂莲,李小芳,余 琳,等.罗布麻双层漂浮型脉冲释药片的制备[J].中成药,2015,37(4):752-757.
[9]申 磊,白 靖,曹德英,等.酒石酸美托洛尔双脉冲片的研制[J].中国药房,2012,23(9):825-828.
[10]Efentakis M,Koligliati S,Vlachou M.Design and evaluation of a dry coated drug delivery system with an impermeable cup,swellable top layer and pulsatile release[J].Int J Pharm,2006,311(1-2):147-156.
[11]Zou H,Jiang XT,Kong LS,et al.Design and evaluation of a dry coated drug delivery system with floating-pulsatile release[J].J Pharm Sci,2008,97(1):263-273.
[12]吴 伟,崔光华,陆 彬.实验设计中多指标的优化:星点设计和总评“归一值”的应用[J].中国药学杂志,2000,35(8):530-533.
[13]何绍雄,宋开源,苏兆虞.时间药理学与时间治疗学[M].天津:天津科学技术出版社,1998:261-267.
[14]Jessy S,Vishal P.Novel floating pulsatile approach for chronotherapeutic release of indomethacin[J].Dhaka Univ J Pharm Sci,2007,6(1):37-41.
[15]Fukui M,Goda A,Komamura K,et al.Changes in collagen metabolism account for ventricular functional recovery following beta-blocker therapy in patients with chronic heart failure[J].Heart Vessls,2016,31(2):173-182.
Preparation of M etoprolol Tartaric Acid Bilayer Floating Tablets for Pulsatile Release and Study on Its in Vitro Release M echanism
Zhang Danxia
(Bao′an District People′s Hospital,Shenzhen,Guangdong,China 518101)
Objective To prepare metoprolol tartaric Acid Bilayer Floating Tablets for the treatment of angina pectoris and to investigate the in vitro release mechanism.M ethods The direct compression of mixed powder method was used to prepare the bilayer tablets,the disintegration time and dissolution rate were used as the indicators to screen out the core disintegrating agent of metoprolol taetaric release tablets,and to obtain the preferred formulation.The in vitro release test was used to study the influence on delay.Results The preferred formulation and process conditions:crosslinked povidone as the tablet core disintegrating agent in an amount of 8%;hydroxypropyl methylcellulose as the gel material in the coating layer formulation,lactose as porogen,amount ratio 4∶1;the optimal combination of floating layer was carbopol of 30%,hydroxypropyl methylcellulose 36.3%,sodium bicarbonate 33.7%.In vitro release tests showed that Metoprolol Tartaric Acid Bilayer Floating Tablets released the drug by 6 h of delay.Conclusion The metoprolol tartaric Acid Bilayer Floating Tablets achieves instantaneous drift and continues to play after a predetermined time demurrage pulse release to meet the demand of hour therapy and angina treatment.
metoprolol tartrate;bilayer floating;pulsatile release;delay
TQ460.6;R972+.3
A
1006-4931(2016)09-0053-03
2016-01-10)
