内毒素对人外周血单个核细胞向血管内皮细胞分化的影响
2016-03-26傅庆荣陈莉卢建文黄水庆邓来明肖正华广州医科大学附属广州市第一人民医院广东广州510180
傅庆荣,陈莉,卢建文,黄水庆,邓来明,肖正华(广州医科大学附属广州市第一人民医院,广东广州510180)
内毒素对人外周血单个核细胞向血管内皮细胞分化的影响
傅庆荣,陈莉,卢建文,黄水庆,邓来明,肖正华
(广州医科大学附属广州市第一人民医院,广东广州510180)
摘要:目的观察不同浓度脂多糖(LPS)对外周血单个核细胞(PBMCs)体外向血管内皮细胞分化的影响。方法取健康成人PBMCs,以血管内皮生长因子(VEGF)和碱性成纤维细胞生长因子(bFGF)进行诱导,加入不同浓度的LPS干预处理,倒置相差显微镜下观察PBMCs的形态改变,流式细胞术检测细胞表达CD31和血管假性血友病相关因子(vWF)。结果体外培养的PBMCs呈贴壁生长,诱导培养后,经历小圆形→梭形→扁平细胞的演变过程。与对照组比较,0.01μg/ml LPS组最后形成的梭形细胞数增加,随着LPS浓度进一步增加,细胞数呈递减趋势。流式细胞术检测结果显示,与对照组比较,0.01μg/ml LPS组,CD31/vWF双阳性细胞数明显增加,差异有统计学意义(P<0.05);0.10μg/ml LPS组CD31/vWF双阳性细胞数无明显改变(P>0.05);随着LPS浓度进一步增加,CD31/vWF双阳性细胞数呈减少趋势,差异有统计学意义(P<0.05)。结论0.01μg/ml LPS能最大限度地促进PBMCs向内皮细胞分化,随着LPS浓度增加,PBMCs分化呈抑制作用,这可能与LPS激活核转录因子-κB(NF-κB)的数量及亚单位不同有关。
关键词:内毒素;外周血单个核细胞;血管内皮细胞;细胞分化
目前,对干细胞移植治疗缺血性疾病的研究已日趋广泛。一定条件下的干细胞可分化为血管内皮细胞和平滑肌细胞,同时能够分泌大量的促血管生成因子。通过干细胞移植,可促进缺血肢体的新生血管形成,最终达到治疗缺血的目的。外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)与骨髓、脐血来源的成体干细胞比较,具有采集无痛苦、容易获取、患者易接受等优点,成为细胞移植治疗的研究热点。本研究通过脂多糖(lipopolysaccharide,LPS)干扰外周血单个核细胞向血管内皮细胞的分化,探讨LPS对该过程的影响及其可能的机制。
1 材料与方法
1.1材料
无菌条件下取健康成人外周血20 ml,Ficoll淋巴细胞分离液(美国康宁公司),达尔伯克必需基本培养基(dulbecco's minimum essential medium,DMEM)/F12培养基(美国Gibco公司),胎牛血清(美国Gibco公司),血管内皮生长因子(vascular endothelial growth factor,VEGF)(美国Pepro Tech公司),碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)(美国Pepro Tech公司),藻红蛋白(Phycoerythrin,PE)标记的CD31(美国BD公司),异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的血管假性血友病相关因子(von Willeband factor,vWF)(美国Abcam公司),脂多糖(美国Sigma公司)。
1.2方法
1.2.1PBMCs的提取无菌条件下取健康成人外周血20 ml,肝素抗凝后,磷酸盐缓冲溶液(phosphate buffer saline,PBS)液双倍稀释,将稀释后的细胞加入等体积Ficoll淋巴细胞分离液表层,室温下水平2 000 r/min离心25 min,吸取中间浑浊的云雾状的灰白色层,即为外周血单个核细胞层。DMEM/F12培养液洗涤2次,室温下分别2 000和1 500 r/min离心10 min,弃上清液,获取外周血单个核细胞。
1.2.2PBMCs诱导分化将离心后的细胞加入至含有10μg/L VEGF、10μg/L bFGF以及体积分数为20%胎牛血清的DMEM/F12培养基,吹打计数后移至培养瓶中,置于37℃、5%饱和湿度的二氧化碳CO2培养箱中,第3天更换细胞培养液,去除未贴壁的细胞,倒置相差显微镜下观察细胞的生长。
1.2.3PBMCs分组诱导分化72 h后,各实验组中分别加入不同浓度(0.01、0.10、1.00和10.00μg/ml)的LPS,对照组不加LPS,分别做好标记,继续培养。
1.2.4诱导后的细胞鉴定①细胞形态学观察。在倒置相差显微镜下对各组细胞进行形态学观察,并对比诱导添加生长因子前后以及加入LPS干预后细胞形态及生长的变化,观察是否有铺路石样改变。②细胞表型检测。诱导分化20 d后,取贴壁细胞,予以0.25%胰蛋白酶消化制成单细胞悬液,各管中加入PE标记的CD31抗体,4℃避光孵育15 min;FITC标记的vWF抗体同样条件下孵育30 min;CD31、vWF双标记为先加入PE标记的CD31,避光孵育15 min后加入FITC标记的vWF避光孵育30 min,流式细胞术检测。所有实验重复3次。
1.3统计学方法
采用SPSS 13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1细胞形态学变化
倒置相差显微镜下,新分离的PBMCs细胞呈小圆形,培养24 h后部分细胞开始贴壁,细胞胞体开始变大,透亮度也增加。随着培养时间推移,细胞可见伪足样突起伸出,细胞拉长呈梭形的内皮样细胞并保持贴壁生长,开始出现细胞集落。诱导分化20 d后,贴壁细胞开始出现融合(见图1A~D)。在培养过程中,部分细胞一直保持小圆形,且不贴壁生长,换液后弃除。
2.2诱导分化后细胞表面标志鉴定CD31、vWF阳性细胞和CD31/vWF双阳性细胞
流式细胞术检测结果(右上象限)显示,对照组、0.01、0.10、1.00和10.00μg/ml LPS组表达CD31/vWF双阳性细胞数所占百分比分别为58.30%、69.10%、55.33%、29.80%和16.80%(见图2)。不同浓度LPS 对BPMCs向内皮细胞分化的作用比较见附表。与对照组比较,0.01μg/ml LPS组CD31/vWF双阳性细胞数明显增加,差异有统计学意义(P =0.025),而0.10μg/ml LPS组CD31/vWF双阳性细胞数无明显变化,差异无统计学意义(P =0.277),1.00和10.00μg/ml LPS组CD31/vWF双阳性细胞数明显减少,差异有统计学意义(P =0.011和0.000)(见图3)。

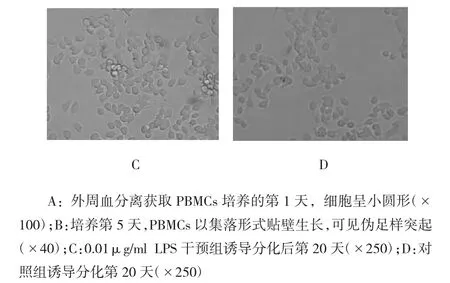
图1 细胞形态变化
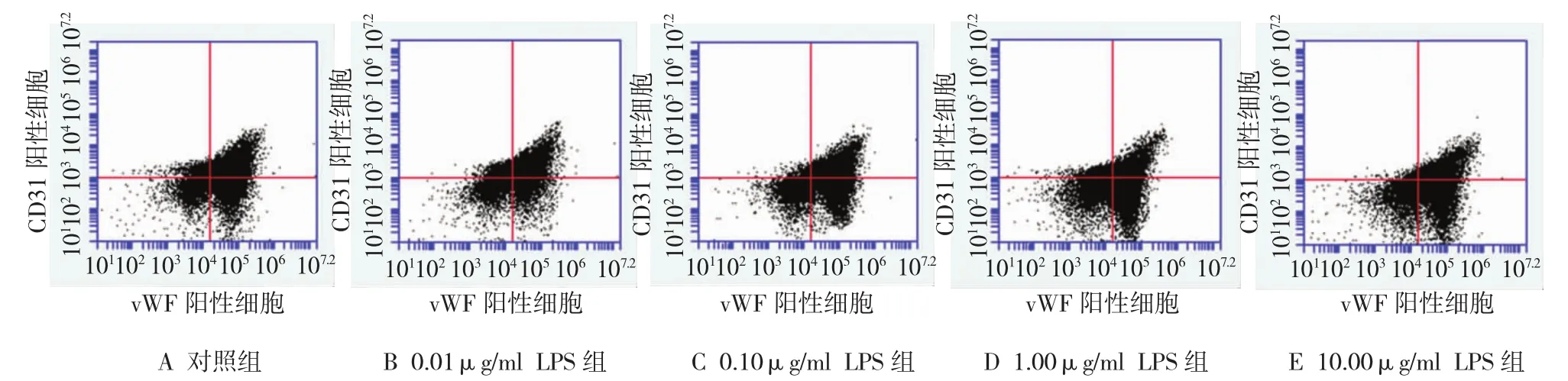
图2 流式细胞术检测CD31/vWF双阳性细胞
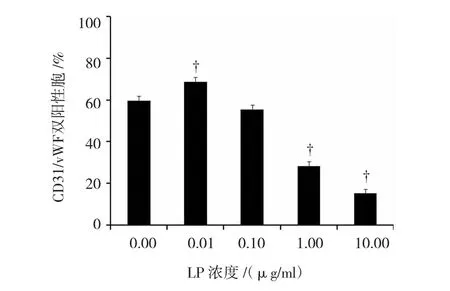
图3 流式细胞术检测CD31/vWF双阳性细胞百分数分布图
附表 不同浓度LPS对BPMCs向内皮细胞分化的作用比较(%,±s)

附表 不同浓度LPS对BPMCs向内皮细胞分化的作用比较(%,±s)
组别 CD31/vWF双阳性细胞数 P值对照组 59.68±2.3 0.01μg/ml LPS组 68.77±1.4 0.025 0.10μg/ml LPS组 55.33±2.4 0.277 1.00μg/ml LPS组 28.17±1.2 0.011 10.0μg/ml LPS组 15.25±3.4 0.000
3 讨论
外周血单个核细胞是指外周血中细胞核为单个的一群混合性,其内存在能分化为血管内皮细胞的前体细胞——内皮祖细胞(endothelial progenitor cells,EPCs)。PBMCs治疗缺血性疾病的机制主要包括2方面:①EPCs能够参加缺血组织的血管形成;②PBMCs能够产生多种细胞因子和生长因子诱导血管的发生。本实验的外周血来自于健康成人,通过密度梯度离心法分离提取PBMCs,再添加细胞因子VEGF和bFGF在DMEM/F12培养基内诱导分化。从未添加LPS干预的对照组中,笔者观察到新分离的PBMCs呈小圆形,24 h后可见细胞呈贴壁生长,继而细胞体积变大,可见伪足样突起,细胞呈现梭形并形成细胞集落,最后细胞呈铺路石样生长,部分细胞融合,与国内外文献报道的内皮细胞演化过程相同。流式细胞术检测结果显示,诱导分化后细胞表达CD31/vWF双阳性细胞数受LPS的影响,差异有统计学意义。CD31即血小板内皮细胞黏附分子-1,主要在血管内皮细胞中表达,同时在血小板、巨核细胞、浆细胞、中性粒细胞中弱表达,存在于早期内皮细胞的边缘,体现内皮细胞间接触并诱导胞内信号的传递,是目前公认的特异性内皮细胞标志物[1-2]。vWF即为血管假性血友病相关因子,主要在内皮细胞内合成并释放一种多聚体糖蛋白,可储存在内皮细胞的Weibel-palade小体中,仅在内皮细胞和少量血小板中表达,vWF是凝血因子Ⅷ的载体蛋白,与凝血因子Ⅷ结合后,以复合体的形式存在于外周循环血液中,在血小板黏附于内皮下组织的过程中发挥重要的作用,被认为是鉴定内皮细胞的特异性标志物[3]。本实验对诱导分化后的PBMCs从细胞形态学和细胞表面特异性标志两方面进行鉴定,证实最后所分化的细胞为内皮细胞。
研究显示,大部分缺血性疾病如糖尿病患者体内的EPCs数量较正常人明显减少[4-5],其黏附能力、细胞形成集落以及增殖能力降低[6]。临床发现,患者的血糖和胰岛素水平、氧化应激、感染等微环境因素会干扰细胞的生长,使PBMCs移植治疗糖尿病足的临床疗效受影响。虽然鲜有文献报道感染与干细胞移植的相关性,但笔者从临床部分病例发现,糖尿病足合并感染尤其是革兰阴性菌感染时,干细胞移植的临床疗效无法令人满意。目前,关于内毒素对PBMCs分化、增殖及凋亡等生物特性的影响及其机制还不十分清楚。
内毒素是革兰阴性菌细胞壁外膜的重要组成成分,化学成分为脂多糖,包括脂质A、核心多糖和O抗原3个组成部分。在细菌生长繁殖的各个阶段及菌体自溶或被裂解时,LPS会从细菌外膜上脱落下来并释放到周围介质中,导致机体代谢、激素水平和神经内分泌的改变,最终可引起发热、微循环障碍、内毒素休克及播散性血管内凝血等一系列病理反应[7]。研究显示,LPS主要通过细胞表面Toll样受体4(toll-like receptors 4,TLR4)结合,激活TLR4介导的信号传导通路,再通过MyD88依赖性通路最终激活核转录因子-κB(nuclear transcription factor-κB,NF-κB),最后通过NF-κB表现出不同的生物学活性。有研究报道,LPS可通过TLR4激活癌细胞内Wnt信号通路,促进细胞增殖及肿瘤的发生[8]。但也有研究发现,LPS可通过分泌具有细胞毒作用的肿瘤坏死因子(tumor necrosis factor,TNF)、白介素-1(Interleukin-1,IL-1)等抑制肿瘤细胞的生长,并诱导一氧化氮NO产生,后者能促进肿瘤细胞发生凋亡。还有研究报道,适量LPS可与间充质干细胞(mesenchymal stem cells,MSCs)表面TLR4结合,进而促进MSCs增殖并提高MSCs移植效率以及抑制氧化应激引起的MSCs凋亡[9-10]。
NF-κB属于Rel家族的转录因子,激活的NF-κB可参与许多基因的转录与调控,在感染、炎症反应、细胞免疫、氧化应激、细胞增殖及凋亡的病理生理过程中发挥重要的作用。具体机制为NF-κB活化后,通过调控多种细胞因子的转录,产生和释放TNF-α、IL-1、IL-6等炎症因子,该炎症因子除可直接作用于细胞,引起细胞凋亡与坏死外,还能激活其他细胞因子,从而激活整个细胞因子网络结构,引发全身炎症反应综合征;活化后的NF-κB也能参与多种凋亡相关基因的转录调控,具有抑制细胞凋亡和促进细胞凋亡的双重作用[11];此外研究还发现,NF-κB能够引起VEGF、类胰岛素一号增长因子、bFGF、TNF-α、IL-1α、IL-6、IL-8等血管形成因子的表达增加[12-14],进而参与细胞的增殖与分化过程。本研究中,在低浓度LPS(0.01μg/ml)作用下可有效地促进BPMCs分化为VECs,随着LPS浓度进一步增加,对PBMCs的分化呈现抑制作用。笔者推断,该双相效应的原因可能为不同浓度LPS(0.01μg/ml)微环境下激活NF-κB的亚单位和数量不同,但其具体机制有待进一步研究。
综上所述,高浓度LPS是影响PBMCs分化的因素之一,与临床革兰阴性菌感染的糖尿病足患者干细胞移植疗效欠佳结果一致。本研究发现,LPS对PBMCs向内皮细胞分化的作用呈一定的剂量依赖性,低浓度时可表现出促进作用。因此,控制微环境中LPS浓度可提高PBMCs的移植效率,为PBMCs移植时机的掌握提供实验依据。另外,本研究提示,通过体外低浓度LPS预处理干细胞,可作为提高干细胞移植效率的一种新手段。
参考文献:
[1] Kim H, Cho HJ, Kim SW, et al.CD31+cells represent highly angiogenic and vasculogenic cells in bone marrow: novel role of non-endothelial CD31+cells in neovascularization and their therapeutic effects on ischemic vascular disease[J].Circ Res, 2010, 107(5): 602-614.
[2] Wu H, Riha G, Yang H, et al.Differentiation and proliferation of endothelial progenitor cells fromcanine peripheral blood mononuclear cells[J].Journal of Surgical Research, 2005, 126(2): 193-198.
[3] Turner NA, Nolasco L, Ruggeri ZM, et al.Endothelial cell ADAMTS-13 and VWF: production, release, and VWF string cleavage[J].Blood, 2009, 114(24): 5102-5111.
[4] Zhao CT, Wang M, Siu CW, et al.Myocardial dysfunction in patients with type 2 diabetes mellitus: role of endothelial progenitor cells and oxidative stress[J].Cardiovasc Diabetol, 2012, 11: 147.
[5] Hernandez SL, Gong JH, Chen LM, et al.Characterization of circulating and endothelial progenitor cells in patients with extreme-duration type 1 diabetes[J].Diabetes Care, 2014, 37(8): 2193-2201.
[6] Chen LL, Liao YF, Zeng TS, et al.Number and function of circulating endothelial progenitor cell in diabetics with different vascular complications[J].National Medical Journal of China, 2009,89(18): 1234-1239.
[7]付晓霞.内毒素血症过程中组蛋白的甲基化修饰及其对炎症介质的转录调控[D].广州:南方医科大学, 2013.
[8] Santaolalla R, Sussman DA, Ruiz JR, et al.TLR4 activates the β-catenin pathway to cause intestinal neoplasia[J].PLoS One, 2013, 8(5): DOI: 10.1371/journal.pone.0063298.
[9]姚永伟.脂多糖预处理对骨髓间充质干细胞移植效率的影响及机制探讨[D].南京:南京医科大学, 2010.
[10] Wang ZJ, Zhang FM, Wang LS, et al.Lipopolysaccharides can protect mesenchymal stem cells from oxidative stree-induced apoptosis and enhance proliferate of MSCs via toll-like receptor (TLR)-4 and PI3K/Akt[J].Cell Biol Int, 2009, 33: 665-674.
[11] Dutta J, Fan Y, Gupta N, et al.Current insights into the regulation of programmed cell death by NF-κB[J].Oncogene, 2006, 25: 6800-6816.
[12] Shibata A, Nagaya T, Imai T, et al.Inhibition of NF-κB activity decreases the VEGF mRNA expression in MDA-MB-231 breast cancer cells[J].Breast Cancer Res Treat, 2002, 73(3): 237-243.
[13] Ko HM, Seo KH, Han SJ, et al.Nuclear factor κB Dependency of platelet-activating factor-induced angiogenesis [J].The Journal of Cancer research, 2002, 62(6): 1809-1814.
[14] Chen SU, Chou CH, Ho CH, et al.Lysophosphatidic acid up-regulates expression of interleukin-8 and -6 in granulosa-lutein cells through its receptors and nuclear factor-kappaB dependent pathways: implications for angiogenesis of corpus luteum and ovarian hyperstimulation syndrome[J].The Journal of Clinical Endocrinology and Metabolism, 2008, 93(3): 935-943.
(童颖丹编辑)
Effect of endotoxin on activity of vascular endothelial cells differentiated from peripheral blood mononuclear cells
Qing-rong Fu, Li Chen, Jian-wen Lu, Shui-qing Huang, Lai-ming Deng, Zheng-hua Xiao
(The First Guangzhou People's Hospital Affiliated to Guangzhou Medical College, Guangzhou, Guangdong 510180, China)
Abstract:Objective To investigate the effects of lipopolysaccharide (LPS) on the in vitro differentiation of peripheral blood mononuclear cells (PBMCs) to vascular endothelial cells (VECs).Methods PBMCs from healthy volunteers were induced by VEGF and bFGF, and exposed to different concentrations of LPS.The inverted phase contrast microscope was used to observe the morphological changes of the cells.The immunofluorescence staining of CD31 and vWF was examined with flow cytometer.Results The morphological characteristics of the cells were observed at different passages under inverted phase contrast microscope.Compared with the control group, the number of positive cells in 0.01 μg/ml LPS -intervented group significantly increased (P < 0.05), while that in the 0.10 μg/ml LPS-intervented group had no significant difference (P > 0.05).The number of positive cells in 1.00-10.00 μg/ml LPS-intervented groups remarkably reduced compared to that in the control group (P< 0.05).Conclusions LPS at a concentration of 0.01 μg/ml can enhance differentiation of PBMCs.However, with the concentration of LPS increasing, the differentiation of PBMCs is inhibited, which may be related to activation of different number and subunits of NF-κB by different concentrations of LPS.
Keywords:endotoxin; peripheral blood mononuclear cell; vascular endothelial cell; cellular differentiation
[通信作者]肖正华,E-mail:742754223@qq.com;Tel:13544436627
收稿日期:2015-10-15
文章编号:1005-8982(2016)01-0041-05
中图分类号:R329.2;R543
文献标识码:A
