通过粪便确定大熊猫的性别方法研究
2016-03-23胡进耀余凌帆毛波勇
周 莎,彭 桦,刘 健,胡进耀*,余凌帆,毛波勇
(1.绵阳师范学院,生命科学与技术学院,四川绵阳 621000;2.四川省林业科学研究院,四川成都 610081;3.天全县林业局,四川天全 625500)
通过粪便确定大熊猫的性别方法研究
周 莎1,彭 桦1,刘 健1,胡进耀*1,余凌帆2,毛波勇3
(1.绵阳师范学院,生命科学与技术学院,四川绵阳 621000;2.四川省林业科学研究院,四川成都 610081;3.天全县林业局,四川天全 625500)
本文采用SDS、核酸吸附柱提取了大熊猫粪便中的DNA,根据大熊猫性别决定因子基因序列设计引物,以非性别特异性的脑源性神经营养因子基因片段(BDNF)作为正对照。使用人工饲养的大熊猫粪便DNA进行验证引物的有效性,结果表明该引物鉴定结果可靠。实验表明该方法方便快捷、可靠有效。
大熊猫;DNA提取;性别鉴定
大熊猫(Ailuropoda melanoleuca)是我国濒危保护动物(陈远飞,1986),是生物多样性保护的旗舰物种。保护大熊猫及其栖息地是保护生物多样性和生态系统功能完整性与稳定性的重要保障(申国珍,2008)。通过保护大熊猫旗舰种来保护其生存的整个生态系统,保护该生态系统的生物多样性,大熊猫作为保护其他珍稀物种及生物多样性保护的旗舰种己经成为了保护行为的一种象征。
性别鉴定是研究和保护野生大熊猫种群的一个重要课题。近年来随着分子生物学的发展,非损伤性取样或非损伤性基因取样在不伤害或触及动物的前提下收集脱落的毛发、粪便、口腔脱落细胞、陈旧皮张等作为分析样品获取样品中的DNA(魏辅文等,2001;李明等,2002;张于光等,2003;刘海等,2003;史燕等,2004)。由于非损伤性取样的广泛性、随机性和便利性,使其在物种鉴别、个体识别、性别鉴定、种群亲缘关系鉴定、种群数量估计等方面得到了广泛的应用(陈璐,2007)。睾丸决定基因位于Y染色体上,哺乳动物在发育期的性腺分化主要依赖于雄性特有的Y染色体(杨晓娟,1999)。随着性别决定的分子生物学机制的深入研究,以及P C R技术的广泛应用,近年来很多研究者应用哺乳动物Y染色体上连锁的特定基因P C R进行扩增,鉴定动物性别,如(田新民,2008)通过Z F Y基因对奶牛的性别鉴定(龚荣慈,1997);SR Y基因对野生狍性别鉴定(杨宝田,2005)。本研究拟通过对人工大熊猫性别的研究,探索大熊猫非损伤性性别鉴定的实验方法。
1 材料与方法
材料:大熊猫戴丽、傲傲、怡畅、英英粪便样本均采自都江堰大熊猫人工繁育基地、取样方法为非损伤性取样。方式为采集新鲜的大熊猫粪便。
基因组DNA提取:用酚—氯仿法对粪便样本DNA进行提取。方法提取产物的含量和纯度在凝胶电泳仪上进行检测。(张保卫,2004)
PCR扩增:PCR反应体系20μl,重蒸馏水14.5 μl,10×buffer 2μl,dNTP1.5μl,
引物1 0.5μl,引物2 0.5μl,模板DNA 1μl,Taq酶0.2μl。在NCBI(National Center for Biotechnology Information)数据库上查找大熊猫性别决定因子SRY(Sex Determining Region Y)基因序列。NCBI基因登录号AB292070.1,如图3所示。根据该序列使用DNAMAN软件设计的一对引物:
SRY F 5’-AGTTAGGCAGTGTTGTGTGACC-3’
SRY R 5’-ATAGTCTGGGTATTTCTCTCGGTC-3’
预期扩增片段600 bp左右。
为了保证结果的准确性,参考相关文献选用大熊猫脑源性神经因子基因BDNF作为对照基因,设计对照引物基因:
BDNF F 5’-TCGGTTGCATGAAGGC-3’
BDNF R 5’-TTGCTATCCATGGTAAGGG-3’
其扩增程序为:预变性:94℃,4min变性:95℃,45 s退火:50.4℃,45 s延伸:72℃,50 s,变性、退火、延伸共35个循环;最末一个循环紧接72℃再延伸10 min补缺口。
电泳及结果记录:取10μLPCR扩增基因产物,在3%的琼脂糖凝胶上电泳30 min,用凝胶成像仪(VilberLourmat公司)进行拍照并记录结果。基因电泳结果中,单条带表示此个体性别为雄性,双带表示此个体性别为雌性。
2 结果与分析
2.1 引物SRY、BDNF扩增结果
4只人工饲养大熊猫的详细资料(见表1)。

表1 人工饲养大熊猫粪便采集信息
2.2 不同预处理对提取DNA的影响
2.2.1 人工饲养大熊猫DNA提取
由图1可知,未预处理提取的DNA效果好,条带清晰,目标DNA质量较高,碎片少;用乙醇预处理提取的DNA碎片较多;用丙酮预处理的DNA碎片多,条带不清晰。
根据图1的DNA提取结果,我们得出用SDS法提取及核酸吸附柱纯化回收DNA效果较好,我们决定采用之前的提取方法并用丙酮及乙醇预处理。

图1 熊猫傲傲DNA检测
实验结果如图2所示:4只大熊猫都提取出了比较清晰完整的DNA条带,M1熊猫戴丽食物不是纯竹叶,粪便中残留了大量的水果消化残渣,提取出的条带有弥散现象,其它3个样品条带较好。F1DNA浓度较低,质量差,DNA破碎严重,杂DNA较多;F2目标DNA质量较好,有大量小段DNA;M1 DNA破碎严重,可能有较多杂质DNA;M2DNA质量较好。
2.3 不同退火温度扩增的结果
对人工饲养4只大熊猫粪便DNA进行了PCR扩增所得到的结果,加入SRY基因引物的是实验组,加入BDNF基因引物的是对照组。本次PCR扩增分别用大熊猫SRY基因引物及BDNF基因引物扩增对4只人工养殖的大熊猫DNA进行PCR扩增。
用提取质量较好的M2 DNA为模板,如上所示进行温度梯度PCR扩增,设置了5组温度,分别是48℃、50.4℃、51.6℃、54℃、56℃进行扩增以确定最佳的退火温度,结果如图3所示。SRY基因扩增最佳退火温度在50℃左右,扩增的条带大小为500 bp左右,BDNF基因最佳退火温度在48℃左右。(图3和图4)

图3 SRY温度梯度PCR检测结果
3 结论
在采集大熊猫粪便过程中,尽量选取7 d以内的表面带有粘膜的新鲜粪便,用此粪便提取DNA效果较好。在保存样品中不同的保存方法在刘艳华等人的论述中已有了较全面的论述(刘艳华,2006),我们参考钟华等人使用丙酮预处理样品(钟华,2003)发现丙酮影响后续DNA的质量,参考使用乙醇预处理样品也发现乙醇影响后续DNA的处理。实验结果表明,直接采用冷藏保存处理方便,提取的DNA效果好。
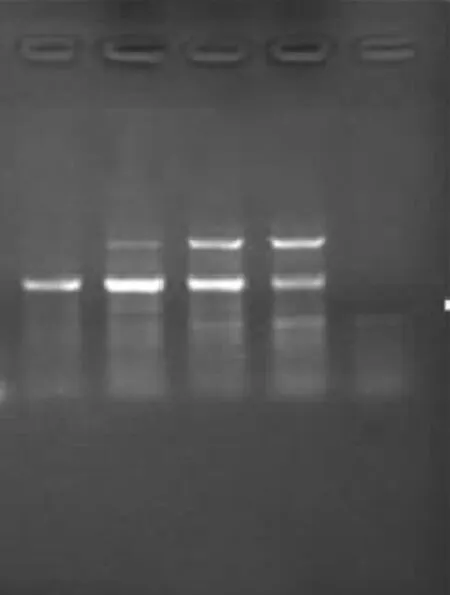
图4 BDNF温度梯度PCR检测结果
影响粪便D N A提取的因素除了保存方法外,动物的取食和环境的温度也会影响。(G oossens et al,2000;Melanie et al.,2003;Lucchini et al,2002)提取DNA使用SDS和核酸纯化柱方法提取,提取DNA质量好,方便快捷,便于后续的PCR实验。由于粪便中含有DNA聚合酶抑制物、植物多糖等PCR抑制剂,传统的提取纯化方法不能将其去除,便会影响PCR扩增的结构,所以选择使用乙醇提取纯化粪便中的DNA,并将其用于PCR检测。
根据NCBI上面公布的大熊猫的性别决定基因序列,采用DNAMAN软件设计的特异性引物,扩增效果好,特异性高。对照引物采用田新民等使用的大熊猫脑源性神经营养因子基因片段(BDNF)引物(田新民,2008),在50摄氏度左右扩增效果最好。
通过粪便DNA扩增鉴定的4只人工饲养的大熊猫的性别与实际相符,表明我们的鉴别方法方便、快捷、准确,可以对野外鉴定大熊猫性别起到重要的作用。
[1] 魏辅文,饶刚,李明,方盛国,冯祚建.分子粪便学及其应用——可靠性、局限性和展望[J].兽类学报,2001,21(2):143~152.
[2] 李明,魏辅文,饶刚,等.非损伤性取样在保护遗传学研究中的应用[J].动物学报,2001,47(3):338~342.
[3] 张于光,李迪强,饶力群,等.东北虎微卫星DNA遗传标记的筛选及在亲子鉴定中的应用[J].动物学报,49(1):118~123.
[4] 刘海,杨光,魏辅文,等.中国大陆梅花鹿mtDNA控制区序列变异及种群遗传结构分析[J].动物学报,2003,49(1):53~60.
[5] 史燕,吴孝兵,晏鹏,等.扬子鳄鞣制皮革和鳞片的DNA提取方法[J].动物学报,2004,50(2):297~301.
[6] 陈璐,岳曦.非损伤性取样研究进展[J].四川动物,2007,01:224~226.
[7] 杨晓娟,杨玉华,张义正.大熊猫与熊类动物性别的分子鉴定[J].应用与环境生物学报,1999,5(3):288~290.
[8] 田新民,张明海,罗理扬.通过粪便确定野生马鹿性别的试验[J].东北林业大学学报,2008,03:68~69.
[9] 龚荣慈.性别鉴定的分子生物学技术与ZFY途径[J].西南民族学院学报:自然科学版,1997,23(1):85~89.
[10] 杨宝田.应用SRY-PCR扩增鉴定狍(Capreoluscapreolus)的性别[J].中国兽医学报,2005,25(4):435~438
[11] 李平,白秀娟.狍SRY基因PCR扩增的初步研究[J].经济动物学报,2005,9(2):107~109.
[12] 张保卫,魏辅文.大熊猫和小熊猫粪便DNA提取的简易方法[J].动物学报,2004,(3):452~458
[13] 刘艳华,张明海.野生动物粪便在濒危物种遗传结构研究中的应用[J].野生动物杂志,2006,27(1):46~49.
[14] 钟华,赖旭龙.一种从大熊猫粪便中提取DNA的方法[J].动物学报,2003,(5):670~674
[16] Goossens B,Chikhi L,Utam i S S,et al.A multi-samples,multiextracts approach form icrosa tellite analysis off aecal samples in an arboreal ape[J].Conservation Genetics,2000,1:157~162.
[15] Melanie A,Murphy,Waits,et al.The influence of diet on faecal DNA amplification and sex identification in brown bears(Ursus arctos)[J].Molecular Ecology,2003,12:2261~2265.
[16] Lucchini V,Fabbri E,Marucco F,et al.Noninvasive molecular tracking of colonizing wolf(Canislupu)packs in the westrn Italian Alps[J].Molcular Ecology,2002,11:857~868.
A M ethod of Sex-determ ination Pandas Tests of Giant
ZHOU Sha1PENG Hua1HU Jin-yao*1YU Ling-fan2MAO Bo-yong3
(1.College of Life Science&Biotechnology,Mianyang Normal University,Mianyang 621000,China;2.Sichuan Academy of Forestry,Chengdu 610081,3.Tian Quan Forestry Bureau in Sichuan Province,Tianquan 625500,China)
In this paper,Using SDSand nucleic acid adsorption column to extraction of the giant panda fecal DNA.According to the giant panda sex determination gene primers design factor,take BDNF as the positive control.Validation of the effectiveness of the primers for the use of fecal DNA from artificially reared giant pandas.The results showed that the resultswere reliable for the identification of the primers. Experiments show that thismethod is convenient and reliable.
Panda,DNA extraction,Determination of sex
Q958
A
1003-5508(2016)06-00-0
2016-09-07
天全县喇叭河-紫石-二郎山大熊猫基因交流走廊带建设项目、天全县大熊猫栖息地修复项目调查监测及技术培训部分项目(项目编号:天政采招[2014]28号);国家自然科学基金项目(31170319)。
周莎(1992-),绵阳师范学院本科生。
胡进耀,博士、教授,主要从事生态系统健康与安全维护研究。
