帕洛诺司琼与格拉司琼联合应用对化疗所致恶心、呕吐的防治效果观察
2016-03-23马原刘杰
马原,刘杰
(1 济南大学·山东省医学科学院医学与生命科学学院,济南250022;2山东省肿瘤医院)
帕洛诺司琼与格拉司琼联合应用对化疗所致恶心、呕吐的防治效果观察
马原1,2,刘杰1
(1 济南大学·山东省医学科学院医学与生命科学学院,济南250022;2山东省肿瘤医院)
摘要:目的探讨帕洛诺司琼与格拉司琼联合应用对化疗所致恶心、呕吐的防治作用和安全性。方法接受培美曲塞或多西他赛联合顺铂方案化疗的非小细胞肺癌患者111例,其中化疗前给予帕洛诺司琼联合格拉司琼36例(联合组),给予帕洛诺司琼38例(帕洛诺司琼组),给予格拉司琼例37例(格拉司琼组)。比较各组急性期(化疗后0~24 h)、延迟期(化疗后24~120 h)及全期(化疗后0~120 h)的呕吐完全缓解率,急性期、延迟期解救治疗率、恶心改善率及不良反应发生情况。结果三组急性期完全缓解率及恶心改善率组间比较差异无统计学意义(P均>0.05);联合组延迟期呕吐完全缓解率、恶心改善率及全期完全缓解率均明显高于帕洛诺司琼组和格拉司琼组(P均<0.05)。三组解救治疗率比较差异无统计学意义(P>0.05)。三组不良反应主要为头痛、便秘及腹胀等,各不良反应的发生率三组比较差异无统计学意义(P均>0.05)。结论帕洛诺司琼与格拉司琼联用对高致吐性化疗药所致的急性期、延迟期恶心、呕吐反应有预防及治疗作用,其效果优于单用帕洛诺司琼或格拉司琼,且较为安全。
关键词:帕洛诺司琼;格拉司琼;恶心;呕吐;化疗
恶心、呕吐(CINV)等消化道反应是恶性肿瘤患者化疗过程中常见的不良反应,不仅能导致患者短时间内营养缺乏、脱水和电解质失衡,还会降低患者治疗的依从性,贻误治疗的最佳时机。格拉司琼为第一代短效5-HT3受体拮抗剂,帕洛诺司琼为第二代长效5-HT3受体拮抗剂,二者均为抑制CINV的常用药物,后者的效果虽好于前者[1,2],但其单药应用对CINV的控制率均无较大突破,尤其是对于高致吐化疗药物所致的迟发性CINV控制率更低[3]。目前延迟性CINV依然是止吐药物疗效的“瓶颈”。本研究观察了格拉司琼与帕洛诺司琼联合应用对CINV的防治效果及其安全性,现将研究结果报告如下。
1资料与方法
1.1临床资料纳入标准:①病理组织学或细胞学确诊的非小细胞肺癌患者;②化疗前血常规、尿常规、肝肾功能、电解质及心电图检查均基本正常;③依从性好并签署知情同意书;⑤ECOG评分≤2分。排除标准:①有消化道梗阻者;②化疗前24 h内用过止吐药或止吐相关药物或化疗前已有呕吐者;③中枢神经系统转移或有颅内高压所致呕吐者;④慢性咽喉炎者;⑤因剧烈疼痛使用吗啡等药物者;⑥精神疾患或其他原因引起顽固性呕吐者。选取2014年6月~2015年2月在山东省肿瘤医院入院治疗并符合纳入及排除标准的111例患者,其中男59例、女52例,年龄20~75(56.39±8.91)岁,ECOG评分(体力状况评分)1分73例、2分38例,有饮酒史48例、无饮酒史63例,有化疗史66例、无化疗史45例。入选患者随机分为联合组36例,帕洛诺司琼组38例,格拉司琼组37例。三组一般资料具有可比性。
1.2治疗方法三组化疗方案为多西他赛60~75 mg/m2或培美曲塞500 mg/m2第1天,联合顺铂75 mg/m2分别于第1、2、3天给予,21天为一周期。联合组化疗前30 min缓慢静推盐酸帕洛诺司琼注射液0.25 mg,第1、3天给药,化疗前30 min缓慢静推格拉司琼注射液3 mg,第1、2、3天给药。帕洛诺司琼组单用盐酸帕洛诺司琼注射液;格拉司琼组单用格拉司琼注射液3 mg,用法及剂量同联合组。三组化疗第1、2、3天每日均给予地塞米松10 mg。治疗期间依据患者情况行解救治疗(对应用止吐药物后每日仍出现呕吐患者予甲氧氯普胺、地塞米松等药物)。
1.3相关指标观察化疗后1~5天逐日记录患者出现的所有症状、体征及每日呕吐发作情况,包括呕吐1次;或连续数次呕吐,缓解时间不超过1 min;或持续时间≤5 min的数次干呕;或持续时间≤5 min的数次干呕伴缓解时间未超过1 min的数次呕吐。记录恶心、呕吐的分级程度[4]。观察以下指标:①止吐效果:观察三组急性期(化疗后0~24 h)、延迟期(化疗后24~120 h)及全期(化疗后0~120 h)的呕吐完全缓解率,即化疗后没有出现呕吐发作(无论有无恶心),且未使用药物解救治疗。②解救治疗率[5]。③恶心改善率:以恶心程度≤Ⅰ级计算恶心改善率(0级:无恶心;Ⅰ级:轻度恶心,不影响进食;Ⅱ级:恶心较重且频繁,影响进食;Ⅲ级:持续严重恶心,不能进食)。④安全性:消化道反应分级(恶心程度)及不良反应评估按照NCI-CTC(第3版)标准[6]。

2结果
2.1三组不同时期呕吐完全缓解率比较见表1。

表1 三组不同时期呕吐完全缓解率比较
注:与联合组比较,*P<0.05。
2.2三组解救治疗率比较联合组、帕洛诺司琼组、格拉司琼组解救治疗率分别为19.44%、26.32%、37.84%,三组解救治疗率比较差异无统计学意义(P>0.05)。
2.3三组恶心改善率比较三组恶心改善率比较见表2。

表2 三组不同时期恶心改善率比较
注:与联合组比较,*P<0.05。
2.4三组不良反应发生情况比较三组最多出现的不良反应为便秘、头痛及腹胀,症状均轻微,患者可耐受。各组不良反应的发生率比较差异无统计学意义(P均>0.05)。见表3。
3讨论
CINV是化疗最常见的不良反应之一,发生率为70%~80%的顺铂为多种癌症治疗方案中的基石,
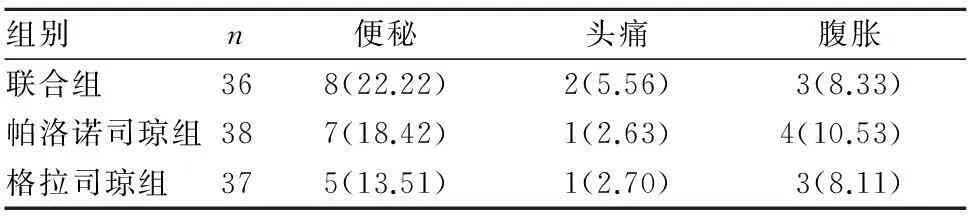
表3 三组药物不良反应发生情况比较[例(%)]
据统计,其每次用量30 mg/m2时发生呕吐的风险高达100%[7],常影响治疗计划的完成。
化疗引起恶心、呕吐的机制相当复杂,目前一般认为主要通过以下途径引发[5,6]:①化疗药物刺激胃肠道黏膜,导致黏膜上皮的嗜铬细胞释放5-HT,随后5-HT与受体结合产生神经冲动由迷走神经和交感神经传入呕吐中枢导致呕吐;②化疗药物及其代谢产物直接刺激第四脑室底的呕吐中枢诱发呕吐反应。③感觉、精神因子直接刺激大脑皮质通路导致呕吐,多见于预期性呕吐。格拉司琼是一种外周神经原及中枢神经系统5-HT3受体的强效、高选择性的竞争抗拮剂,可同时阻断中枢和周围5-HT3受体,其清除半衰期为3.1~5.9 h。Grunberg等[1]研究显示,第1代5-HT3受体拮抗剂格拉司琼、恩丹西酮、托烷司琼对延迟性呕吐的完全缓解率分别为55.5%、48.5%和48.5%,本研究中格拉司琼对延迟性CINV的完全缓解率为48.65%。对于高致吐性化疗方案,采用第1代5-HT3受体拮抗剂加以预防仍有超过一半的患者持续出现恶心、呕吐[8]。药代动力学研究显示,帕洛诺司琼的半衰期长达40 h[9],与5-HT3受体的亲和力是第1代药物的30~100倍[10],其与第1代药物不同的是不仅与5-HT3受体具有高度的变构相互作用,持续抑制5-HT3受体的功能;且可阻止5-HT3/NK1受体信号的串扰,抑制在延迟期发挥重要作用的神经递质P物质介导的致吐反应,对于延迟性CINV表现出了较高的应答率[11~13]。但多项随机、双盲的临床试验数据显示,其对延迟期呕吐的完全缓解率为42%~80%[14~18],仍有20%~58%的患者未获得满意效果。本研究中延迟期呕吐完全缓解率也只有60.53%。目前,国内外关于两种5-HT3受体拮抗剂联合应用的报道鲜见。本研究试图在格拉司琼的基础上联用帕洛诺司琼,作用于呕吐发生机制中的相关靶点,以期达到协同镇吐的作用。
本研究结果显示,化疗后24 h内联合组完全缓解率高于帕洛诺司琼组及格拉司琼组;化疗后24~120 h联合组完全缓解率明显高于两单药组。本研究中我们将化疗方案里致吐性较强的顺铂分次分量给药,这种连续多日的化疗虽会降低急性期呕吐发生率,但延迟性呕吐的发生率会相对升高,可增加延迟期止吐的难度。分析本研究三组的全期完全缓解率,联合组达到了75%,明显高于两单药组;恶心改善率况亦优于两单药组。虽三组解救治疗率无统计学差异,但联合组已经显示出一定优势。
在安全性方面,联合组与帕洛诺司琼组或格拉司琼组的不良反应发生率相似,并未因止吐药的种类增多导致不良反应增加,仅有少数患者表现为轻度头痛、便秘及腹胀。所有不良反应中便秘发生率较高,亚组分析显示老年患者便秘发生率相对较高,可能与老龄人肾脏排泄功能减弱、肝脏解毒能力降低及胃肠功能下降有关。
综上所述,帕洛诺司琼与格拉司琼联合应用能明显减轻化疗患者的消化道反应,效果优于帕洛诺司琼或格拉司琼单用,且毒性反应未增加,患者耐受性良好。证实二者联合应用是防治化疗所致CINV的有效方案。
参考文献:
[1] Grunberg SM, Deuson RR, Mavros P, et al. Incidence of chemotherapy-induced nausea and emesis after modern antiemetics[J]. Cancer, 2004,100(10):2261-2668.
[2] Botrel TEA, Clark OAC, Clark L, et al. Efficacy of palonosetron (PAL) compared to other serotonin inhibitors (5-HT3R) in preventing chemotherapy-induced nausea and vomiting (CINV) in patients receiving moderately or highly emetogenic (MoHE) treatment: systematic review and meta-analysis[J]. Support Care Cancer, 2011,19(6):823-832.
[3] Petru E, Andel J, Angleitner-Boubenizek L, et al. Early Austrian multicenter experience with palonosetron as antiemetic treatment for patients undergoing highly or moderately emetogenic chemotherapy[J]. Wien Med Wochenschr, 2008,158(5-6):169-173.
[4] Rahimian R, Dehpour AR, Fakhfouri G, et al. Tropisetron upregulates cannabinoid CB1 receptors in cerebellar granule cells: possible involvement of calcineurin[J]. Brain Res, 2011(1417):1-8.
[5] Singhal AK, Kannan S, Gota VS. 5HT 3 antagonists for prophylaxis of postoperative nausea and vomiting in breast surgery: a meta-analysis[J]. J Postgrad Med, 2012,58(1):23-31.
[6] Rojas C, Slusher BS. Pharmacological mechanisms of 5-HT 3 and tachykinin NK 1 receptor antagonism to prevent chemotherapy-induced nausea and vomiting[J]. Eur J Pharmacol, 2012,684(1):1-7.
[7] Faessel H, Ravva P, Williams K. Pharmacokinetics, safety, and tolerability of varenicline in healthy adolescent smokers: a multicenter, randomized, double-blind, placebo-controlled, parallel-group study[J]. Clin Ther, 2009,31(1):177-189.
[8] Celio L, Agustoni F, Ricchini F, et al. Palonosetron plus dexamethasone in highly emetogenic chemotherapy: pooled data from two Phase Ⅲ trials[J]. Future Oncol, 2013,9(10):1451-1458.
[9] Eisenberg P, MacKintosh FR, Ritch P, et al. Efficacy, safety and pharmacokinetics of palonosetron in patients receiving highly emetogenic cisplatin-based chemotherapy: a dose-ranging clinical study[J]. Ann Oncol, 2004,15(2):330-337.
[10] Gralla R, Lichinitser M, Van Der Vegt S, et al. Palonosetron improves prevention of chemotherapy-induced nausea and vomiting following moderately emetogenic chemotherapy: results of a double-blind randomized phase Ⅲ trial comparing single doses of palonosetron with ondansetron[J]. Ann Oncol, 2003,14(10):1570-1577.
[11] Rojas C, Slusher BS. Pharmacological mechanisms of 5-HT 3 and tachykinin NK 1 receptor antagonism to prevent chemotherapy-induced nausea and vomiting[J]. Eur J Pharmacol, 2012,684(1):1-7.
[12] Rojas C, Raje M, Tsukamoto T, et al. Molecular mechanisms of 5-HT 3 and NK 1 receptor antagonists in prevention of emesis[J]. Eur J Pharmacol, 2014,722:26-37.
[13] Schwartzberg LS, Jacobs P, Matsouka P, et al. The role of second-generation 5-HT 3 receptor antagonists in managing chemotherapy-induced nausea and vomiting in hematological malignancies[J]. Crit Rev Oncol Hematol, 2012,83(1):59-70.
[14] Eisenberg P, MacKintosh FR, Ritch P, et al. Efficacy, safety and pharmacokinetics of palonosetron in patients receiving highly emetogenic cisplatin-based chemotherapy: a dose-ranging clinical study[J]. Ann Oncol, 2004,15(2):330-337.
[15] Aapro MS, Grunberg SM, Manikhas GM, et al. A phase Ⅲ, double-blind, randomized trial of palonosetron compared with ondansetron in preventing chemotherapy-induced nausea and vomiting following highly emetogenic chemotherapy[J]. Ann Oncol, 2006,17(9):1441-1449.
[16] Maemondo M, Masuda N, Sekine I, et al. A phase Ⅱ study of palonosetron combined with dexamethasone to prevent nausea and vomiting induced by highly emetogenic chemotherapy[J]. Ann Ocol, 2009,20(11):1860-1866.
[17] Lorusso V, Spedicato A, Petrucelli L, et al. Single dose of palonosetron plus dexamethasone to control nausea, vomiting and to warrant an adequate food intake in patients treated with highly emetogenic chemotherapy (HEC). Preliminary results[J]. Support Care Cancer, 2009,17(12):1469-1473.
[18] Schwartzberg L, Barbour SY, Morrow GR, et al. Pooled analysis of phase Ⅲ clinical studies of palonosetron versus ondansetron, dolasetron, and granisetron in the prevention of chemotherapy-induced nausea and vomiting (CINV)[J]. Support Care Cancer, 2014,22(2):469-477.
(收稿日期:2015-04-28)
中图分类号:R730.53
文献标志码:B
文章编号:1002-266X(2016)04-0064-03
doi:10.3969/j.issn.1002-266X.2016.04.024
通信作者:刘杰(E-mail: 1029752403@qq.com)
