精子质量对不孕不育患者辅助生殖技术选择的指导作用
2016-03-23肖鑫李大文冯刚成俊萍何泳志
肖鑫,李大文,冯刚,成俊萍,何泳志
(1宁波市泌尿肾病医院,浙江宁波 315100;2 广西壮族自治区人民医院;3广西壮族自治区妇幼保健院)
精子质量对不孕不育患者辅助生殖技术选择的指导作用
肖鑫1,李大文2,冯刚3,成俊萍2,何泳志3
(1宁波市泌尿肾病医院,浙江宁波 315100;2 广西壮族自治区人民医院;3广西壮族自治区妇幼保健院)
摘要:目的探讨精子质量对不孕不育患者辅助生殖技术选择的指导作用。方法选择201对行常规体外受精胚胎移植术(IVF-ET)的不孕不育夫妇,其中行IVF-ET成功(二极体的胚胎数量占胚胎总数≥30%)者126对(IVF-ET组),IVF-ET失败(二极体的胚胎数量占总胚胎数<30%)后行补救卵胞浆内单精子注射术(R-ICSI)75对(R-ICSI组)。比较两组精液常规、精子DNA完整率、精子顶体完整率、顶体反应率;体外受精后比较两组受精率、优胚胎率。结果IVF-ET组精子密度、活力及正常形态率均高于R-ICSI组(P均<0.05);R-ICSI组精子DNA断裂指数(DFI)明显高于IVF-ET组(P<0.05),顶体完整率、顶体反应率两组比较无统计学差异(P均>0.05);R-ICSI组受精率、优胚率低于IVF-ET组(P均<0.05)。结论当精子密度低于11.1×106/mL,正常形态率低于1.4%,DFI高于15.9%,顶体完整率低于77.3%,顶体反应率低于15.7%时建议直接行R-ICSI助孕。
关键词:常规体外受精胚胎移植术;补救卵胞浆内单精子注射术;精液质量;受精能力
近年来,随着人类辅助生殖医学的发展, 常规体外受精胚胎移植术(IVF-ET)及卵胞浆内单精子注射术(ICSI)成为人类重要的辅助生殖技术。ICSI最早是在20世纪90年代后期进行尝试作为对常规体外受精(IVF)患者体外受精率低下或受精完全失败的一种补救措施,又称为补救ICSI(R-ICSI)[2]。根据精子各项参数及精子功能选择合适的辅助生殖技术是近年来生殖医学研究的热点及难点。本研究观察行R-ICSI与IVF-ET的男性精液各项指标及受精率、优胚率的差异,以指导临床选择辅助生殖技术。
1临床资料
1.1基本资料选择2013年6月~2014年6月在广西壮族自治区人民医院生殖中心就诊的不孕不育夫妇201对。纳入标准:男方:①年龄≤40周岁;②临床确诊为不育症,体检未发现睾丸、附睾及输精管有明显异常,无其他合并症;③婚后性生活正常,不避孕1年以上不育。女方:①年龄≤38周岁;②存在单纯性输卵管因素,其他检查无异常;③进行常规促性腺激素释放激素激动剂(GnRH-a)长方案治疗。排除标准:①男方存在泌尿生殖系统急性感染、性传播疾病;②男方存在先天畸形,如精路梗阻、睾丸萎缩(包括附睾)、染色体异常、精索静脉曲张Ⅱ度以上;③家族遗传病及染色体异常;④合并心血管、肝、肾和造血系统等疾病。其中行IVF-ET成功(二极体的胚胎数量占胚胎总数≥30%)者126对(IVF-ET组),IVF-ET失败(二极体的胚胎数量占总胚胎数<30%)后行R-ICSI者75对(R-ICSI组)。IVF-ET组男(28.44±2.20)岁、女(27.55±2.32)岁,不孕不育病程(6.22±2.71)年,采卵(10.37±4.22)枚;R-ICSI组男(28.55±2.24)岁、女(27.81±2.52)岁,不孕不育病程(5.60±2.47)年,采卵(11.05±5.02)枚。两组一般资料比较均具有可比性。本研究通过医院伦理委员会批准,患者本人均知情并签署同意书。
1.2精子质量检测两组行IVF-ET前采用手淫法取精液,采用直接上游法加非连续密度梯度法洗涤精子后检测精子质量。 ①精子密度:参照《人类精液检查与处理实验室手册》第5版,使用计算机精子辅助分析(CASA) 系统测定精子密度。②精子活力:使用CASA系统测定精子活力。③精子形态:采用Diff-Quick染色法分析精子形态,计算精子形态正常率。④精子DNA完整性、顶体完整率及顶体反应率:采用精子染色质扩散试验检查精子DNA,精子DNA碎片的判断标准:计数500个精子,观察精子光晕大小,根据光晕与精子头部横径的比例,粗分为大、中、小和无光晕4 个等级,大和中光晕表示精子DNA 完整无碎片,小和无光晕表示精子DNA断裂为碎片。精子DNA碎片化指数(DFI)=(小光晕精子+无光晕精子+退化精子)/精子总数。用实验室计数器(血球分类计数器) 计数顶体完整和顶体反应的数目,每张图片精子计数为200条,计算两张重复涂片顶体完整和顶体反应所占比率;若两个百分率之间的差异可接受则报告已发生顶体反应精子的平均百分率,以最接近的整数报告已发生顶体反应的精子百分率。采用SPSS17.0统计软件。偏态分布的资料以中位数及四分位数[M(P25,P75)]表示,比较采用秩和检验,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。检测结果见表1、表2。
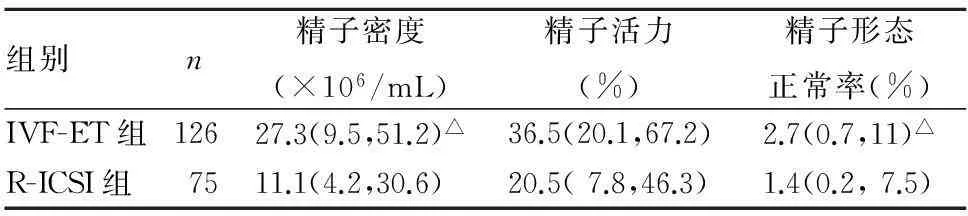
表1 两组精子密度、活力、形态正常率比较[M(P25,P75)]
注:与R-ICSI组比较,P<0.05,△P<0.01。

表2 两组DFI、顶体完整率及顶体完整率比较[M(P25,P75)]
注:与R-ICSI组比较,P<0.05。
1.3受精率及优胚率情况受精后16~20 h在倒置显微镜下观察卵细胞的原核情况。双原核(2PN)受精卵定义为正常受精卵,将1PN和多PN的受精卵定义为异常受精卵;受精后培养72 h观察胚胎情况。参照《现代辅助生育技术》[1],根据卵裂球大小、胞质均匀程度、胞浆碎片数量将受精后3天胚胎分为4级:1级胚胎为卵裂球大小均匀,胞质均匀清晰,胞质碎片<5%;2级胚胎为卵裂球大小略不均匀,形态略不规则,胞质碎片<20%;3级胚胎为卵裂球大小不均匀,可有明显的形态不规则,胞质碎片<50%;4级胚胎为卵裂球大小严重不均匀,胞质可有严重颗粒现象,胞质碎片>50%;其中1、2级胚胎为优质胚胎。两组受精率及优胚率比较见表3。

表3 两组受精率及优胚率比较±s)
注:与R-ICSI组比较,*P<0.01。
2讨论
在我国由于ICSI的治疗费用相比IVF要高昂很多,在整个试管婴儿周期数中行ICSI的周期数所占比例并不像欧美等发达国家那么高。然而传统IVF和ICSI之间的选择仍然存在困难。国内外众多生殖医学领域的研究结果发现,在患者病情及基本状况相同的情况下,IVF-ET与ICSI在受精率、临床妊娠率及活产率上并无显著的统计学差异[3~6]。但两者的优胚率目前还存在争议,Van der Westerlaken等[7]的研究结果提示ICSI获得的优势胚胎明显多于IVF-ET,但Kihaile等[8]的研究却得出相反的结论。为减轻患者的经济负担,增加受孕的成功率,根据男性精液质量及功能指标选择助孕方式已成为一种趋势。但目前选择时的精液标准尚不统一。
常规体外受精时受精率低下或完全受精失败的因素较为复杂,除卵子因素外精子质量是主要因素。精子的密度及其活力是评价精液质量的两项重要指标,常用于评价男性的生育能力。顾斌等[9]研究结果提示,当经过上游处理法处理后的精子其前向性运动的精子总数<5×106/mL时,其常规体外受精率显著降低。Lu等[10]认为精子质量异常会降低精卵结合率及后期的胚胎质量;而Tsai等[11]研究结果却认为ART的治疗结局和子代健康不受精子质量的影响,导致上述结论不一致的原因有可能与其研究对象的纳入标准、分组方式以及实验方法等存在差异有关。本研究结果显示,IVF-ET组正常受精者精子密度、活率、正常形态率显著高于补救ICSI组。提示选择辅助生殖技术时精液常规检查可预测IVF-ET或ICSI的助孕结果,患者在了解两种辅助生殖技术的情况下可自己选择助孕方式。
研究发现,传统的精液参数分析结果不够精确,使得依靠这一评价的诊断灵敏度降低[12]。Natali等[13]认为,仅依据常规精液参数很难确定男性因素是否是导致不孕不育的原因,因此额外的精子功能测试是必要的。近十年来,精子DNA的完整性测定被认定为一项重要的精子功能参数[14]。精子发生期间,精子DNA出现各种改变,以实现高度的组织、紧致和凝聚态结构[15];独特的染色质结构保护父亲的基因使得其对卵母细胞传递正确的基因组。已有大量的案例研究评估DNA碎片率与人类精液和辅助生殖受精、胚胎发育和胚胎品质及妊娠结局的关系[16]。本研究结果显示,IVF-ET组正常受精患者洗涤后DFI显著高于R-ICSI组,且IVF-ET组受精率、优胚率显著高于R-ICSI组。主要原因是行IVF助孕患者的精子密度、活力及精子DNA完整率显著高于R-ICSI组。
综上所述,以本研究得出的精液各项指标为依据,当精子密度低于11.1×106/mL,正常形态率低于1.4%,DFI高于15.9%,顶体完整率低于77.3%,顶体反应率低于15.7%时建议直接行ICSI助孕,避免IVF受精失败后行补救ICSI再次失败,以缩短助孕周期,减轻患者心理及经济负担。
参考文献:
[1] Terriou P, Sapin C, Giorgetti C, et al. Embryo score is a better predictor of pregnancy than the number of transferred embryos or female age[J]. Fertil Steril, 2001,75(3):525-531.
[2] Yuzpe AA, Liu Z, Fluker MR. Rescue intracytoplasmic sperm injection (ICSI)-salvaging in vitro fertilization (IVF) cycles after total or near total fertilization failure[J]. Fertil Steril, 2000,76(3):1115-1119.
[3] Dozortsev D, Nagy P, Abdelmassih, et al. Heoptimal time for intracytoplasmic sperm injection in the human is from 37 to 41h after administration of human chorionic gonadotropin[J]. Fertil Steril, 2004,82(6):1492-1496 .
[4] De Mouzon J, Goossens V, Bhattacharya S, et al. Assisted reproductive technology in Europe, 2006: results generated from European registers by ESHRE[J]. Hum Reprod, 2010,25(8):1851-1862.
[5] Xie BG, Huang YH, Zhu WJ, et al. Comparison of the outcome of onventional in vitro fertilization and intracytoplasmic sperm injection in moderate male infertility from ejaculate[J]. Urol Int, 2015,94(1):111-116.
[6] Hashimoto H, Ishikawa T, Goto S, et al. The effects of severity of oligozoospermia on intracytoplasmic sperm injection (ICSI) cycle outcome[J]. Syst Biol Reprod Med, 2010,56(1):91-95.
[7] Van der Westerlaken L, Naaktgeboren N, Verburg H, et al. Conventional in vitro fertilization versus intracytoplasmic sperm injection in patients with borderline semen: a randomised study using sibling oocytes[J]. Fertil Steril, 2006,85(2):395-400.
[8] Kihaile PE, Misumi J, Hirotsuru K, et al. Comparison of sibling oocyte outcomes after intracytoplasmic sperm injection and in vitro fertilization in severe teratozoospermic patients in the first cycle[J]. Int J Androl, 2003,26(1):57-62.
[9] 顾斌,郑爱燕,丁洁,等.精子质量和功能参数与 IVF 受精率和优胚率的关系探讨[J].生殖与避孕, 2011,26(6):881-884.
[10] Lu YH, Gao HJ, Li BJ, et al. Different sperm sources and param-eters can influence intracytoplasmic sperm injection outcomes before embryo implantation[J]. J Zhejiang Univ Sci B, 2012,13(1):1-10.
[11] Tsai CC, Huang FJ, Wang LJ, et al. Clinical outcomes and development of children born after intracytoplasmic sperm injection(ICSI) using extracted testicular sperm or ejaculated extreme severe oligoas-theno-teratozoospermia sperm: a comparative study[J]. Fertil Steril, 2011,96(3):567-571.
[12] Lewis SE. Is sperm evaluation useful in predicting human fertility? Reproduction[J]. Hum Reprod, 2007,134(1):31-40.
[13] Natali A, Turek PJ. An assessment of new sperm tests for male infertility[J]. Urology, 2010,77(5):1027-1033.
[14] Lewis SE, Aitken RJ, Conner SJ, et al. The impact of sperm DNA damage in assisted conception and beyond: recent advances in diagnosis and treatment[J]. Reprod Biomed Online, 2013,27(4):325-337.
[15] Simon L, Brunborg G, Stevenson M, et al. Clinical signi cance of sperm DNA damage in assisted reproduction outcome[J]. Hum Reprod, 2010,25(7):1594-1608.
[16] Sakkas D, Alvarez JG. Sperm DNA fragmentation: mechanisms of origin, impact on reproductive outcome, and analysis[J]. Fertil Steril, 2010,93(4):1027-1036.
Guidance of sperm quality in choosing assisted reproductive technology for infertility patients
XIAOXin1,LIDawen,MAGang,CHENGJunping,HEYongzhi
(1NingboUrologyandNephrologyHospital,Ningbo315100,China)
Abstract:ObjectiveTo evaluate the guidance of sperm quality in choosing assisted reproductive technology for patients with infertility. MethodsWe chose 201 infertile couples receiving conventional in vitro fertilization-embryo transplantation (IVF-ET), in whom, 126 couples (IVF-ET group) succeeded (the number of diodes accounted for≥30% of embryos) and 75 couples (R-ICSI group) with unsuccessful IVF-ET (the number of diodes accounted for <30% of embryos) received remedy intra-cytoplasmic sperm injection (R-ICSI). We compared the semen routine, sperm DNA integrity rate, sperm acrosome intact rate, acrosome reaction rate, rate of fertilization and good embryo rate of the two groups. ResultsThe normal morphology rate, sperm density and living rate of the IVF-ET group were higher than those in the R-ICSI group (all P<0.05). The sperm DNA index (DFI) of the R-ICSI group was significant higher than that of the IVF-ET group (P<0.05). No statistical differences were found in the acrosome intact rate and acrosome reaction rate between the two groups (all P>0.05). The fertilization rate and good embryo rate of the R-ICSI group were lower than those of the IVF-ET group (all P<0.05). ConclusionWhen the sperm density is less than 11.07×106/mL, normal form rate is below 1.4%, DFI is higher than 15.9%, acrosome intact rate is below 77.3% and the acrosome reaction rate is less than 15.7%, we advise to use ICSI to assist reproduction.
Key words:conventional in vitro fertilization-embryo transplantation; remedy intra-cytoplasmic sperm injection; semen quality; fertilization ability
(收稿日期:2015-09-19)
中图分类号:R312.2
文献标志码:A
文章编号:1002-266X(2016)04-0019-03
doi:10.3969/j.issn.1002-266X.2016.04.006
通信作者简介:李大文(1964-),男,硕士研究生导师,主任医师,主要从事生殖男科方面的临床工作。E-mail: Lidawendavid@aliyun.com
作者简介:第一肖鑫(1990-),男,硕士研究生,主要从事泌尿男科方面的临床工作。E-mail: 835670636@qq.com
基金项目:国家自然科学基金资助项目(81360107);广西医疗卫生适宜技术研究与开发课题(S201421-03)。
