臭氧消毒对村镇饮用水生物稳定性的影响
2016-03-23鄢元波贾燕南丁昆仑孙文海中国水利水电科学研究院水利研究所北京100048
鄢元波,贾燕南,丁昆仑,孙文海,赵 翠(中国水利水电科学研究院水利研究所,北京 100048)
臭氧消毒因其具有不增加水的嗅和味、效率高、设备操作简单、便于运行管理等优点而受到人们的青睐,并广泛应用于各类供水系统的消毒环节[1]。然而,由于臭氧消毒的持久性差,消毒过程中臭氧能将水中大分子有机物氧化为易被微生物利用的小分子,造成细菌在供水管网中大量生长,对饮用水生物稳定性构成潜在威胁[2,3]。因此研究和解决臭氧消毒对饮用水生物稳定性影响问题一直是水处理行业关注的焦点之一[4]。
AOC是生物可同化有机碳(Assimilable Organic Carbon)的简称,是有机物中最易被细菌吸收、直接同化成细菌体的部分,被认为是控制配水管网中细菌再生长的主要营养物质[5,6]。AOC是表征水生物稳定性的指标[3,4],饮用水中AOC与异养菌生长有良好的相关性,通常AOC在10 μg/L以下被认为是生物稳定水。管网水中AOC控制在50 μg/L以内,细菌的生长就受到限制,故美国建议标准为AOC<50~100 μg/L,我国建议的近期目标为AOC<200 μg/L,远期目标AOC<100μg/L[7]。
目前关于臭氧消毒对饮用水生物稳定性(AOC)影响的研究较多,但主要是针对城市水厂和复合工艺系统的研究,与农村小型供水工程的特点和消毒工艺等有一定差异,不具有完全代表性。该研究以村镇饮用水臭氧消毒工程为对象,选取不同来源村镇饮用水水源水,通过室内制备高浓度臭氧水进行臭氧投加试验与臭氧消毒工程现场调研相结合的形式,研究臭氧消毒对饮用水生物稳定性的影响,以期为臭氧消毒在村镇小型供水工程中的适用和生物稳定性保障措施的制定和实施提供参考。
1 材料与方法
1.1 水样的采集与保存
取样瓶处理:100 mL磨口玻璃瓶若干,先用洗涤剂洗净晾干,再用重铬酸钾洗液浸泡8 h以上,最后依次用自来水、蒸馏水、超纯水冲洗干净,121 ℃(0.1 MPa)灭菌20 min。
水样采集与保存:水样采集前先对取样口进行去污灭菌处理,即先用酒精灯灼烧(金属管材)或用酒精擦拭(塑料管材)取样口,然后打开取样口使水自流5 min后取样。取样数量均为一式3份。其中AOC水样收集于处理后的玻璃瓶中,并立即置于保温箱(4 ℃)中储存、送检。其他检测指标所需水样的采集依据《生活饮用水标准检验方法-水样的采集与保存》(GB/T 5750.2-2006)执行。
1.2 试验方法
前人研究表明,温度是影响饮用水微生物稳定性的重要因素[8-10],所以本文于6-7月微生物稳定性较差的高温季节,选取具有代表性的村镇供水工程水源水和管网水进行采样和试验。
1.2.1臭氧投加对AOC的影响试验
取湖北孝昌A地地表水源水(取自水库)和北京大兴B地地下水源水(水源井深100 m),分别投加一定量的高浓度臭氧水(采用循环混合柱制备),使投加后混合液初始臭氧浓度约为0、0.3、0.6 mg/L,反应30 min后加入适量硫代硫酸钠中和剩余臭氧,巴氏灭菌。然后加入适量营养盐进行AOC检测。水样的部分水质指标检测结果见表1。
1.2.2臭氧投加对TOC的影响试验
取北京大兴B地地下水源水和北京密云C地地下水源水(水源井深128 m,水样的部分水质指标检测结果见表1),分别投加一定量的高浓度臭氧水,使混合液臭氧初始浓度约为0、0.15、0.3、0.45、0.6 mg/L,反应30 min后进行TOC测定。
1.2.3村镇饮用水臭氧消毒工程管网AOC的变化
以北京市怀柔区两处村镇饮用水臭氧消毒供水工程为研究对象,其中:D村供水工程水源类型为地下水,水源井位于村中心,井深100 m;E镇水源类型为地下水,水源井位于镇外约500 m处,井深300 m。两处工程的臭氧投加量均约为0.3~0.4 mg/L。分别采集两处工程的水源水、出厂水和管网末梢水进行AOC等指标测定。具体采样点布设情况为:D村供水工程取样点3个,分别为地下水源水,供水管网10 m处用户水(以出厂水作为起点,下同),供水管网500 m处用户水。E镇供水工程取样点3个,分别为清水池出水(未投加臭氧),高压供水管网200 m处用户水,高压供水管网2 000 m处用户水。水样的部分水质指标检测结果见表1。

表1 水质检测结果Tab.1 The test results of water quality test results
注:原水-未投加臭氧的水源水。
1.3 测试方法
AOC测试方法[11]:取待测水样40 mL,经70 ℃、30 min水浴巴氏消毒后冷却至室温,接种荧光假单胞菌P17 (fluorescent pseudomonas),在22~25 ℃下培养2d,取培养液进行平板计数,计算水样中的AOC-P17浓度;然后再次对水样进行巴氏消毒,接种NOX(spirillum)作为测试菌种,在22~25 ℃下培养3 d,再对培养液进行平板计数,计算水样中的AOC-NOX浓度;AOC-P17与AOC-NOX之和即为所测水样AOC含量。
臭氧浓度测定方法:采用便携式多参数比色计(DR900,美国)检测水中臭氧浓度。
TOC测定方法:采用TOC分析仪(multi N/C 3100,德国)测定。
其他指标的测定方法参照《生活饮用水标准检验方法》(GB/T5750-2006)执行。
2 试验结果与讨论
2.1 饮用水水源水投加臭氧后AOC的变化
A地地表水源水和B地地下水源水及其投加不同量臭氧后AOC的变化结果如图1所示。由图1可知,A地地表水源水的AOC为85 μg/L,属于生物不稳定水;投加臭氧水后,当水中臭氧初始浓度为0.3 mg/L时,AOC增至146 μg/L,增加了117%,水体不稳定性增强;当水中臭氧初始浓度为0.6 mg/L时,AOC显著增长至324 μg/L,约为原水的3.8倍,已超出目前我国建议控制标准。B地地下水源水AOC为68 μg/L,属于生物不稳定水;投加臭氧后AOC下降为0,水体达到生物稳定水平。A地地表水源水和B地地下水源水投加臭氧后水中AOC变化显著,表明臭氧消毒对饮用水的生物稳定性有较大影响。
A地地表水源水投加臭氧后,水中AOC显著增大,这与国外学者研究的结论[12]一致,这是由于臭氧与水中带不饱和键的有机物发生氧化反应,生成醛、酮、醇、羧酸等中间产物,这些易降解的小分子物质为P17和NOX菌提供了丰富的营养物,造成AOC值升高[13,14];投加臭氧水后,臭氧初始浓度为0.3 mg/L时,单位臭氧的AOC增量明显较0.6 mg/L时小,这是由于水中臭氧间接氧化大分子有机物为生物可利用小分子有机物涉及多个中间环节[2,15,16],当水中臭氧量较少时,氧化过程在中间某一环节被迫终止,部分大分子有机物未被完全氧化至生物可利用的小分子物质,因而依旧不能被微生物利用所致。B地地下水源水投加臭氧后,AOC下降为0,这是由于地下水水质较好,TOC浓度低(见表1),O3/TOC(质量浓度比)较大,高剂量的臭氧氧化形成了抑制细菌生长的化合物,或者使细菌可以利用的化合物被直接氧化成CO2[17,18]。
李灵芝认为当水中TOC较少时,较少的臭氧量就可将有机物氧化成CO2和H2O;当水中TOC较高时,则转折点(AOC下降临界点)将往后移[13]。A地地表水源水和B地地下水源水投加臭氧后AOC的变化大相径庭,正是由于二者相异的水质条件决定的,由此说明臭氧消毒适用于水源TOC较小(≤0.48 mg/L)的村镇饮水工程。而对TOC较大的饮水工程,在保证消毒效果的前提下,合理控制臭氧投加量,能减小出厂水的生物不稳定性风险。

图1 水源水投加臭氧后AOC的变化Fig.1 The changes of AOC in source water after dosing of ozone
2.2 饮用水水源水投加臭氧后TOC的变化
A地地表水源水和C地地下水源水投加臭氧后△TOC的变化情况如图2所示。若△TOC>0,表明投加一定浓度臭氧后水中的TOC增大;若△TOC<0,投加一定浓度臭氧后水中的TOC值减小。由图2可知,当臭氧投加量为0~0.15 mg/L时,A地地表水源水与C地地下水源水的△TOC均大于0,这可能是由于水中存在颗粒悬浮物,大分子有机物与颗粒物表面的化学物质结合形成颗粒态有机物,水样静置后颗粒物附着于容器壁或相互间通过有机物的管能团连接团聚形成大颗粒物,而测试过程中受水样进样器针孔和进样量的限制(0.3 mL),测定结果往往不包括全部颗粒态有机碳。当投加臭氧后,臭氧作用于大分子,使其断键形成小分子并与颗粒物分离溶于水中,从而致使TOC测试结果升高。当臭氧投加量为0.15~0.3 mg/L时,A地地表水中△TOC几乎无变化,这与朱晓超等[5]的研究结论一致,该阶段主要为臭氧氧化水中大分子有机物为小分子有机物的过程,故臭氧投加量增加,TOC不再继续升高。当A地水中臭氧投加量为0.3~0.6 mg/L时,B地水中臭氧投加量为0.15~0.6 mg/L时,二者的△TOC均随着臭氧投加量的增加而减小,且A的减小趋势较B明显。此过程中,二者的△TOC均由大于0降低至0以下,这说明臭氧不仅能氧化大分子有机物为小分子,同时也可以氧化有机物为无机物,使得TOC下降。
臭氧投加量为0.3 mg/L时,A地地表水的△TOC>0,表明水中TOC增大。同样条件下,2.1中A地水中AOC也增大,说明臭氧投加浓度较低(0.3 mg/L)时,水中臭氧主要以间接反应为主,即氧化大分子有机物为小分子有机物,增加水中有机物的生物可利用性,使AOC增加。当臭氧投加量为0.6 mg/L时,A地水中TOC减小,而2.1中A地水AOC继续增大,说明此过程间接反应与直接反应同时发生,即一部分大分子被氧化为小分子的同时部分小分子被继续氧化为CO2。由此可见,臭氧消毒后,水中TOC和AOC的变化并不一致,因此对于TOC较高的饮用水源水,仅通过投加臭氧氧化水中有机物,以期降低水体TOC和AOC,达到保障饮用水生物稳定性的目的不现实,应该通过合理控制臭氧投加量或组合其他工艺处理后再供水。
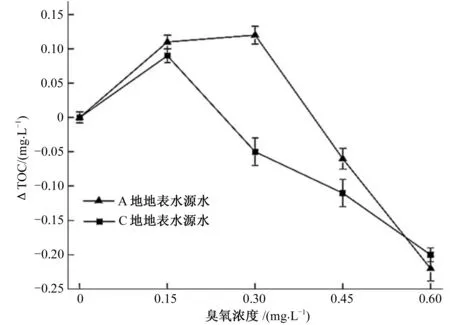
图2 水源水投加臭氧后TOC的变化Fig.2 The changes of TOC in source water after dosing of ozone 注:△TOC-投加臭氧后,水中TOC的值减去原水TOC的值。
2.3 村镇饮用水臭氧消毒工程管网中AOC的变化
D村和E镇饮用水臭氧消毒工程水源水和管网中AOC和TOC的检测结果如图3所示。由图3可知,D村饮水工程原水(D-1)AOC为43 μg/L,属于不稳定性水,但因AOC<50 μg/L,水体微生物生长可能受抑制;投加臭氧后供水管网10 m处(D-2)AOC为94 μg/L,与原水相比增加了约118%,水的生物不稳定性显著增加;供水管网500 m处(D-3)AOC为48 μg/L,较D-2处下降了约49%,水的生物不稳定性减弱,再次成为生物抑制型水。E镇饮水工程原水(E-1)AOC为82 μg/L,属于生物不稳定性水;投加臭氧后高压供水管网200 m处(E-2)AOC为55 μg/L,仅为原水的67%,水的不稳定性减弱;随着管网的延伸,在高压供水管网 2 000 m处(E-3)AOC降为37 μg/L,为生物不稳定水。D村和E镇供水工程水源水和管网水中AOC处于37~94 μg/L之间,均属于生物不稳定水,但远低于我国近期建议控制标准值。D-1中 AOC/TOC比值(质量浓度比,下同)为0.06,说明D村水源水中有机物主要以大分子形式存在,微生物可利用性差,经臭氧消毒后,D-2中AOC显著增加,这与2.1中A地地表水源水投加臭氧后AOC的变化情况类似,说明原水TOC较大(0.68 mg/L)时,臭氧投加会导致水中AOC增大,水的生物不稳定性增加。D-3中AOC减小则可能是由于管网末端水流动性较差,微生物繁殖消耗部分生物可降解有机碳所致[19,20]。E-1中AOC/TOC比值为0.36,微生物可利用性比D村强,经臭氧消毒后,AOC值降低至55 μg/L(E-2),这与2.1中C地地下水源水投加臭氧后AOC的变化情况类似,说明原水TOC较小(0.23 mg/L)时,臭氧投加会导致水中AOC降低,水的生物不稳定性减弱。其中,E-2处AOC显著减小,是因为原水TOC较低,水厂投加臭氧后,一部分有机物被矿化为CO2,致使AOC下降[13]。至E-3处AOC继续减小,则可能是管网中微生物繁殖消耗部分生物可降解有机碳所致[19,20]。
如图3所示,D村水源水臭氧消毒后,TOC先减小后在管网末梢处增大,与AOC的变化规律不同;E镇水源水臭氧消毒后,TOC随管网延伸持续减小,与AOC的变化规律相同。D村和E镇供水工程投加臭氧后管网水中AOC、TOC的不同变化规律主要是原水水质的不同造成的。D村水源井较浅,原水TOC值较高,AOC/TOC值较低,水中有机物主要以大分子形式存在,而E村水源井相对较深,原水TOC值相对较低,AOC/TOC相对值高,水中有机小分子所占比例较高,投加臭氧后有机物更易被氧化。因此,相对于D村,E镇水源水质更好,更适宜采用臭氧消毒。由此说明,确保良好的原水水质对于保障臭氧消毒供水工程饮用水生物稳定性非常重要。

D-1为地下水源水,D-2为供水管网10 m处用户水(计出厂水端点为起点,下同),D-3为供水管网500 m处用户水;E-1为清水池出水(未投加臭氧),E-2为高压供水管网200 m处用户水,E-3为高压供水管网2 000 m处用户水。图3 村镇饮用水臭氧消毒工程中AOC和TOC的变化Fig.3 The changes of AOC and TOC in rural drinking water supply
3 结 语
(1)TOC较大(2.06 mg/L)的水源水投加臭氧后,AOC随着臭氧投加量的增大而升高,水的微生物稳定性降低;TOC较小(0.48 mg/L)的水源水,投加臭氧后AOC减小,水的生物稳定性增加,表明臭氧消毒适用于TOC较低(≤0.48 mg/L)的水源水,而对于TOC较大的水源水,在保证消毒效果的前提下,应该合理控制臭氧投加量,防止AOC的增长。
(2)水源水投加臭氧后,当投加量较低时,可氧化水中大分子有机物为小分子有机物,使TOC增加或不变;当臭氧投加量较高时,可氧化有机物为无机物使TOC减小,其分界点受臭氧投加量和水源水质(TOC含量)制约。臭氧投加后,水中TOC和AOC的变化并不一致,因此对于TOC较高(或水质较差)的水源水,应通过合理控制臭氧投加量或组合其他工艺处理后供水,以保证供水管网中水体的生物稳定性。
(3)本研究中的村镇供水工程采用臭氧消毒后管网中AOC出现较大变化,全部属于生物不稳定性水(>10 μg/L),但低于我国近期建议控制标准(100 μg/L)。水源水质较好时,臭氧消毒后管网中AOC值减小,微生物稳定性增强,因此为保证消毒后水体的生物稳定性,应尽可能地提高原水水质。
□
[1] 靳俊伟, 林 衍,李 东. 臭氧消毒现状与发展[J].四川环境, 2004,23(1):18-20.
[2] Christriane G, Martin J, Anja K. 水和废水臭氧氧化-臭氧及其应用指南[M]. 李凤亭, 张冰如, 张善发, 译. 北京:中国建筑工业出版社, 2004.
[3] 刘汝鹏, 曲 莹, 王新伟, 等. 饮用水水质生物稳定性及其控制措施[J]. 城镇供水, 2011,(4):44-47.
[4] 方 华, 吕锡武, 乐林生, 等. 饮用水生物稳定性的研究进展与评述[J].净水技术, 2004,(5):15-18.
[5] 朱晓超, 吕锡武, 付 军, 等. 臭氧消毒对饮用水中微生物生长的影响[J]. 供水技术, 2007,1(1):24-27.
[6] 王继萍, 华 伟, 蒋福春, 等. 臭氧-生物活性炭工艺去除AOC和有机物的效果研究[J].给水排水, 2014,40(2):11-15.
[7] 余国忠, 王根凤, 龙小庆, 等. 给水管网的细菌生长可能机制与防治对策[J]. 中国给水排水, 2000,16(6):18-20.
[8] Silhan J, Corfitzen C B, Albrechtsen H J. Effect of temperature and pipe material on biofilm formation and survival of Escherichia coli in used drinking water pipes: a laboratory-based study[J]. Water Sci Technol, 2006,54(3):49-56.
[9] 马 颖, 龙腾锐, 方振东. 饮用水生物稳定性的评价体系[J]. 中国给水排水, 2004,20(12):96-98.
[10] 吴 卿, 赵新华. 饮用水细菌总数及相关指标关系[J].中国公共卫生, 2006,22(3):280-281.
[11] 刘文君, 王亚娟, 张丽萍, 等. 饮用水中可同化有机碳(AOC)的测定方法研究[J].给水排水, 2000,26(11):1-6.
[12] Hacker P A, Paszko-Kolva C, Stewart MH, et al. Production and removal of assimilable organic carbon under pilot-plant conditions through theuse of ozone Peroxone[J]. Science and Engineering,1994,16(3):197-212.
[13] 李灵芝, 李建渠, 王占生. 不同消毒剂对饮用水中可同化有机碳的影响[J].环境污染与防治, 2005,27(6):457-459.
[14] 张淑琪, 刘彦竹, 胡江泳, 等. 臭氧氧化自来水生物稳定性研究[J]. 环境科学, 1998,(5):34-37.
[15] 王华然, 尹 静. 饮用水生物稳定性研究进展[J].环境与健康杂志, 2009,26(4):367-370.
[16] 赵新华, 吴 卿, 尤作亮. 配水管网饮用水微生物学水质研究[J]. 天津大学学报, 2005,38(5):410-414.
[17] 吴红伟, 刘文君, 王占生. 臭氧组合工艺去除饮用水源水中有机物的效果[J]. 环境科学, 2000,21:29-33.
[18] Vahala R, Ala-Peijari T. Rintala J.Laukkanen R, et al. Evaluating ozone dose for AOC removal in two-step Gac filters[J]. Water Science & Technology, 1998,39(9):13-120.
[19] Lechevrallier M W, Schulz W, Lee R G. Bacterial nutrients in drinkingwater[J]. Applied Environmental Microbiology, 1991,57(3):85-73.
[20] Kooij V, Visser A, Hijnen W A M. Determining the concentration of easily assimilable organic carbon in drinking Water[J]. Journal (American Water Works Association), 1982,74(10):540.
