PCR方法在抗虫转基因水稻外源基因漂移风险研究中的应用
2016-03-21张富丽常丽娟刘文娟
张富丽,牛 蓓,常丽娟,宋 君,王 东,尹 全, 刘文娟
(1.四川省农业科学院分析测试中心,四川 成都 610066;2.成都大学医学院,四川 成都 610106)
PCR方法在抗虫转基因水稻外源基因漂移风险研究中的应用
张富丽1,牛 蓓2*,常丽娟1,宋 君1,王 东1,尹 全1, 刘文娟1
(1.四川省农业科学院分析测试中心,四川 成都 610066;2.成都大学医学院,四川 成都 610106)
本试验以抗虫转基因水稻华恢1号为研究对象,将几种非转基因常规栽培水稻种植在其周围,采用PCR检测方法对不同距离收集的F1代水稻种子进行转基因杂种鉴定,统计并分析外源基因漂移的频率,评估无标记基因抗虫水稻基因漂移风险。结果显示,外源bt基因向P13381和春江063水稻平均漂移频率皆为零。而抗虫转基因水稻华恢1号与非转基因水稻合系22-2、天香、明恢63、P1157几个品种不同程度地发生了转基因漂移,平均漂移频率最高为0.88 %,并且漂移频率随着距离加大而逐渐降低,在7 m 以外的所有采样点平均转基因漂移频率为零。采用合理田间布局、物理隔离、保持合适距离,以及科学安排农时、错开花期等方式,可有效减小转基因水稻外源基因漂移风险。本试验表明,采用PCR法可以准确地进行转基因杂种的鉴定,但缺点是工作量很大,耗时较长,需进一步寻求更简便高效的方法用于检测无标记基因的转基因漂移频率。
转基因水稻;抗虫性;基因漂移;环境安全;PCR方法
2014年全球转基因种植面积已达到18.15亿公顷,相比1996年转基因作物商业化之初增加了100倍[1]。转基因生物技术的快速发展和转基因作物的不断培育,为全球粮食安全保障带来了新的契机的同时,转基因作物潜在的生物安全问题也成为各界的关注焦点之一[2-3]。许多国家和地区已经颁布实施了一系列法律法规强化转基因产品的安全管理和标识管理。环境影响评价是评估转基因植物生物安全性的重要内容,而转基因植物中外源基因向非转基因常规栽培稻漂移的频率是评价其对环境影响的重要方面,因此,基因漂移是转基因作物商品化生产前环境安全评价的重要内容之一。
水稻是重要的粮食作物,在解决全球粮食安全问题中担当重要角色。通过转基因手段提高产量、优化性状的相关研究越来越多,已成功培育出多个转基因水稻品种[4]。其中转Bt和CpTI基因的抗虫、转Xa21基因抗病和转bar,EPSPs基因抗除草剂是几种主要改良的目的性状,其节省农业生产成本、减少农药化肥对环境污染等特性将产生巨大经济和环境效益,转基因水稻大规模环境释放和商品化生产在未来势不可挡。目前转基因水稻在全球仅在伊朗等少数地方进行商品化种植[5],虽然无数据显示转基因水稻的商业化释放对环境造成显著影响,但转基因水稻环境安全相关的研究在国内外已作为重要课题全面开展。薛大伟等[6]研究表明,转bar基因抗除草剂水稻外源基因可能漂移到普通野生稻,但不易漂移到药用野生稻和疣粒野生稻。戎俊等[5]研究发现双价(Bt/CpTI基因)抗虫转基因水稻品系及其相应的非转基因水稻亲本品种在相邻种植条件下,外源基因具有向非转基因水稻亲本品种发生漂移的可能性,但频率较低。Jia等[7]的研究亦表明,转bar基因抗除草剂粳稻近距离(0 m)向不育系发生基因漂移的频率可以达到很高(36.116 %),而向杂交水稻发生基因漂移的频率却很低,不超过0.045 %。研究表明水稻花粉受体的异交率是决定基因漂移频率的重要因素[8],不同品种的水稻间具有不同的异交率[9-10],从而不同水稻品种间发生基因漂移的概率也可能不同。对各水稻品种进行具体而深入的研究,以此来制定相应的转基因水稻生物安全监测和管理措施更科学有效。我国农业部已批准转cry1Ab/cry1Ac基因抗虫水稻华恢1号和Bt汕优63在湖北省生产应用的安全证书,这预示着转基因水稻在我国商品化进程更进一步了。近年来对该抗虫转基因水稻环境安全的研究多集中于对土壤[ 11-12]、微生物群落[13]及其他生物群落[ 14-18]的影响研究,对其外源基因漂移的文献报道较少。目前,基因漂移研究通常以抗药性或潮霉素筛查和表型鉴定为基础[4, 19-21]。然而这些方法不适于抗虫水稻华恢1号基因漂移频率的检测。抗虫转基因水稻华恢1号外源基因在转入受体后标记基因hpt即被敲除了,不能采用潮霉素抗性筛选的方法来鉴定筛选。而针对外源基因的分子检测方法能有效解决无标记外源基因检测的问题,可准确检测的漂移频率[22-23]。目前,PCR法是分子检测工作中最常用的可靠检测方法。因此,本试验以华恢1号为研究对象,通过采用PCR方法检测F1代种子的杂交率,研究抗虫转基因水稻在田间生产的自然条件下外源基因向非转基因常规栽培水稻漂移的可能性及其频率,以初步估计防止基因漂移发生的安全距离,以期为转基因水稻外源基因漂移的防控和监管提供数据支持,同时为常规栽培稻生产的保护提供科学依据。
1 材料与方法
1.1 供试材料
抗虫转基因水稻华恢1号(HUAHUI-1),由农业部转基因植物环境安全监督检验测试中心(杭州)提供。该材料外源抗性基因为Bt(cry1Ab/Ac)融合基因,转化事件为TT51-1,系华中农业大学和国际水稻所共同培育的高抗鳞翅目害虫转基因水稻品系。
6个非转基因水稻品系:春江063 (Chunjiang 063),系常规粳稻晚熟品种,由农业部转基因植物环境安全监督检验测试中心(杭州)提供;合系22-2 (Hexi 22-2),系常规旱作粳稻品种,由四川省华龙种业有限公司提供;天香 (Tianxiang),系籼型杂交水稻品种,由四川天宇种业有限公司提供;明恢63 (Minghui 63),系籼稻恢复系,由江苏省农业科学院提供;P13381和P1157均为四川省农业科学院作物所培育,其中P13381为早熟籼稻杂交水稻,P1157为常规粳稻,两者均为水稻新品种,为保护商业机密,文中均以代号称之。
1.2 试验方法
1.2.1 供试材料的鉴定 在田间试验开始之前,依据标准农业部953号公告-6-2007[24]及农业部1193号公告-3-2009方法[25],采用PCR检测方法对供试的抗虫转基因及非转基因水稻进行分子鉴定。从转基因材料 “华恢1号”中扩增到外源Bt基因和转化体TT51-1特异性条带,其他水稻品系中不能扩增到目的条带,确定供试材料转基因及非转基因的真实性。所用引物序列见表1,由上海生工(上海)合成。采用植物基因组提取试剂盒(天根生化科技(北京)有限公司)提取供试水稻种子中基因组DNA。超微量紫外分光光度计ND-1000 (NanoDrop Technologies, Inc, USA)检测核酸浓度和纯度,并稀释至25 ng/μl,取2 μl作为模板,在25 μl 含1× QuickTaq®HS DyeMix试剂(Toyobo Co., Ltd.,日本), 0.4 μM 各引物的反应体系中进行PCR扩增。扩增产物用2 %琼脂糖胶进行电泳分析。
1.2.2 田间试验设计和取样 试验于四川省农科院分析测试中心温江转基因植物环境安全试验基地进行。该基地四周建有3 m 高的围墙,围墙外面为果园及林地。土壤为沙壤土,肥力良好,排灌情况良好,0 ~ 20 cm 土层有机质含量1.87 g·kg-1,全氮0. 8 g·kg-1, 速效磷9.7 mg·kg-1,速效钾176.9mg·kg-1,pH 6.2 ~6.9。在基地内选择一块平整、肥力均匀的田块,约为660 m2。田间布局如图1,将抗虫转基因水稻华恢1号种植于试验田块中央,种植面积为25 m2(5 m × 5 m),6种非转基因水稻分别种植1 m×10 m,等宽随机排列于转基因水稻的四周,以避免试验地微环境不同可能导致的位置效应。田间其余空地及周边种植当地常规水稻品种以作试验保护带。将供试种子浸种、消毒、催芽后,培苗30 d,取选择大小一致、生长健壮的幼苗按试验设计移栽到相应区块中。种植株距和行距均为 0.2 m。按照常规方法进行田间水肥管理。水稻成熟后,采集非转基因水稻F1代种子样本。采集点从距离转基因水稻“华恢1号” 0 m 处(相邻点)开始,每1 m 收取10 株为1个样本,最远取样距离为10 m。分别按不同方向、不同距离保存收集样本,供后期检测用。
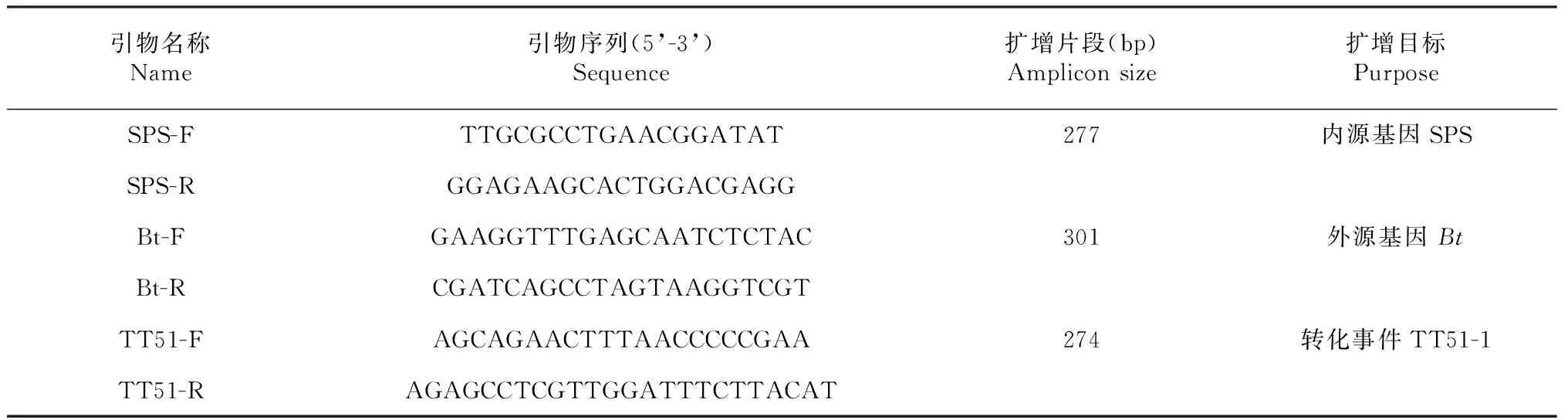
表1 PCR检测所用的引物
试验基地按照国家对转基因材料环境安全有关管理条例规定进行围墙和相应隔离设施设置,并在试验后将所有试验材料进行焚烧灭活处理。
1.2.3 非转基因水稻F1代种子发芽率及分子鉴定 将收获的F1代种子进行风干处理,并在干燥的条件下保存3个月以上,以打破种子休眠。将各个点收集的种子催芽至露白后,随机选取 200 粒种子,均匀摆放在Φ12 cm 的培养皿中,37 ℃恒温培养。调查各点样本的发芽率。待长出幼苗后,采用植物基因组提取试剂盒(天根生化科技(北京)有限公司)分别提取幼苗叶片基因组DNA。以提取到的DNA为模板,依据标准农业部953号公告-6-2007[25]通过PCR技术检测外源Bt基因,扩增产物用2.0 %琼脂糖进行电泳分析。

图1 田间布置Fig.1 Field arrangement
1.2.4 数据处理及统计分析 如DNA模板中能扩增到目标带,表明供试基因组DNA中带有外源Bt基因,也即外源基因从转基因水稻向非转基因水稻发生了漂移。将能扩增出目标条带的种子鉴定为转基因杂种。统计转基因杂种的数量,计算外源基因漂移频率。本试验中以检测到外源Bt基因片段的F1代幼苗数占检测总苗数的百分比除以发芽率作为外源基因的漂移频率,也即抗虫转基因的漂移频率=(转基因杂种数量/检测总苗数×100 %)÷发芽率。4个方位同一距离采样点样本作为 4 个重复,外源基因对各个品种水稻的漂移频率取相同距离4个点漂移频率的平均值。
2 结果与分析
2.1 供试材料真实性鉴定
分别采用SPS、Bt、TT51 3对引物对抗虫转基因材料华恢1号种子基因组DNA进行PCR扩增,结果如图2所示,3 对引物均能从DNA模板中扩增到特异性目标带,从而可以确定本试验所用的抗虫转基因材料是华恢1号真实种子。而从其余几种非转基因水稻材料中,仅能扩增到SPS内源基因,不能扩增到Bt、TT51的目标片段。
2.2 外源Bt基因的漂移频率
采用常规定性PCR技术对各点收集的F1代水稻种子进行转基因杂种鉴定,通过统计各采集点转基因杂种的数量,计算各点外源基因漂移到常规水稻的频率,结果见表2。在P13381和春江063水稻所有种子中均未检测到外源Bt基因的特异性目的条带,基因漂移频率判为零。而在合系22-2、天香、P1157、明恢63几种水稻F1代种子中检测到外源Bt基因,说明转基因水稻华恢1号与合系22-2、天香、明恢63、P1157几个非转基因水稻品种之间发生了基因杂交,且外源Bt基因向非转基因水稻发生漂移。结果还表明F1代中含有外源基因的水稻幼苗株数多少与距离转基因水稻远近有关。距离越远,阳性杂交率越低。漂移频率最高为0.88 %,发生在天香、明恢63与转基因材料相邻(0 m)的采集点。平均漂移频率随着距离加大逐渐降低,在距离转基因材料7 m 以外的采样点F1代种子中没有检测到Bt外源基因,平均转基因漂移频率为零。据初步分析,春江063为晚熟品种,其扬花时间比华恢1号晚20 d 左右,而P13381为早熟品种,其扬花时间比其他水稻都早15 d 左右,可能因花期不遇,阻断了通过花粉传播与转基因水稻发生基因交流的可能,从而在本实验中春江063和P13381 两种水稻F1代植株中均未检测到基因漂移的发生。而其他4 种水稻花期均与转基因水稻华恢1号一致,具有通过花粉传播与转基因水稻发生基因交流的可能,而且距离越短,发生基因漂移的频率越高。

表2 转基因抗虫水稻外源基因向非转基因水稻漂移的频率

M:2000 bp DNA ladder图2 供试水稻材料鉴定的电泳图谱Fig.2 Electrophoresis pattern of identification of the supplied materials
3 讨 论
本实验表明,采用PCR法用于转基因杂种的鉴定,简单易行,且准确性高,但明显的缺点是工作量很大,耗时较长。因此,对于无法利用标记基因或抗药性进行筛选的转基因作物外源基因自然杂交率的研究,还需要寻求一种更简单快速的方法。
从试验可以看出,抗虫水稻外源基因具有一定逃逸的风险,但基因漂移频率非常低。本研究中外源Bt基因向其它几种非转基因常规栽培品种基因漂移不超过0.88 %,其对生态环境的潜在风险很小。试验中转基因和非转基因植株间的最短距离仅 20 cm,在这种极端条件下的转基因漂移频率不超过1 %,那么通常田间栽培情况下发生的基因漂移概率会更低。该结果肯定了Stewart等人[26]认为水稻是一种低风险作物的说法。
本试验选择常规粳稻栽培品种和籼稻杂交水稻品种作为受体供试材料,结果表明在花期相遇的情况下,转基因水稻中外源基因是可能逃逸到非转基因常规水稻中的,但漂移频率较低,且距离转基因花粉源的越远,外源基因漂移的频率越低,这与Song等人[27]的研究结果是基本一致的。也即距离转基因花粉源越远,空气中携带外源基因的花粉密度就越低,加上周围非转基因水稻的干扰,大大降低了转基因的漂移频率。本试验中,即使在可能有基因交流的 2 个品种间,在7 m 以外采样点的F1代种子中皆未检测到Bt外源基因,这有力地证实了距离隔离可以有效地降低转基因水稻向非转基因水稻的基因漂移频率。结果还表明,春江063和P13381 2种水稻与转基因水稻华恢1号之间因花期不遇没有发生基因漂移。综合分析可看出,田间合理布局、物理隔离、保持合适距离,以及科学安排农时,错开花期等方式,能有效控制转基因水稻外源基因漂移,降低转基因逃逸带来的生态风险。然而,转基因植物与非转基因植物之间的基因交流影响因子很多,很复杂,需要进行长时期的跟踪监测,积累大量的实验数据,才能得出最终结论,才可对转基因植物的环境风险进行有效的评估。因此,对抗虫转基因水稻外源Bt基因漂移及其环境风险的研究将是一个长期的过程。
[1]James C. Global Status of Commercialized Biotech/GMCrops in 2014[C]. Pocket K No.16, 2011.
[2]Ruane J, Sonnino A. Agricultural biotechnologies in developing countries and their possible contribution to food security[J]. Journal of Biotechnology, 2014, 156:356-363.
[3]Aleksejeva I. Experts' attitude towards use of GMO in food and feed and other industries EU[J]. Procedia-Social and Behavioral Sciences, 2014,110:494-501.
[4]Huang J K, Rozelle S, Pray C, et al. Plant biotechnology in China[J]. Science, 2002, 295:674-677.
[5]戎 俊,宋志平,苏 军,等.Bt/CpTI转基因稻及其非转基因亲本对照在间隔种植条件下的转基因漂移[J]. 生物多样性, 2006, 14(4):309-314.
[6]薛大伟, 马丽莲, 姜 华, 等. 抗除草剂转基因水稻的安全性评价[J]. 农业生物技术学报, 2005,13(6):723-727.
[7]Jia S R, Wang F, Shi L, et al. Transgene flow to hybrid rice and its male-sterile lines[J]. Transgenic Research, 2007, 16:491-501.
[8]Oka H I, Morishima H. Variations in the breeding systems of a wild rice(Oryzaperennis)[J]. Evolution, 1967, 21:249-258.
[9]姜大刚, 梁奕涛, 黄 靖, 等. 转基因水稻外源基因的漂移研究[J]. 生物技术通报, 2010(6):95-99.
[10]陆永良, 彭于发, 王渭霞, 等. 抗除草剂转基因水稻基因漂移至常规栽培稻的频率研究初报[J]. 中国水稻科学, 2010, 24(6):663-666.
[11]李修强, 陈法军, 刘满强, 等. 转Bt水稻对土壤可溶性有机碳氮及微生物学性质的影响[J]. 应用生态学报,2012,23(1):96-102.
[12]陈 婧, 陈法军, 刘满强, 等. 温度和CO2浓度升高下转Bt水稻种植对土壤活性碳氮和线虫群落的短期影响[J]. 生态学报,2014,34(6):1481-1489.
[13]戚 琳,陈法军,刘满强,等. 三种转Bt水稻短期种植对土壤微生物生物量和线虫群落的影响[J]. 生态学杂志, 2013,32(4):975-980.
[14]隋 贺,李志毅,徐艳博,等. 广西兴安转Bt水稻大田两迁害虫发生动态[J]. 应用生态学报, 2011, 22(11):3021-3025.
[15]祝向钰,李志毅,常 亮,等. 转Bt水稻土壤跳虫群落组成及其数量变化[J]. 生态学报, 2012, 32(11):3546-3554.
[16]李 菲,刘雨芳,孙远东,等. 泥鳅对饲料中添加转融合基因Cry1Ab/Ac水稻花粉的响[J]. 应生态学杂志, 2014,33(10):2727-2732.
[17]梁玉勇,程正新,程森弟,等.Bt水稻对褐飞虱及其二种天敌种群动态的影响[J]. 应用昆虫学报, 2014, 51(5):1163-1172.
[18]王文晶,王瑞林,于福兰,等. 转Bt水稻对捕食性天敌黑肩绿盲蝽种群动态的影响[J]. 应用昆虫学报, 2014, 51(5):1173-1183.
[19]刘 琦,李希臣,刘昭军,等. 抗草甘膦转基因大豆基因漂移的研究Ι大豆风媒介传粉的基因漂移研究[J]. 黑龙江农业科学, 2008(9):14-16.
[20]路兴波,孙红炜,杨崇良,等. 转基因玉米外源基因通过花粉漂移的频率和距离[J]. 生态学报, 2005, 25(9):2450-2453.
[21]任江萍,李 磊,尹 钧. 转基因小麦向其近缘野生种基因漂移的研究[J]. 河南农业科学, 2009(1):28-30.
[22]Messeguer J, Fogher C, Guiderdoni E, et al. Field assessments of gene flow from transgenic to cultivated rice (OryzasativaL.) using a herbicides resistance gene as tracer marker[J]. Theoretical and Applied Genetics, 2001, 103:1151-1159.
[23]Messeguer J, Marfa V, Catala M M, et al. A field study of pollen-mediated gene flow from Mediterranean GM rice to conventional rice and the red rice weed[J]. Molecular Breeding, 2004, 13:103-112.
[24]农业部科技发展中心,中国农业科学院生物技术研究所,上海交通大学,等. 农业部953号公告-6-2007,转基因植物及其产品成分检测 抗虫转Bt基因水稻定性PCR方法[M]. 北京:中国农业出版社, 2007:1-6.
[25]农业部科技发展中心,中国农业科学院油料作物研究所,中国检验检疫研究院食品安全研究所,等. 农业部1193号公告-3-2009, 转基因植物及其产品成分检测 抗虫水稻TT51-1及其衍生品种定性PCR方法[M]. 北京:中国农业出版社, 2009:1-6.
[26]Stewart C N, Halfhill M D, Warwick S I. Transgene introgression from genetically modified crops to their wild relatives[J]. Nature Reviews Genetics, 2003(4):806-817.
[27]Song Z P, Lu B R, Chen J K. Pollen flow of cultivated rice measured under experimental conditions[J]. Biodiversity and Conservation, 2004,13:579-590.
(责任编辑 陈 虹)
PCR Detection Method for Assessment Risk of Gene Flow from Insect-resistance Transgenic Rice
ZHANG Fu-li1, NIU Bei2*, CHANG Li-juan1, SONG Jun1, WANG Dong1, YIN Quan1, LIU Wen-juan1
(1.Analysis and Determination Center, Sichuan Academy of Agricultural Sciences, Sichuan Chengdu 610066, China; 2. Medical College, Chengdu University, Sichuan Chengdu 610106, China)
In this paper, the genetically modified rice HUAHUI-1 was used as test material which was planted around by some non-transgenic rice cultivars, their F1seeds from the HUAHUI-1 were collected at different distance, and their hybrid seedlings with foreignBtgene were identified by PCR technique. The frequency of gene flow from insect-resistance transgenic rice to conventional rice varieties at each sampling site was count and analyzed. The results showed that the frequency ofBtgene flow to P13381 and Chunjiang063 were zero. And the foreignBtgene would flowed more or less to the HEXI22-2, TIANXIANG, MINGHUI63 and P1157, the mean value of frequency was no more than 0.88 % and dropped gradually with the distance increasing until it were zero at sampling point 7 m far away. Those useful measures, such as rational field arrangement, suitable distance for physical segregation, scientific farming planning to avoid flowering at the same time, could control effectively and prevent the foreign gene of transgenic rice flowing away, and then lower the ecological risks from foreign gene escaping. The results indicated that PCR method could detect the hybrid strains accurately, but it would take a long time and had a heavy workload. More simple and efficient methods would be explored to evaluate the flow frequency of those transgenic plants without marker gene.
Transgenic rice; Insect-resistance; Gene flow; Environmental safety; PCR detection method
1001-4829(2016)10-2269-06
10.16213/j.cnki.scjas.2016.10.003
2015-11-10
四川省财政创新能力提升工程项目(2014LWJJ-011,2016LWJJ-010,2016GYSH-032)
张富丽(1978-),女,四川大竹人,副研究员,主要研究转基因植物环境影响评价,*为通讯作者:牛 蓓(1974-),女,四川成都人,副教授,生物化学与生物技术相关研究,E-mail:anne4935@qq.com。
S511
A
