无金属参与的氧原子邻位C( sp3)—S键的构筑
2016-03-21鄢东童孟良
鄢东,童孟良
(湖南化工职业技术学院,株洲412004)
无金属参与的氧原子邻位C( sp3)—S键的构筑
鄢东,童孟良
(湖南化工职业技术学院,株洲412004)
摘要以二叔丁基过氧化物( DTBP)为氧化剂,苯硫酚为硫化试剂,在无金属参与的条件下,于120℃下采用一步法合成了硫代苄醚.这种构筑C( sp3)—S键的方法具有高原子经济性和高选择性的优点,并以较高的收率获得了一系列目标化合物.
关键词无金属参与;碳氢活化;硫化;硫代苄醚
近年来,交叉脱氢偶联反应备受关注[1~3].交叉脱氢偶联反应作为碳氢官能团化反应的一种重要途径,通过氧化断裂C—H键,可直接引入各种官能团构建C—C,C—O和C—N键等,不需要使用官能团化的原料底物.交叉脱氢偶联反应不仅具有理想的原子及步骤经济性,而且环境友好.交叉脱氢偶联反应按机理可分为金属参与的、无金属参与的及光催化的偶联等.金属离子特别是重金属离子对土壤和水源都会造成污染,因此发展高效的无金属试剂参与的交叉脱氢偶联反应具有重要意义.近年来,对无金属参与的交叉脱氢偶联反应的研究主要集中在以四氢异喹啉和酰胺类化合物为代表的氮原子邻位C( sp3)—H键的官能团化方面[4~7],而氧原子邻位的C( sp3)—H键的官能团化反应研究相对较少.Wang等[8]以叔丁基过氧化氢( TBHP)作为氧化剂,实现了苯并噁唑和苯并噻唑的C2与醇或醚α-C( sp3)—H键的偶联反应,构建了C—C键.Wan等[9]以TBHP氧化醚的α-C( sp3)—H键使其乙酰化.Shi等[10]以过硫酸钾氧化醚的α-C( sp3)—H键,实现了其与吡啶的偶联反应.
在苄醚类化合物的sp3杂化C—H键的官能团化反应中,异色满是一种具有代表性的底物.异色满的C1位置通过sp3杂化C—H活化历程来构筑新的碳杂原子键的方法集中于过渡金属催化或者非金属催化反应[11~14],这些催化方法存在需要比较苛刻的反应条件或包含复杂的反应历程等缺点.交叉脱氢偶联反应具有条件温和及操作简单的优点,目前使用交叉脱氢偶联反应构筑C—S键的报道较少[15,16].C—S键广泛存在于多种重要的天然产物及药物分子中[17,18].因此,发展新型、高效且环境友好的构筑C—S键的方法十分紧迫.传统的构筑方法通常需要预活化反应物,增加了反应的步骤,反应的原子经济性不高,同时反应底物具有较大的局限性[19,20].近来,Xiang等[21]报道了一种以二叔丁基过氧化物( DTBP)作为氧化剂,在无过渡金属参与下,通过交叉脱氢偶联反应制备具有潜在生物活性的含硫化合物的新方法.基于此,本文构建了在无过渡金属参与的条件下,直接从苯硫酚出发,在苄醚的苄甲基位置构筑新的C—S键的方法体系,为含C( sp3)—S键化合物的制备提供了直接且便利的路径.
1 实验部分
1.1试剂与仪器
苄醚、芳基硫酚、二叔丁基过氧化物( DTBP)、二氯二氰基苯醌( DDQ)、过硫酸钾( K2S2O8)、叔丁基过氧化氢( TBHP,70%水溶液,质量分数)、过氧化苯甲酰( BPO)和其它试剂均为进口或国产分析纯,未经纯化直接使用;薄层层析硅胶和柱层析用硅胶(青岛海洋化工厂).
Brucker ARX 400型核磁共振波谱仪( NMR,瑞士Brucker Biospin公司) ; FD-5DX型红外光谱仪( IR,日本岛津仪器公司) ; LCQ-Advantage型质谱仪( MS,美国Thermo-Finnigan公司) ; X-5型显微熔点仪(河南予华仪器有限公司).
1.2实验过程
目标化合物3a~3m的合成路线如Scheme 1所示.

Scheme 1 Thioetherification of Isochromans
1.2.1苄醚1的合成参照文献[18,19]方法合成苄基异丙基醚、苄基苯基醚以及苯甲酸苄基酯.
1.2.2反应条件的优化在14支10 mL反应瓶中,分别依次加入苄基甲基醚( 1 mmol)、苯硫酚( 1. 5 mmol)、不同的氧化剂(氧化剂分别为DTBP,DDQ,K2S2O8,TBHP和BPO)及3 mL溶剂,搅拌下反应,用薄层色谱层析( TLC)监测反应进程.反应结束后冷却至室温,减压除去溶剂,残余物用淋洗液[V(正己烷)∶V(乙酸乙酯) = 8∶1]通过柱层析色谱进行分离.
1.2.3反应底物的适用性考察在10 mL反应瓶中,依次加入1 mmol苄醚、1. 5 mmol芳硫酚、1. 5 mmol( 219. 2 mg) DTBP及3 mL 1,4-二氧六环,于120℃搅拌反应,用TLC监测反应进程.反应结束后减压旋转蒸发除去溶剂,残余物用淋洗液[V(正己烷)∶V(乙酸乙酯) = 8∶1]通过柱层析色谱进行分离,得到纯产物3a~3m.化合物3a~3m的理化数据及波谱数据如表1和表2所示.

Table 1 Appearance,melting points,HR-MS and IR data of compounds 3a—3m

Table 21H NMR,13C NMR data of compounds 3a—3m
Continued

Compd. 1H NMR( 400 MHz,CDCl3),δ13C NMR( 100 MHz,CDCl3),δ 3f 7. 48( d,J=7. 8 Hz,2H),7. 40—7. 30( m,1H),7. 26—7. 00( m,5H),6. 45( s,1H),4. 55—4. 52( m,1H),3. 98( dd,J = 11. 4,6. 3 Hz,1H),3. 25—3. 05( m,1H),2. 65—2. 63( m,1H),2. 28( s,3H) 137. 4,134. 0,133. 9,132. 2,132. 1,129. 8,128. 9,127. 7,127. 2,126. 1,86. 4,77. 4,77. 1,76. 9,58. 2,27. 9,21. 2 3g 7. 31—7. 25( m,7H),6. 84( d,J=8. 2 Hz,2H),5. 68( s,1H),3. 82( s,3H),3. 42( s,3H) 141. 3,139. 0,134. 3,133. 2,129. 4,128. 2,127. 6,125. 2,90. 2,58. 2,56. 8 3h 7. 30—7. 29( d,J=8. 3 Hz,4H),7. 25—7. 22( m,5H),5. 80( s,1H),3. 82( s,3H),3. 38( s,3H) 138. 3,136. 0,133. 5,132. 8,132. 0,129. 3,128. 2,127. 6,126. 9,89. 2,55. 9 3i 7. 31—7. 22( m,7H),7. 08( d,J=8. 2 Hz,2H),5. 68( s,1H),3. 51( m,2H),1. 27( s,3H),1. 26( s,6H) 139. 6,138.9,133.3,131.2,130.8,129.1,128.7,126.4,87.9,78.2,23.7,21.2 3j 7. 32—7. 28( m,6H),7. 24( t,J = 7. 5 Hz,1H),6. 98( d,J = 8. 2 Hz,2H),5. 68( s,1H),3. 68( s,1H),3. 47( m,1H),1. 24( s,3H),1. 22 ( s,6H) 142. 8,138. 9,133. 3,131. 2,130. 8,128. 7,126. 4,115. 6,87. 9,75. 2,56. 0,22. 7,21. 2 3k 7. 32—7. 28( m,6H),7. 28—7. 21( m,3H),5. 68( s,1H),3. 47( m,1H),1. 24( s,3H),1. 22( s,6H) 138. 9,135. 5,133. 6,132. 2,129. 9,128. 9,128. 2,126. 4,87. 9,75. 2,21. 2 3l 7. 43—7. 31( m,5H),7. 24—7. 19( m,4H),6. 49( s,1H),4. 55—4. 53 ( m,2H),3. 20—3. 09( m,1H),2. 72( dd,J=16. 5,2. 4 Hz,1H) 136. 6,132. 9,132. 5,132. 3,132. 2,128. 1,127. 9,126. 9,126. 1,125. 2,85. 1,57. 4,25. 9 3m 7. 62( d,J=7. 8 Hz,2H),7. 41—7. 32( m,1H),7. 26—7. 00( m,5H),6. 45( s,1H),4. 55( m,1H),3. 98( dd,J=11. 4,6. 3 Hz,1H),3. 25—3. 05( m,1H),2. 65( dd,J=16. 5,2. 9 Hz,1H),2. 28( s,3H) 138. 4,136. 0,133. 5,132. 7,132. 0,129. 3,128. 2,127. 6,126. 9,126. 1,125. 2,85. 1,57. 5,25. 8
2 结果与讨论
2.1反应条件的优化
为了获得最佳的反应条件,以苄甲醚( 1a)和苯硫酚( 2a)为模板底物进行了一系列实验.首先对氧化剂进行了筛选:在120℃下,在反应体系中分别加入4 mmol的DTBP,DDQ,K2S2O8,TBHP和BPO(表3,Entries 1~5).当以K2S2O8与BPO作为氧化剂时,反应基本未进行,而添加DTBP的实验得到了较高产率.因此选择DTBP作为本反应的氧化剂,并对其用量进行了考察(表3,Entries 6~9).实验尝试降低氧化剂的用量,当DTBP的添加量从4 mmol逐渐降低到1. 5 mmol时,反应产率达到最高,而进一步降低为1. 0 mmol时,产率下降.其次考察了反应温度对产率的影响,结果表明,反应温度的提高或者降低均降低了产率,100和140℃所得收率分别为58%和67%(表3,Entries 10和11).最后,对反应溶剂进行了筛选(表3,Entries 12~14),结果表明,1,4-二氧六环作为溶剂时,反应产率优于氯
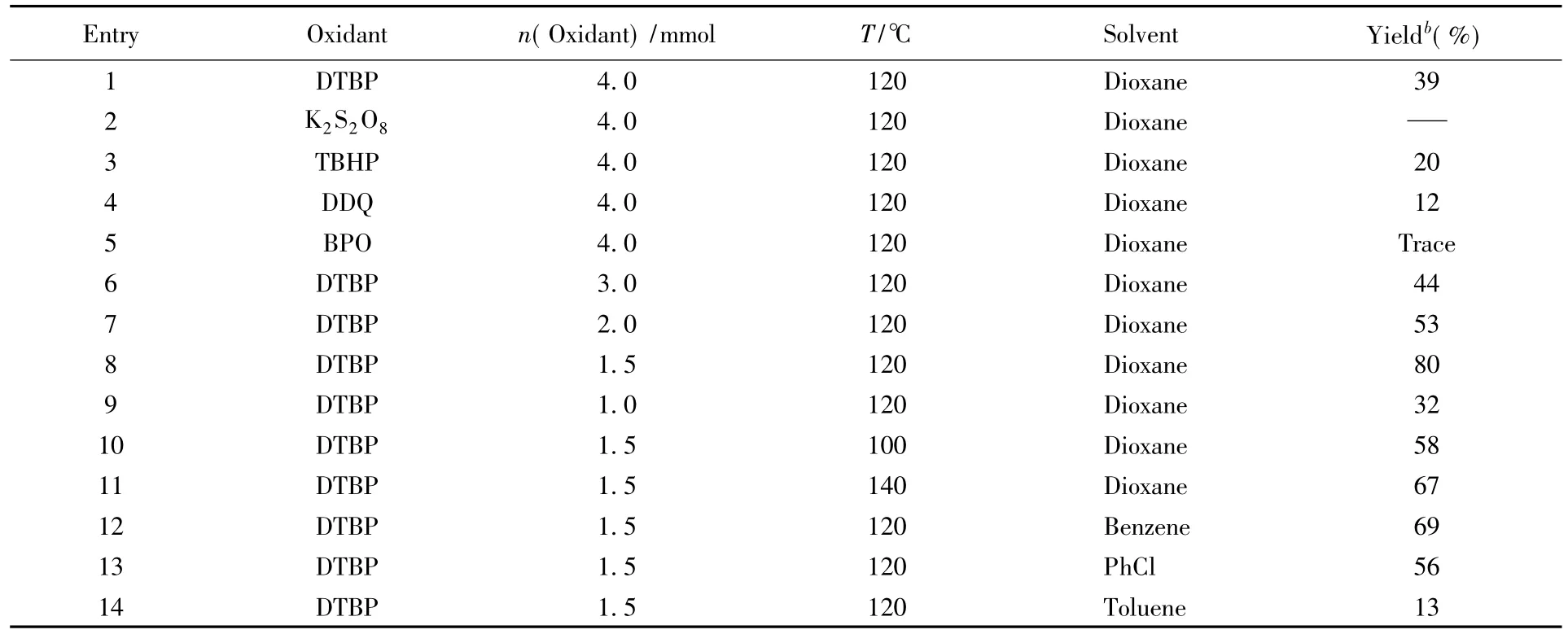
Table 3 Optimization of the reactions between thiophenol and benzyl ethera
苯和苯.综上,确定了最佳反应条件:以过氧叔丁醚( DTBP,1. 5 mmol)作为氧化剂,1,4-二氧六环作为反应溶剂,反应温度为120℃,反应时间为12 h.
2.2反应底物的适用性
根据最佳反应条件,对反应底物的适用范围进行了考察(表4).使用不同取代基的苄醚,如苄乙醚、苄异丙醚以及苄基苯基醚等代替苯甲醚进行实验时,均可与苯硫酚顺利反应(表4,Entries 1~4),且异丙基、苯基等体积较大的基团并未降低反应收率.而以苯甲酸苄基酯作为反应底物时,反应可以顺利进行并获得74%的收率,扩大了底物的适用性(表4,Entry 5).以不同取代基的苯硫酚进行实验(表4,Entries 6~11),在苯硫酚的对位引入供电子取代基(甲基、甲氧基)或吸电子取代基(氯原子),反应均获得较好的收率,说明反应的适用性较好.此外,还使用异色满作为反应底物,由于异色满的杂环上同时存在普通的sp3杂化的C—H键以及苄基上的sp3杂化的C—H键,因此其分子上C( sp3)—H键的选择性具有挑战性,而在本文实验条件下,反应能获得唯一的苄基C( sp3)—H键反应产物,且产率良好(表4,Entries 12和13).
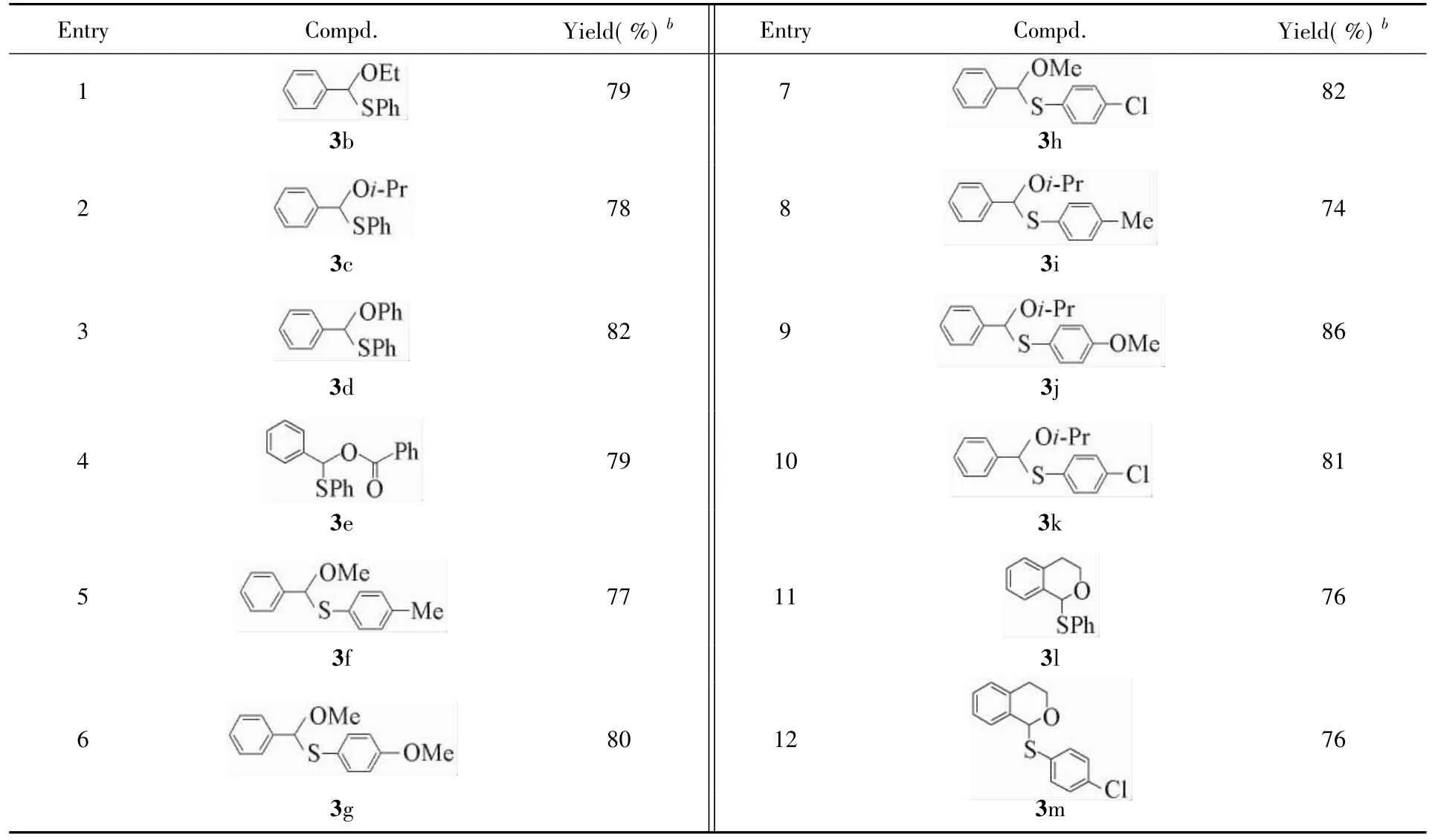
Table 4 Scope of the reactiona
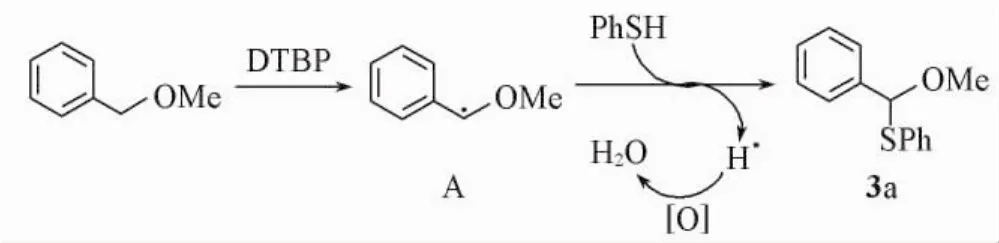
2.3反应机理
Scheme 2 Proposed reaction mechanism
为了考察反应历程,在反应体系中加入自由基淬灭剂四甲基哌啶氮氧化物( TEMPO,1. 5 mmol),反应12 h后收率降至8%.由此推断反应按照自由基机理进行.基于文献[10,21]报道及对比实验结果,推测该反应的机理如Scheme 2所示.首先,苄醚与DTBP反应得到自由基中间体A,中间体A与硫酚进一步反应得到产物3.
3 结 论
利用交叉脱氢偶联反应策略,以过氧叔丁醚为氧化剂,苯硫酚为硫化试剂,一步合成了硫代苄醚.与已有方法相比,本反应无金属参与、操作简单,具有高原子经济性和高选择性、更符合绿色化学的要求,因此具有更好的应用价值.
参考文献
[1]Li C.J.,Acc.Chem.Res.,2009,42( 2),335—344
[2]Yi W.G.,Yan D.,Wu C.,Lan L.X.,Chem.J.Chinese Universities,2014,35( 12),2563—2566(易卫国,鄢东,吴超,兰立新.高等学校化学学报,2014,35( 12),2563—2566)
[3]Zhang Y.,Feng B.N.,Chin.J.Org.Chem.,2014,34( 12),2406—2411(张艳,冯柏年.有机化学,2014,34( 12),2406—2411)
[4]Kumar R.A.,Saidulu G.,Prasad K.R.,Kumar G.S.,Sridhar B.,Reddy K.R.,Adv.Synth.Catal.,2012,354( 16),2985—2991
[5]Chu L.,Qing F.L.,Chem.Commun.,2010,46,6285—6287
[6]Wu C.,Huang W.Y.,He W.M.,Xiang J.N.,Chem.Lett.,2013,42,1233—1234
[7]Shu X.Z.,Xia X.F.,Yang Y.F.,Ji K.G.,Liu X.Y.,Liang Y.M.,J.Org.Chem.,2009,74( 19),7464—7469
[8]He T.,Yu L.,Zhang L.,Wang L.,Wang M.,Org.Lett.,2011,13( 19),5016—5019
[9]Chen L.,Shi E.,Liu Z.,Chen S.,Wei W.,Li H.,Xu K.,Wan X.,Chem.Eur.J.,2011,17( 15),4085—4089
[10]Li X.,Wang H.Y.,Shi Z.J.,New J.Chem.,2013,37,1704—1706
[11]Chen D.,Pan F.Y.,Gao J.R.,Yang J.G.,Synlett.,2013,24( 16),2085—2088
[12]Xiang S.K.,Zhang B.,Zhang L.H.,Cui Y.X.,Jiao N.,Sci.China Chem.,2012,55( 1),50—54
[13]Correia C.A.,Li C.J.,Heterocycles,2010,82( 1),555—562
[14]Zhang Y.H.,Li C.J.,J.Am.Chem.Soc.,2006,128( 13),4242—4243
[15]Kang X.,Yan R.L.,Yu G.Q.,Pang X.B.,Liu X.X.,Li X.N.,Xiang L.K.,Huang G.S.,J.Org.Chem.,2014,79( 21),10605—10610
[16]Varun B.V.,Prabhu K.R.,J.Org.Chem.,2014,79( 20),9655—9668
[17]Corbet J.P.,Mignani G.,Chem.Rev.,2006,106( 7),2651—2710
[18]Frei R.,Waser J.,J.Am.Chem.Soc.,2013,135( 26),9620—9623
[19]Saravanan P.,Anbarasan P.,Org.Lett.,2014,16( 3),848—851
[20]Zhao J.,Xuan L.N.,Zhao H.C.,Cheng J.,Fu X.Y.,Li S.,Jing F.,Liu Y.M.,Chen B.Q.,Chem.Res.Chinese Universities,2014,30( 5),764—769
[21]Guo S.R.,Yuan Y.Q.,Xiang J.N.,Org.Lett.,2013,15( 18),4654—4657
Metal-free Thiolation of C( sp3)—S Bond Adjacent to an Oxygen Atom†
YAN Dong,TONG Mengliang*
( Hunan Chemical Vocational Technology College,Zhuzhou 412004,China)
Abstract The formation of C—S bonds is one of the most important transformations in organic chemistry due to the high prevalence of sulfur-containing molecules of biological and pharmaceutical relevance.Crossdehydrogenative coupling( CDC) is more atom economical and environmentally friendly than traditional crosscoupling reactions.A facile and transition metal-free methodology for construction of C( sp3)—S bond was herein reported.With ditertbutyl peroxide( DTBP) as oxidant and thiophenol as thioetherification regent under 120℃,the high atom-efficiency and selective system offered the thiobenzylethers as products in acceptable to good yields.These new compounds were characterized via infrared( IR),nuclear magnetic resonance( NMR),and mass spectrometry( MS).The possible mechanism for the reaction was suggested as followed: benzyl ethers was oxidized by DTBP to generate intermediates A,which further reacted with thiophenol to form desired products.This direct thiolation method is a new protocol for the construction of C—S bonds,which might be very valuable and attractive in sulfur chemistry and radical chemistry.
Keywords Metal free; C—H activation; Thiolation; Thiobenzylether( Ed.: P,H,W,K)
†Supported by the Scientific Research Fund of Hunan Provincial Education Department,China( Nos.13C236,15C0464).
基金项目:湖南省教育厅科学研究项目(批准号: 13C236,15C0464)资助.
收稿日期:2015-06-12.网络出版日期: 2016-01-14.
doi:10.7503/cjcu20150465
中图分类号O621.3
文献标志码A
联系人简介:童孟良,男,教授,高级工程师,主要从事金属催化反应研究.E-mail: 13973327103@ 163. com
