无金属参与的二乙酸碘苯促进吲哚C3—H乙酸化反应
2016-03-21顾昌翰胡思前
王 亮,瞿 星,李 站,顾昌翰,胡思前
( 1.江汉大学光电化学材料与器件教育部重点实验室,2.化学与环境工程学院,武汉430056)
无金属参与的二乙酸碘苯促进吲哚C3—H乙酸化反应
王亮1,2,瞿星1,李站1,顾昌翰1,胡思前1,2
( 1.江汉大学光电化学材料与器件教育部重点实验室,2.化学与环境工程学院,武汉430056)
摘要研究了无金属参与的二乙酸碘苯和吲哚的C3—H乙酸化反应,通过对取代基效应、温度以及二乙酸碘苯用量等因素的考察,建立了反应的最佳条件:反应温度60℃,乙酸( HOAc)为溶剂.在无需任何添加剂条件下,以中等到良好的收率获得一系列C3位乙酸化的吲哚衍生物.采用红外光谱、核磁共振波谱、高分辨质谱及X射线单晶衍射分析对目标化合物进行了结构表征,并推测了可能的反应机理.该催化体系对于克量级规模反应均能获得很好的结果.
关键词无金属;二乙酸碘苯;吲哚;乙酸化
吲哚及其衍生物是一类重要的含氮杂环化合物,广泛存在于天然产物和药物分子中,具有多种多样的生物及药理活性,尤其是C3位取代的吲哚化合物[1~5].例如,3-乙酸基吲哚不仅是合成氧化吲哚的中间体,也常用于检测组织切片中的乙酰胆碱酯酶[6,7].迄今,经典的付-克反应、金属催化的偶联反应和C—H活化反应等合成方法已被应用于吲哚分子的C3—H键官能化[8~11].但是,大多数研究[12~14]集中于吲哚C3位的C—C键或C—N键的形成,关于C—O键形成的报道却很少.Lei等[15]使用二乙酸碘苯作为反应试剂和氧化剂,发展了醋酸钯催化吲哚选择性的C3—H乙酸化反应,该反应需使用贵金属催化剂Pd( OAc)2和化学计量的强碱KOH.
无金属( Metal-free)参与的反应作为一种绿色、清洁的合成策略能够减少资源浪费和环境污染[16,17].二乙酸碘苯等高价碘化物是一类易制备、性能温和的氧化剂,是无金属参与的反应中最常用的试剂之一[18~20].Huang等[21]发展了无金属参与下,吲哚与二乙酸碘苯在强碱KOH的作用下的C3—H乙酸化反应,不添加过量的KOH时,该反应收率仅为35%.Ackermann等[22]和Wen等[23]报道了无金属参与下二芳基碘化物促进的吲哚C—H芳化反应,但该反应的区域选择性不佳.
尽管无金属参与的C3位取代吲哚的合成取得了一些进展.但是,继续探索操作简便、条件温和、无需任何添加剂的无金属参与的吲哚的C—O键形成反应仍然十分必要.本文在吲哚C—H官能化反应[24,25]的基础上,通过调节吲哚氮原子上的取代基,不仅能够避免强碱如KOH等添加剂的使用,而且无需昂贵金属试剂的参与,使3-乙酸基吲哚的合成能在更加简单、温和的条件下进行.
1 实验部分
1.1试剂与仪器
所用试剂均为市售分析纯,未经纯化直接使用;无水溶剂均按标准方法干燥; GF254薄层层析和柱层析硅胶( 200~300目,山东青岛海洋化工厂).
Bruker AvanceⅡ-400 MHz型超导核磁共振仪; Bruker TENSOR27型傅里叶变换红外光谱仪(直接涂片测定)和Bruker microTOF-QⅡ型高分辨质谱仪(德国Bruker公司) ; WRS-2型微机熔点仪(上海圣科仪器设备有限公司).
1.2实验过程
吲哚C3—H乙酸化反应路线如Scheme 1所示.向干燥的10 mL Schlenk管中依次加入N-嘧啶吲哚( 1,0. 3 mmol)、二乙酸碘苯( 0. 36 mmol)和2 mL乙酸( HOAc),于60℃反应直至结束( TLC监测).冷却至室温后,加入20 mL乙酸乙酯转移至分液漏斗,加入25 mL饱和碳酸氢钠水溶液洗涤,分液,水相用20 mL乙酸乙酯提取,合并有机相.有机相用45 mL饱和食盐水洗涤,无水硫酸镁干燥,过滤并浓缩得到粗产品.粗产品经硅胶柱层析纯化[V(乙酸乙酯)∶V(石油醚) = 1∶8~1∶3]得目标产物2a~2t.

Scheme 1 Synthetic route for C3—H acetoxylation of indoles
化合物2a~2t的理化数据见表1,核磁数据见表2,核磁共振谱图和质谱图见图S1~S40(见本文支持信息).

Table 1 Appearance,yields,melting points,HRMS and IR data of compounds 2a—2t

Continued
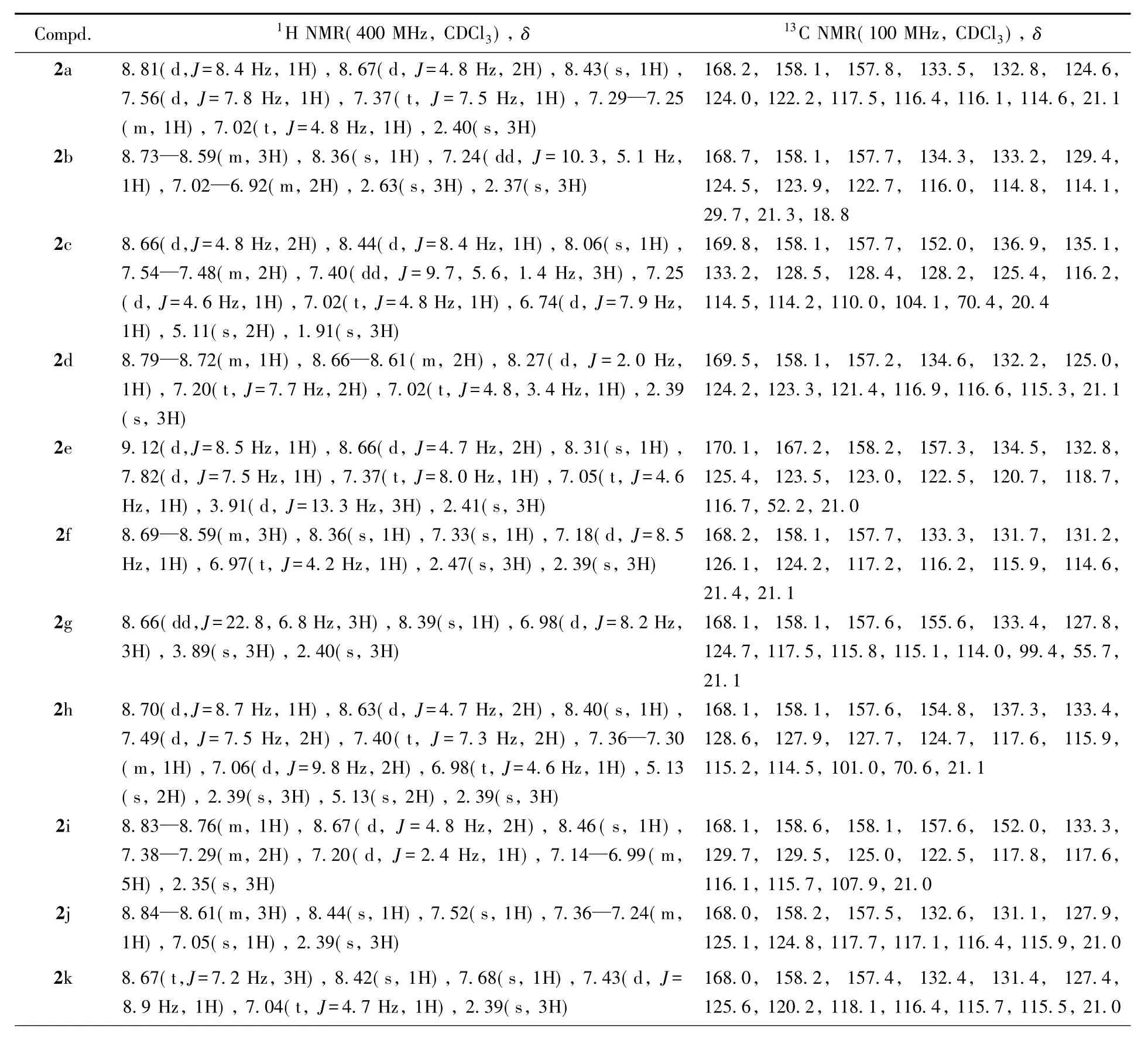
Table 21H NMR and13C NMR data of compounds 2a—2t
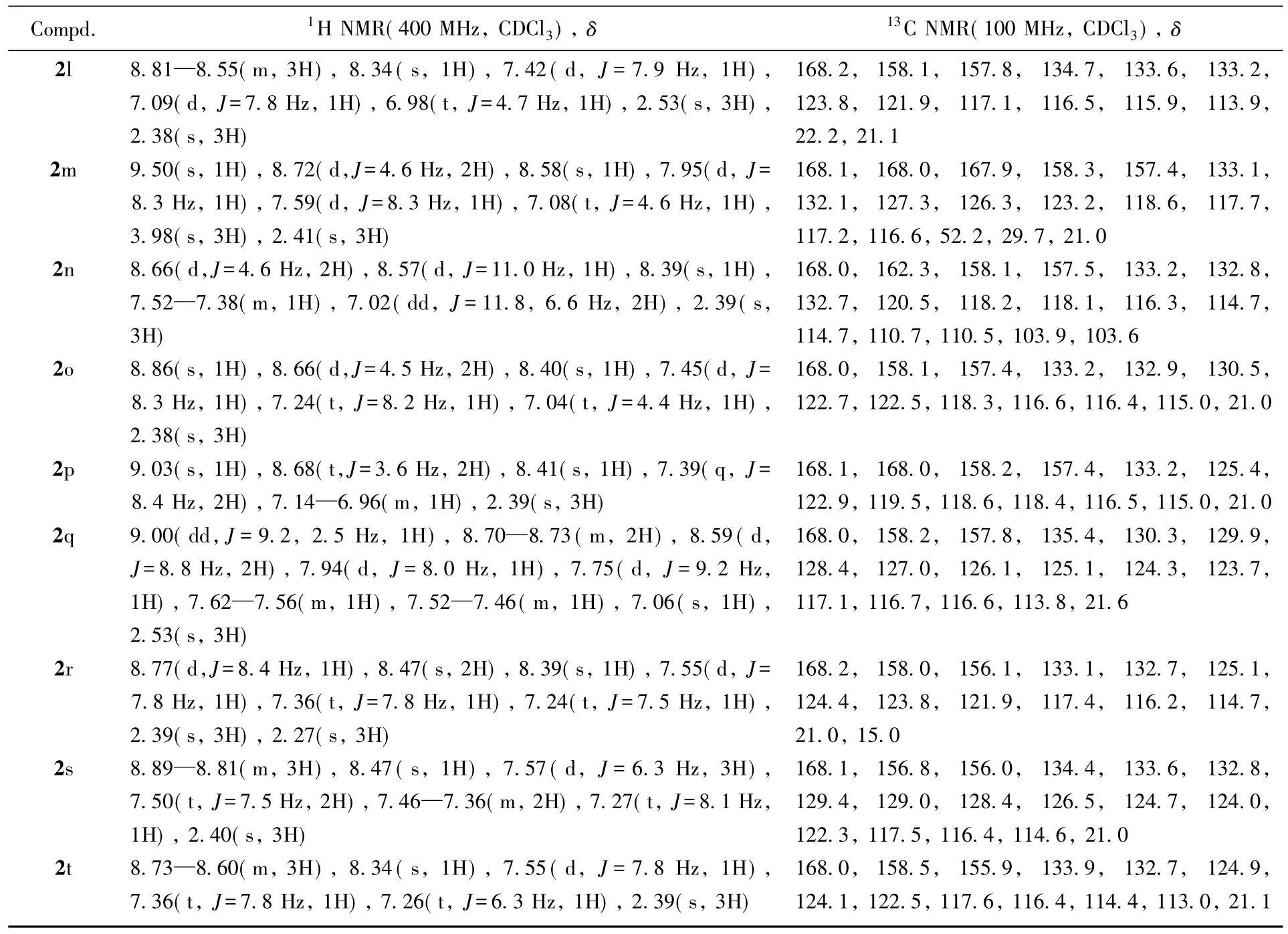
Continued
2 结果与讨论
2.1反应条件的优化
选用二乙酸碘苯作为反应试剂,醋酸作为溶剂,在50℃下对吲哚氮原子上的取代基进行了筛选,结果列于表3.当吲哚氮原子上无取代基时,反应不能发生,并且随着反应时间延长,吲哚逐渐分解直至完全(表3,Entry 1) ;当取代基为甲基或苄基时,反应体系迅速变黑,无产物形成(表3,Entries 2和3) ;当取代基为苯基时,反应能够获得产物,但收率仅为40%(表3,Entry 4) ;当取代基为吡啶基时,反应收率提高至65%(表3,Entry 5) ;当取代基为嘧啶基时,反应收率提高至78%(表3,Entry 6).而
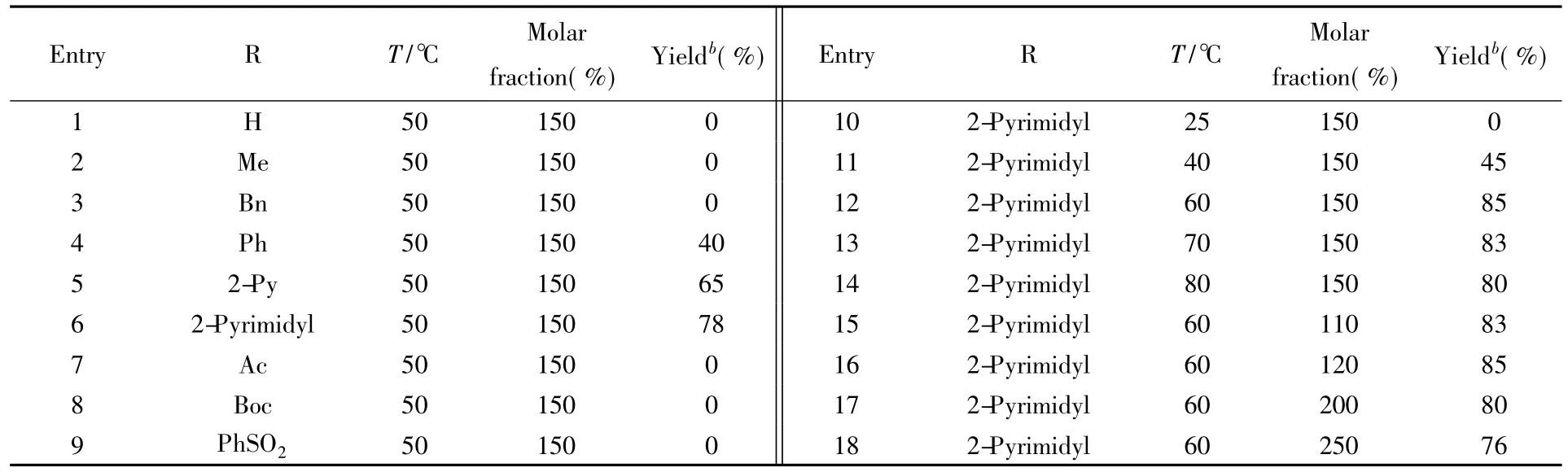
Table 3 Optimization of the reaction conditionsa
.a.Reaction conditions: indoles( 0. 3 mmol),PhI( OAc)2( 0. 36 mmol),
HOAc( 2 mL) ; b.yield after purification by column chromatography on silica gel.几种吸电子取代基,如乙酰基、叔丁氧羰基和苯磺酰基,在该条件下不能获得目标产物(表3,Entries 7~9).因此,最好的取代基为嘧啶基团.反应温度优化结果表明,当降低温度到40℃时,反应收率明显下降;反应在室温下无法进行;升温至60℃时,收率进一步提高至85%(表3,Entry 12) ;继续升温至70℃时,收率为83%(表3,Entry 13) ;在80℃下反应时,反应收率降至80%(表3,Entry 14).因此,最佳的反应温度为60℃.对二乙酸碘苯的用量进行了考察,当其用量为150%和120%(摩尔分数,相对于吲哚)时反应效果相同(表3,Entries 12和16) ;当用量增至200%时,反应收率有所下降.综上,最优的反应条件是选择吲哚氮原子取代基为嘧啶,HOAc为溶剂,反应温度为60℃,二乙酸碘苯的用量为120%.
2.2反应底物的扩展
在最优反应条件下,对反应的底物适用范围进行了考察,结果列于表4.可见,一系列含有各种取代基的吲哚均能以中等到良好的产率获得预期的乙酸化产物.当吲哚环上含有供电子的基团,如甲基、甲氧基及苄氧基等时,均能很好地适应反应体系,收率为63%~83%(表4,Entries 2,3,6~8和12).其中,当吲哚5位为苯氧基时,能以86%的最高收率获得相应产物(表4,Entry 9).在吲哚环的不同位置引入卤素基团,如氟、氯及溴等,反应也能够较好地进行(表4,Entries 4,10,11和14~16).这些卤素基团为进一步的官能化提供了反应位点.底物中的酯基官能团在反应中未受到影响,收率分别为75% 和63%(表4,Entries 5和13).值得注意的是,具有多个苯环结构的吲哚也是很好的底物,以45%的收率获得目标产物(表4,Entry 17).此外,对嘧啶环的取代基进行了拓展.在嘧啶基团上引入甲基、苯基和溴原子时,反应能够以较好收率获得相应的产物(表4,Entries 18~20).

Table 4 Substrate scope of the C3—H acetoxylation of indoles
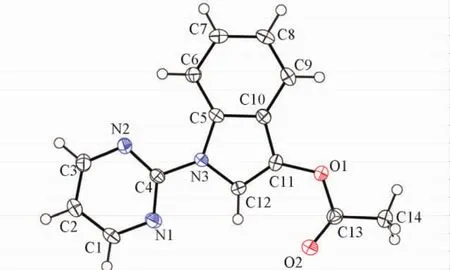
Fig.1 Crystal structure of compound 2a
2.3放大量实验
在HOAc为溶剂,60℃条件下进行了放大量实验.结果表明,当N-嘧啶吲哚1a用量扩大到8 mmol时,也能够与二乙酸碘苯顺利进行反应,并以83%的收率获得目标产物.在某种程度上,该反应具有一定的放大效应和应用前景.
2.4反应的区域选择性
从实验结果分析,所有产物中乙酸基均连接在吲哚的C3位置,表现出区域专一性.为了进一步确证反应具有绝对的区域选择性,测定了产物2a ( CCDC号: 1418484)的晶体结构(见图1).可见,吲哚C3位的氢原子被乙酸基所取代,而吲哚C2位的氢原子未被取代.
2.5反应机理
根据以上实验结果,推测的可能反应机理如Scheme 2所示.N-嘧啶吲哚亲核性进攻二乙酸碘苯,形成C—I键并产生中间体A;中间体A经分子内的环化,形成三元环碘鎓离子中间体B;乙酸根负离子亲核进攻,使三元环碘鎓离子中间体B发生开环,并形成C—O键;中间体C经过分子内电子转移使得C—I键断裂形成中间体D,并脱去一分子碘苯和乙酸;中间体D经过分子内的质子转移形成产物.

Scheme 2 Proposed mechanism of the C3—H acetoxylation of indoles
3 结 论
通过研究吲哚氮原子取代基的结构,发现取代基为嘧啶基团的吲哚能够在乙酸作为溶剂条件下,与二乙酸碘苯发生C3—H乙酸化反应.该反应操作简便、条件温和,无需金属催化剂参与避免了强碱的使用,底物适用范围广泛,并且能进行克量级放大实验.
支持信息见http: / /www.cjcu.jlu.edu.cn/CN/10.7503/cjcu20150716.
参考文献
[1]Cacchi S.,Fabrizi G.,Chem.Rev.,2005,105( 7),2873—2920
[2]Kang C.M.,Zhao X.H.,Yu Y.Q.,Lü Y.T.,Chem.J.Chinese Universities,2014,35( 3),550—554(康从民,赵绪浩,于玉琪,吕英涛.高等学校化学学报,2014,35( 3),550—554)
[3]Zhang J.H.,Lü Y.,Jia H.L.,Song Y.Y.,Sun X.X.,Chai D.X.,Wang L.Y.,Chem.J.Chinese Universities,2015,36( 10),1924—1932(张江华,吕英,贾红亮,宋银银,孙晓霞,柴敦宵,王兰英.高等学校化学学报,2015,36( 10),1924—1932)
[4]Cheng X.,Li X.L.,Wan W.L.,Hao W.M.,Hai L.,Wu Y.,Chem.Res.Chinese Universities,2015,31( 1),53—59
[5]Li X.L.,Qiu R.,Wan W.L.,Cheng X.,He Y.,Hai L.,Wu Y.,Chem.Res.Chinese Universities,2015,31( 4),539—542
[6]Guyen B.,Schultes C.M.,Hazel P.,Mann J.,Neidle S.,Org.Biomol.Chem.,2004,2( 7),981—988
[7]Arnold R.D.,Nutter W.M.,Stepp W.L.,J.Org.Chem.,1959,24( 1),117—118
[8]Bandini M.,Eichholzer A.,Angew.Chem.Int.Ed.,2009,48( 51),9608—9644
[9]Chen J.R.,Li C.F.,An X.L.,Zhang J.J.,Zhu X.Y.,Xiao W.J.,Angew.Chem.Int.Ed.,2008,47( 13),2489—2492
[10]An X.L.,Chen J.R.,Li C.F.,Zhang F.G.,Zou Y.Q.,Guo Y.C.,Xiao W.J.,Chem.Asian J.,2010,5( 10),2258—2265
[11]Cho S.H.,Kim J.Y.,Kwak J.,Chang S.,Chem.Soc.Rev.,2011,40( 10),5068—5083
[12]Stuart D.R.,Fagnou K.,Science,2007,316( 5),1172—1175
[13]Liu H.H.,Wang Y.,Deng G.,Yang L.,Adv.Synth.Catal.,2013,355( 17),3369—3374
[14]Li Y.X.,Wang H.X.,Ali S.,Xia X.F.,Liang Y.M.,Chem.Commun.,2012,48( 17),2343—2345
[15]Liu Q.,Li G.,Yi H.,Wu P.,Liu J.,Lei A.,Chem.Eur.J.,2011,17( 8),2353—2357
[16]Sun C.L.,Shi Z.J.,Chem.Rev.,2014,114( 18),9219—9280
[17]Allais C.,Grassot J.M.,Rodriguez J.,Constantieux T.,Chem.Rev.,2014,114( 21),10829—10868
[18]Zhdankin V.V.,Stang P.J.,Chem.Rev.,2002,102( 7),2523—2584
[19]Wirth T.,Angew.Chem.Int.Ed.,2005,44( 24),3656—3665
[20]Cho S.H.,Yoon J.,Chang S.,J.Am.Chem.Soc.,2011,133( 15),5996—6005
[21]Liu K.,Wen P.,Liu J.,Huang G.,Synthesis,2010,21,3623—3626
[22]Ackermann L.,Dell’Acqua M.,Fenner S.,Vicente R.,Sandmann R.,Org.Lett.,2011,13( 9),2358—2360
[23]Wen J.,Zhang R.Y.,Chen S.Y.,Zhang J.,Yu X.Q.,J.Org.Chem.,2012,77( 1),766—771
[24]Wang L.,Qu X.,Li Z.,Peng W.M.,Tetrahedron Lett.,2015,56( 24),3754—3757
[25]Wang L.,Qu X.,Li Z.,Peng W.M.,Chin.J.Org.Chem.,2015,35( 3),688—697(王亮,瞿星,李站,彭望明.有机化学,2015,35( 3),688—697)
Metal-free C3—H Acetoxylation of Indoles Promoted by PhI( OAc)†
2
WANG Liang1,2*,QU Xing1,LI Zhan1,GU Changhan1,HU Siqian1,2*
( 1.Key Laboratory of Optoelectronic Chemical Materials and Devices,Ministry of Education,2.School of Chemical and Enviromental Engineering,Jianghan University,Wuhan 430056,China)
†Supported by the National Natural Science Foundation of China( No.21302064),the Scientific Research Project of Hubei Provincial Department of Education,China( No.B2015231) and the Scientific Research Initial Funds for Doctors of Jianghan University,China( No.2012023).
Abstract 3-Substituted indoles are common structural motifs in a series of natural products,pharmaceuticals and biologically active compounds.Metal-free reaction was emerged as one of the most powerful tools for functionalization of indoles due to its environment friendly features.In this work,the metal-free C3—H acetoxylation of indoles and PhI( OAc)2was developed.The optimized reaction conditions were established by examination of the substituent,temperature and amounts of PhI( OAc)2.A series of 3-acetoxyindoles could be obtained in HOAc at 60℃without additives.The yield of product ranged from 45% to 86%.The structures were characterized by infrared ( IR),nuclear magnetion resonance ( NMR),high resolution mass spectra ( HRMS) and X-ray diffraction techniques and a possible reaction mechanism was then proposed.Moreover,this reaction system was also feasible in a gram-scale reaction without significant decrease in the product yields.
Keywords Metal-free; Diacetoxyiodobenzene; Indole; Acetoxylation
( Ed.: P,H,Y,K)
基金项目:国家自然科学基金(批准号: 21302064)、湖北省教育厅科学研究计划指导性项目(批准号: B2015231)和江汉大学博士科研启动经费项目(批准号: 2012023)资助.
收稿日期:2015-09-14.网络出版日期: 2016-01-04.
doi:10.7503/cjcu20150716
中图分类号O626. 1
文献标志码A
联系人简介:王亮,男,博士,讲师,主要从事杂环化合物的C—H官能化研究.E-mail: wangliang@ jhun.edu.cn胡思前,男,教授,主要从事杂环导向的有机功能材料研究.E-mail: husiqian@ 126.com
