基于阴极材料优化的微生物电解池研究进展
2016-03-18靳捷刘奕梅邵俊捷徐向阳朱亮浙江大学环境工程系浙江杭州009杭州市环境监测中心站浙江杭州0007浙江省水体污染控制与环境安全技术重点实验室浙江杭州009
靳捷,刘奕梅,邵俊捷,徐向阳,,朱亮,(浙江大学环境工程系,浙江 杭州 009;杭州市环境监测中心站,浙江 杭州 0007;浙江省水体污染控制与环境安全技术重点实验室,浙江 杭州 009)
基于阴极材料优化的微生物电解池研究进展
靳捷1,刘奕梅2,邵俊捷1,徐向阳1,3,朱亮1,3
(1浙江大学环境工程系,浙江 杭州 310029;2杭州市环境监测中心站,浙江 杭州 310007;3浙江省水体污染控制与环境安全技术重点实验室,浙江 杭州 310029)
摘要:微生物电解池(MEC)是一种新型的废水处理和产能一体化技术,其通过微生物阳极催化氧化废水中的有机物,同时在阴极产生氢气和甲烷。近年来,寻找高性能低成本的阴极材料和催化剂、推进MEC废水处理应用是相关领域的研究热点。本文综述了目前MEC系统常见的阴极材料和催化剂,包括贵金属Pt、不锈钢网、镍金属、纳米材料、导电聚合物和复合材料以及生物阴极。着重介绍了基于生物阴极优化的MEC系统在废水处理与产能方面的应用。最后在阴极材料的布局优化、阴极复合材料合成、胞外电子传递机制三方面进行了展望,指出不锈钢网和纳米材料具有良好的性能,未来可通过优化电极材料的空间布局和电极表面催化特性来强化微生物附着,推进MEC技术工程应用。
关键词:电化学;阴极材料;催化剂;废水
第一作者:靳捷(1991—),女,硕士研究生。联系人:朱亮,博士,副教授,主要从事废水生物处理和资源化技术研究。E-mail felix79cn@ hotmail.com。
微生物电解池(microbial electrolysis cell,MEC)在含有机物废水处理和产能方面具备极大开发潜力,已受到了国内外研究者广泛关注。MEC以附着在阳极表面的产电菌为催化剂(如Geobacteraceae,Shewanella,Pseudomonas 等)[1-3]氧化废水中的有机物产生电子、质子、二氧化碳等,电子被转移到阳极,并通过外电路到达阴极,最终在阴极表面催化剂的作用下与电子受体结合[4]。其中电子受体的种类有很多,包括质子、二氧化碳、硫酸盐、硝酸盐以及一些难生物降解的有机物质,如染料、农药、氯代硝基苯等。 MEC的工作原理如图1所示。

图1 微生物电解池的工作原理
区别于微生物燃料电池(microbial fuel cell,MFC),MEC通常需要外加一定的电压来降低阴极过电势。在较低过电势下,MEC阴极不仅能够产氢,同时污染物的去除性能得到强化[5]。从热力学角度来看,阳极氧化乙酸和阴极产氢所需标准电极电势(pH=7.0,温度25℃)分别为−0.284mV和−0.421mV,因此当乙酸作为电子供体时,理论上至少需要0.137V外加电压才能发生上述反应,见式(1)、式(2)[6]。综合考虑电极过电势和内阻,MEC体系需在0.5~1.0V的电压条件才可以正常运行,电解水产氢则需要1.6V外加电压[7]。因此,MEC在产氢方面更具可行性与经济性。此外,与厌氧发酵相比,MEC产氢效率更高、有机物降解更彻底[8]。

目前,研究主要集中于改善阳极面积[9]、减少电极间距[10]、优化电极布局[11]、改善装置结构[12]等途径,以期提高MEC运行效率。综合分析认为,阴极作为MEC的重要组成部分,扮演着产能、污染物降解的重要角色,其特性一定程度决定MEC整体性能。为此,本文对目前MEC系统常见的阴极材料及催化剂进行了系统总结,着重介绍了基于生物阴极优化的MEC系统在废水处理与产能方面的应用,最后在阴极材料的结构优化、阴极复合材料合成、胞外电子传递机制等方面进行了展望,以期为MEC在废水处理与产能领域应用提供借鉴和帮助。
1 MEC阴极材料
一直以来,阴极设计是MEC发展和应用的重大挑战,通常采用化学阴极法或生物阴极法来增强其催化活性,加快MEC阴极材料的还原反应速率。目前,MEC阴极材料大多采用性能优异的碳载铂催化剂,其成本较高。因此,寻求高活性的廉价催化剂,仍然是MEC阴极的研究重点。
1.1 贵金属铂催化剂
金属铂因其较低的产氢过电势[13],被广泛用作阴极催化剂。铂金属高催化活性可从金属材料的析氢反应“火山图”中得到解释(如图2),其在适当的吸附自由能 ∆G0ads(H++ e−+M—→M—H)处交换电流密度i0最大,说明其析氢催化活性最强[14]。
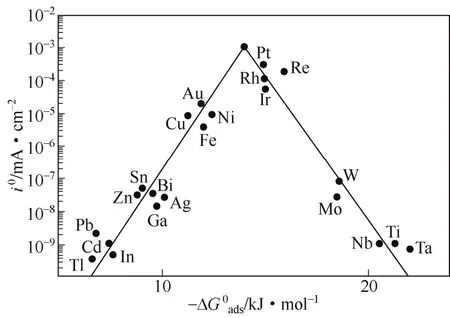
图2 金属析氢反应电催化活性“火山图”[14]
目前,多数研究者用黏合剂(例如全氟磺酸)将铂涂抹在碳纸或碳布上作为阴极[15]。CHENG和LOGAN[16]在MEC双室体系中,用负载0.5mg/cm2铂催化剂的碳布(投影面积1cm2)作阴极材料,当外加为0.8V电压时反应体系H2产生速率为1.5m3/(m3·d),H2产量高达3.95mol/mol乙酸,占理论计算产量的99%。CALL和LOGAN[17]用负载0.5mg/cm2铂催化剂的碳布(投影面积7cm2)作为阴极材料,添加乙酸作为碳源,MEC体系阴极产H2速率达3.12m3/(m3·d)±0.02m3/(m3·d),是目前实验室得到的最高H2产率。HOU等[18]用铂催化的碳布(0.5mg/cm2,投影面积7cm2)作为阴极材料,在MEC单室体系中研究紫外线对产甲烷过程的抑制,发现紫外线可有效抑制产甲烷过程,H2产量由2.87mol/mol±0.03mol/mol乙酸持续升高到3.70mol/mol±0.11mol/mol乙酸,而无紫外线的对照组的氢气产量由3.78mol/mol±0.12mol/mol乙酸降至0.03mol/mol±0.004mol/mol乙酸。
尽管铂催化剂具有较好的产氢性能,但在自然界中铂的提取困难、价格昂贵且易受硫化物侵蚀失活[19],因此其在MEC体系中的推广应用受到限制。
1.2 不锈钢网
不锈钢网是目前最常用的含镍金属材料,其价格低廉且性能稳定。SELEMBO等[20]研究不同型号不锈钢网SS(304、316、420和 A286)和镍合金(201、400、625 和 HX)的氢气回收率、最大体积氢气产率和能量回收率,发现在外加0.9V电压下SS A286的H2产量最高(21.2mL±2.2mL),且多次批次试验后H2产量仍然稳定,而铂金属板的H2产量在第一周期的批次实验中较高(34.5mL±2.6mL),试验三周期后H2产量降至19.2mL±1.3mL;此外,SS A286阴极H2回收率为61%,最大体积氢气产率1.5m3/(m3·d),均高于铂金属板阴极[47%和0.68m3/(m3·d)],表明不锈钢网在产气方面具有更好的催化活性和稳定性,可以代替贵金属用作MEC阴极。
ZHANG等[21]发现,网状结构不锈钢的电化学活性表面积是平面结构不锈钢的3倍以上,前者具有更优的产氢活性,进一步分析不同孔径不锈钢网304系列(>0.04cm,44#;约0.02cm,60#;约0.01cm,165#)的性能差异发现,60#具备最密集的网线结构、最大的比表面积66m2/m3和最低的产氢过电势,外加0.9V电压条件下其H2回收率高达98±4%,总能量效率为74%±4%,H2产率2.1m3/(m3·d)± 0.3m3/(m3·d),体积电流密188A/m3±19A/m3,在三者中性能最优。尽管165#的比表面积仅次于60#(61m2/m3),但其产氢过电势远远高于60#,这可能是由于165#的小孔径对氢气具有滞留效应,增加了过电势。因此,在不锈钢网的选材过程中,要考虑到孔径的大小对氢气释放的影响。
为强化不锈钢网的产氢性能,研究者对不锈钢网表面结构进行了改进。Call等[9]将鬃毛刷子(直径0.08mm)插入不锈钢网SS304中制成高比表面积(810m2/m3)的不锈钢网刷,外加0.6V电压条件下体系H2产率达1.7m3/(m3·d)±0.1m3/(m3·d),体积电流密度为188A/m3±10A/m3,和ZHANG等[21]在0.9V条件下的实验结果相当,表明增加电极表面积可减少MEC体系的能耗。但不锈钢网刷的价格高于60#(30mL体系中,用于60#需要0.004美元,不锈钢网刷0.03美元),因此在选材方面应综合考虑材料价格、能耗和产氢三方面因素,从而提高反应体系的性价比。
1.3 镍金属催化剂
在非贵金属行列中,镍价格低廉、催化活性高、化学稳定性强,在电解水产氢领域具有较好的应用前景。SELEMBO等[22]将267μL的全氟磺酸黏合剂与镍粉(Ni 210:0.5~1mm)混合后涂抹于碳布上制成MEC阴极,发现Ni-碳布电极在H2产生速率为1.2~1.3m3/(m3·d),略低于Pt-碳布电极(10mg Pt,400mL全氟磺酸)的产氢速率1.6m3/(m3·d),但是LSV线性扫面发现两者具有相同的阴极过电势−0.5mV,且H2回收率和库仑效率基本相同,说明Ni-碳布电极可以作为Pt-碳布电极的替代物。
由于金属之间的协同电子效应,镍合金在催化产氢方面的性能优于单独镍金属[23]。HU等[24]将镍合金NiMo和 NiW电沉积于碳布上作为MECs阴极,研究发现在外加0.6V电压条件下,NiMo-碳布阴极产氢速率为2.0m3/(m3·d),比NiW-碳布体系高33%,略低于Pt催化的阴极产氢速率[2.3m3/(m3·d)]。NiMo-、NiW-、Pt-碳布体系的氢气回收率分别为65%、55%和48%。LI等[25]以石墨板作为阴极,研究添加Sn的Ni、Al合金粉作为低成本MEC制氢催化剂的可行性,发现配比为Ni50%、Al45%、Sn5%时催化制氢效果最好,且Ni-Al-Sn的协同作用能够提高催化剂对产氢的选择性,不同镍合金的催化活性和稳定性排序如下:Ni-Mo > Co-W > Co-Mo > Ni-W > Ni-Co > Ni-Fe > Ni-Cr。
近年来,泡沫镍用于电极材料日益受到关注,其电阻率低、易于生产、价格低廉(0.02美元/g; Pt 50美元/g),最重要的是其高比表面积有助于降低产氢过电势、增大表面电流密度、减少活化过电势和浓度过电势[26]。JEREMIASSE等[27]用泡沫镍做阴极材料(10cm×10cm×0.2cm,1360kg/m3),外加1V电压,MEC阴极产氢效率超过50.00m3/(m3·d) ,电流密度为22.8A/m2±0.1A/m2。随着反应运行到32天,电流密度下降到13.8A/m2,阴极电势由−0.23V升高到−0.24V。目前对于泡沫镍作为阴极材料的电势升高的原因还未有定论,研究者对含镍材料产氢性能下降分析如下:①泡沫镍表面产生的H2占据电极活性位点[28];②碱性条件下活性位点中毒[29];③碱性条件下生成强氧化镍降低电催化活性[30];④批次试验之间存在镍材料电极暴露在空气中的问题,易被腐蚀[22]。
1.4 纳米材料催化剂
纳米材料,主要包括纳米粒子和碳纳米管(CNTs),具有良好的结构稳定性以及电化学稳定性,且能有效改善电极表面的形态和化学过程,是一种极具开发前景的催化剂。
鉴于金属钯来源广泛、活性与铂相当,可作为铂催化剂理想的替代物。HUANG等[31]将钯纳米粒子通过电沉积法负载于碳纸上作为MEC阴极,研究其产氢催化活性发现,尽管钯纳米粒子的负载量(0.0106mg/cm2)仅为铂负载量(0.53mg/cm2)的1/50,但钯纳米粒子-碳纸电极具有更低的产氢过电势,且库仑效率和氢气产率均高于铂-碳纸电极,较高的产氢活性推测是由钯在特定电沉积条件下形成的微纳米形态引起。除此之外,钯在脱氯方面也具有出色的催化性能。CHENG等[32]研究发现,铂表面产生的氢气会大量流失,而通过电沉积法形成的钯纳米粒子能够将氢原子或氢气固定在其晶格内,用于不断提供脱氯反应所需的强还原剂,揭示了钯强化脱氯的本质。
镍作为阴极催化剂在MEC产氢方面优势明显,研究者在此基础上提出镍基纳米材料的概念,旨在提高电极表面积来进一步降低阴极过电势。WU等[33]以不锈钢网为基材,将Ni 纳米颗粒涂布在不锈钢网306上作为阴极,以预处理过的厌氧发酵制氢废液为底物、乙酸为主要的电子供体用于产氢。体系稳定运行5个周期后,产氢速率达到1.31m3/(m3·d)±0.04m3/(m3·d),是没有涂布Ni 纳米颗粒对照组的两倍,表明阴极 Ni 纳米颗粒可大幅降低阴极过电势。MITOV等[34]用电沉积法将镍基纳米材料NiFe-、NiFeP-和NiFeCoP-负载于碳毡表面作为MEC阴极,在中性和弱酸性溶液中复合材料的产氢过电势和电流产率均高于未经修饰的碳毡,其中NiFeCoP-碳毡产氢速率最高,达1.7m3/(m3·d)±0.1m3/(m3·d)。无论是在磷酸盐缓冲体系中(pH值为7.0)或是乙酸盐缓冲溶液中(pH值为5.5),镍基纳米材料均表现出了良好的抗腐蚀稳定性。研究者还致力于开发其他成分的纳米粒子,如TIAN等[35]在碳布上负载FeP纳米粒子膜用于阴极产氢,发现在酸性或中性介质中其产氢催化活性高于Pt/C催化剂。
碳纳米管具有良好导电性、较大比表面积、高强度和柔韧性,使其在电极修饰领域备受青睐。WANG等[36]分别用Pt/碳纳米管、Pt、碳纳米管修饰碳布基材用于MEC产氢,发现Pt/碳纳米管的产氢率高达1.42m3/(m3·d),电流密度为192A/m3,库仑效率为94%。REZAEE等[37]用多壁碳纳米管修饰碳毡用于微生物阴极脱氮,在最优ORP、pH值、电流密度和水力停留时间下氮去除率高达92.7%,主要是由于碳纳米管大幅提高了碳毡表面积,增强反硝化菌在电极表面的附着,从而明显改善阴极脱氮性能。
1.5 导电聚合物及其复合材料
导电聚合物如聚苯胺、聚吡咯、席夫碱、酞菁等,具有较好的电化学特性和较高的稳定性[38]。其中,酞菁是由4个吡咯核组成的具有卟啉环结构的染料,根据分子轨道理论,其具有这种结构的共轭体系很稳定,且平面π共轭结构有利于电子在活性催化位点和反应物之间的快速转移。研究发现,金属酞菁附着在电极表面能够有效催化CO2还原,特别是钴酞菁及其衍生物的催化活性最高[39]。ISAACS等[40]用四氨基M酞菁(M=Co,Ni,Fe,H2)修饰玻碳电极催化还原CO2,发现还原产物取决于中心原子的类型。

图3 碳纳米管/四氨基钴酞菁修饰的电极
ZHAO等[41]将碳纳米管和四氨基钴酞菁复合修饰MEC阴极表面,研究发现其大大降低了CO2还原反应过电势(如图3),甲酸产率高达21.0mg/(L·h) ±0.2mg/(L·h),相比单独用四氨基钴酞菁修饰阴极,碳纳米管/四氨基钴酞菁修饰的电极电流和甲酸的产率分别提高20% 和100%,且增加电极的修饰层可以继续提高电极电流和甲酸的产率。YANG等[42]用聚苯胺/多壁碳纳米管复合材料代替Pt/C用于MEC单室产氢,外加1.0V电压时复合材料的氢气产率达到1.04m3/(m3·d),电流密度为163A/m3,库仑效率为47.2%,COD去除率88%,各项指标均与Pt/C催化的阴极相当。ZHANG等[43]用聚乙烯亚胺(PEI)强化氮掺杂纳米管还原CO2,发现氮掺杂和PEI的协同催化效应能够大大降低阴极过电势、增加电流密度,增强CO2还原生成甲酸过程的电子利用效率。
1.6 生物阴极
早在20世纪60年代,LEWIS[44]就创新性地提出微生物作为阴极催化剂的想法。由于化学催化剂存在成本高、 稳定性差等问题,近年来越来越多研究者利用微生物代替昂贵的金属催化剂来催化阴极反应。生物阴极主要有以下几个优点:①微生物替代金属等其他化学试剂作为催化剂,可降低MEC的构建与运行成本;②避免了催化剂中毒等问题,从而提高MEC运行稳定性;③阴极表面生长的微生物可处理废水和生成有价值的产物。
电极基材作为微生物附着物,是决定生物阴极性能的关键因素[45]。首先,良好的导电性有助于电子顺利的从外电路传递到阴极表面;其次,较大的比表面积为微生物提供了广阔的附着空间,有助于发挥功能微生物的催化作用。为此,本文以不同结构的电极基材为分类单元,将现阶段常见的MEC生物阴极分为三类,具体阴极材料见表1。
1.6.1 平面生物阴极
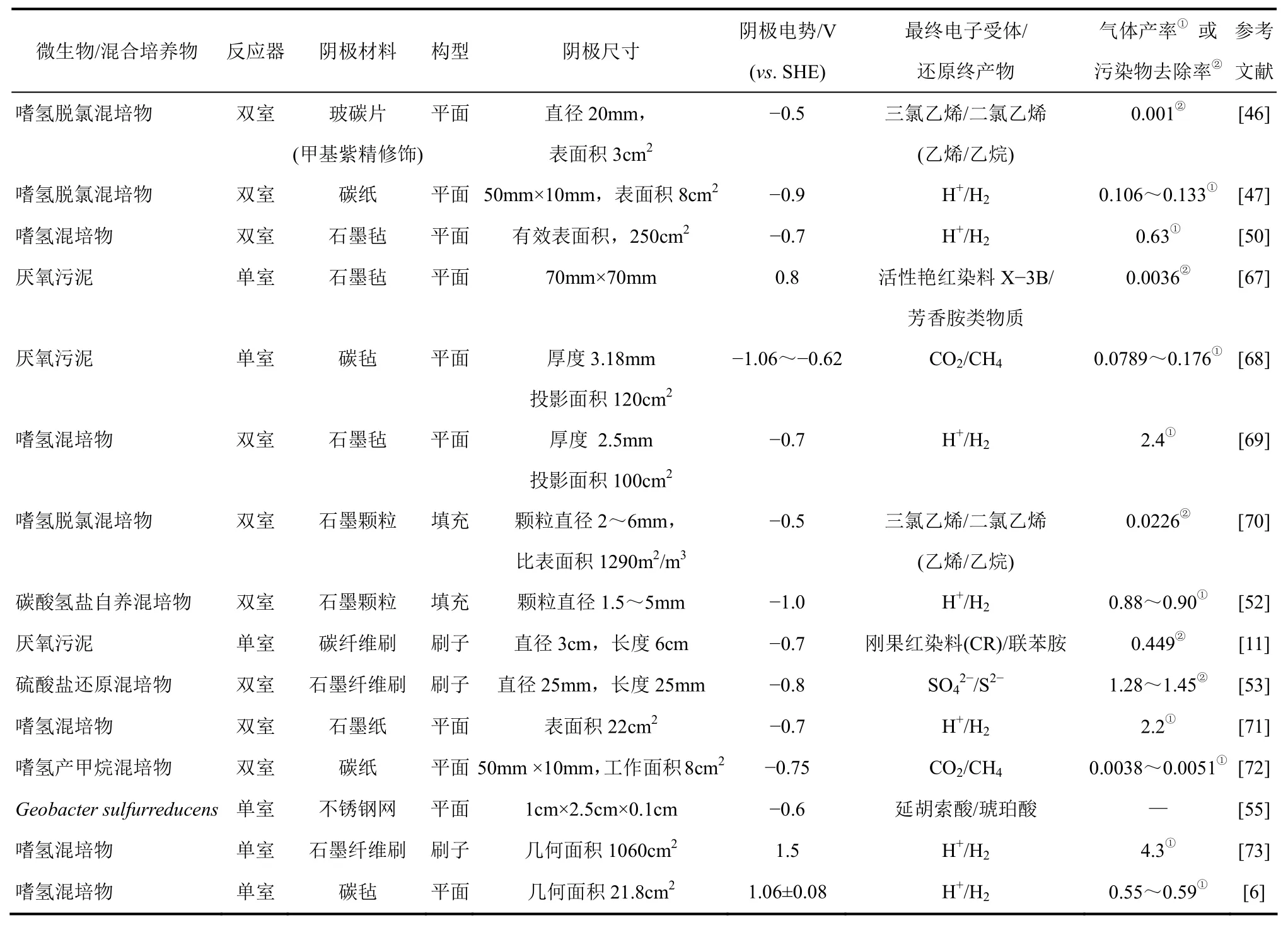
表1 MEC中不同生物阴极材料的结构和运行性能
典型的平面电极材料包括玻璃碳、碳布、碳纸、石墨板、石墨纸、石墨毡等。其中,玻碳电极导电性好、化学硬度高,但其表面积小、不易微生物附着,因此目前有关玻碳电极的使用大都加入甲基紫精作为介体,用来加速电极和微生物之间的电子转移过程[46]。碳纸很薄,僵硬易碎,但相对于玻碳棒来说表面积大,更易附着微生物。VILLANO等[47]用碳纸(50mm×10mm,表面积8cm2)替代玻碳棒作为阴极,以三氯乙烯脱氯菌群(83% Desulfitobacterium,5.6% Dehalococcoides)作为阴极接种物用于MEC体系产氢,当阴极电势−750mV(相对于标准氢电极)时三氯乙烯脱氯菌群的电流密度达0.025mA/cm2,是非生物阴极的3.7倍,且随着阴极电势进一步降低到−900mV,电流密度继续上升到0.44mA/cm2。碳布空隙多、较碳纸柔韧性强,更有利于微生物附着,目前已受到研究者的广泛关注[48]。CHEN等[49]首次提出碳布可以促进微生物间的直接电子传递过程,在Geobacter metallireducens和Geobacter sulfurreducens的互养体系中,用乙醇作为电子供体、延胡索酸作为电子受体,外加0.1g碳布的体系中乙醇的降解速率明显高于不加碳布的体系,且随着碳布量提高到0.2g,乙醇的降解速率继续升高。而外加棉布的体系导电性(电阻774kΩ±43kΩ)远远低于碳布(54Ω±6Ω),降解效果不明显。
石墨具有较优的导电性,石墨板、石墨纸、石墨毡等均已被用于阴极微生物的附着。ROZENDAL 等[50]以石墨毡为电极材料(有效表面积250cm2,厚度6.5mm),通过改变电极极性,成功将嗜乙酸和H2的微生物阳极转变为生物阴极,在电势−0.7V、电流密度−1.2A/m2条件下H2产率达0.63m3/(m3·d),而对照体系的电流密度仅为−0.3A/m2、H2产率为0.08m3/(m3·d)。HUANG等[51]以多孔的石墨毡为阴极,在MEC体系中接种厌氧消化池污泥还原二价钴[Co(II)],研究发现,外加0.2V电压,88.1%的Co(II)被还原(Co2++2e−→Co),Co产量为0.266molCo/mol COD ± 0.001molCo/mol COD;阴极Co(II)还原的表观活化能(Ea)为26.7kJ/mol,远低于非生物阴极(Ea=40.5kJ/mol),SEM扫描电镜发现石墨毡表面的生物膜分布均匀,部分以纳米导线的形式与阴极结合。
1.6.2 填充型生物阴极
众所周知,大比表面积的阴极材料利于微生物附着,对阴极反应速率提升具有重要影响,其中石墨颗粒作为填充型阴极材料的代表受到越来越多的关注。石墨棒通常被插入填充体系作为集流体,VILANOVA等[52]将具有导电性的石墨颗粒(粒径1.5~5mm)投加于MEC的阳极室和阴极室可加速MEC反应体系产氢,生物阴极(以Hoeflea sp.和Aquiflexum sp.为主)的能效利用率和产氢效率均高于非生物阴极,生物阴极体系中石墨颗粒表层附着大量微生物与胞外聚合物(EPS)。同时,在−1000mV阴极电势下,MEC的产氢效率为0.89m3/(m3·d)± 0.10m3/(m3·d),每公斤氢气相当于消耗掉3.2美元的能耗,低于市场产氢能耗6.0美元。
尽管石墨颗粒具有大比表面积,但为确保整个阴极室更好的电子传递效率,颗粒石墨之间必须具备一定的连贯性。此外,反应装置长期运行、水流或搅拌不畅容易产生死区,从而降低石墨颗粒的效能。
1.6.3 刷子型生物阴极
目前,刷子类电极使用广泛的是石墨纤维刷,其拥有巨大的比表面积、较高的孔隙率,能够有效收集电流传递电子。LUO等[53]用加热处理过的石墨纤维刷(直径25mm,长度25mm)作为反应体系的阳极和阴极,发现在连续流实验中阴极室硫酸盐降解速率为0.73mg/d,是批次试验的1.49倍。SEM电镜扫描阴极表面可看到一层杆状为主的生物膜,优势菌群为Lactococcus sp.,Carnobacterium sp.和Escherichia sp.。PISCIOTTA等[54]在电极电势−400mV条件下成功将MFC中石墨纤维刷阳极转化为MEC体系中能够产氢的生物阴极,石墨纤维刷表面优势菌群为Eubacterium limosum (Butyribacterium methylotrophicum) ,Desulfovibrio sp. A2,Rhodococcus opacus,Gemmata obscuriglobus。石墨纤维刷常用于MEC和MFC阳极体系充当产电菌群的载体,但阳极和阴极都为石墨纤维刷势必会增加电极间距,增大体系的内阻,因此有研究者将刷子型阴极截去一半制成半月状,用来降低电极间距提高反应器性能[11]。
除了用碳材料作生物负载基材,也有研究使用不锈钢网作阴极。DUMAS等[55]以Geobacter sulfurreducens作为阴极接种物、延胡索酸为电子受体,电极电势−0.60V条件下系统稳定,不锈钢网的电流密度为20.5A/m2,远远高于石墨材料的电流密度0.75A/m2。CV曲线表明,不锈钢网表面发生还原反应的电势为−0.30V(相对于Ag/AgCl参比电极),不锈钢表面的G.sulfurreducens生物膜在延胡索酸的还原过程中发挥重要作用。
微生物作为催化剂价格便宜、可再生且不易被腐蚀,在MEC阴极催化剂的选择上占有重要分量。MEC中用于阴极产氢的优势菌群主要包括Geobacter sulfurreducen[56]、Desulfitobacterium和Dehalococcoides[47]、以碳酸氢盐为碳源的混合菌群[50]等。然而,生物阴极达到稳定电流密度至少需要一个月,H2产生速率和阴极库仑效率均低于金属催化剂[27]。因此,宏观层面上强化基材的电导性和比表面积,微观层面上深入了解产氢菌群结构和代谢途径,是进一步提高生物阴极催化性能的关键。
2 生物阴极在MEC中应用
相比非生物阴极,生物阴极具有更为广阔的开发应用前景,在此对MEC的生物阴极功能进行总结。
2.1 废水处理
通常,含有毒物质(如氯代芳香烃、农药、染料等)的有机废水可生化性差、可利用有机物浓度低,电子供体往往成为其高效厌氧生物处理的限制瓶颈。MEC体系可提供较为充足的电子供体,为该类废水处理提供可选择途径。
研究表明,阴极表面的微生物可通过直接(外膜氧化还原蛋白/纳米导线)[56]或间接(电子介体或H2)[57]的方式接收电极表面电子,并将其用于污染物还原。LIANG等[58]发现,外加0.5V电压条件下氯霉素(CAP)可被生物阴极还原成胺类化合物,且去除率在4h内达到87.1%±4.2%、24h内达到96.0%±0.9%。TCE作为典型的氯代有机物,在MEC中已有大量研究。AULENTA等[59]发现碳纸(−550mV)可以作为直接电子供体,在Dehalococcoides spp.和Desulfitobacterium spp.的作用下将TCE还原成乙烯,且阴极电子利用率高达70%。此外,MEC还用于染料废水[60]、硫酸盐废水[61]、高氯酸盐废水[62]等的处理。本文作者课题组研发了生物电极-UASB耦合反应器,在进水COD、对氯硝基苯(p-ClNB)负荷分别为2.1~4.2 kg/(m3·d)、0~60 g/(m3·d),外加电压0~5 V条件下启动,系统获得较高COD去除率(99%)和p-ClNB还原转化速率(最高为0.328/h)。同时,耦合反应器内污泥颗粒化较快,颗粒平均粒径增幅明显,揭示生物电极可刺激微生物分泌EPS、改变污泥表面疏水性,协同促进厌氧污泥颗粒化与难降解废水高效处理[63]。
2.2 产能
研究表明,某些微生物(例如Desulfovibrio vulgaris)含有大量的氢化酶,可以催化可逆反应2H++2e−H2[64]。ROZENDAL等[50]首次实现了在MEC中利用生物阴极产氢的设想。当阴极电势为−0.7 V,其电流密度达到−1.2 A/m2,H2产生速率为0.63m3/(m3·d),远远大于非生物阴极的对照体系[电流密度仅为−0.3A/m2,H2产率仅为0.08m3/(m3·d)]。CROESE等[65]进一步研究了在阴极产氢中发挥功能的微生物,发现其组成为Proteobacteria(46%)、Firmicutes(25%),Bacteroidetes(17%)。LEE等[6]在MEC单室体系中用碳毡作为阴极微生物载体,发现外加1.06V± 0.08V电压条件下体系最大体积电流密度达51.4A/m3±1.6A/m3,产H2速率为0.57m3/(m3·d)± 0.02m3/(m3·d),高于用Pt作为阴极催化剂的MEC双室体系产H2速率[0.3m3/(m3·d)]。
除了产氢之外,MEC还可用于产甲烷,其反应方程式为:CO2+8H++8e−—→CH4+2H2O。CHENG 等[66]发现当阴极电势低于−0.5V(vs. SHE)时,产甲烷菌可直接将电极作为电子供体还原CO2产CH4;当阴极电势−0.8V(vs. SHE)时,产甲烷库仑效率高达96%;阴极生物膜表面的产甲烷优势菌为Methanobacterium palustre,能够直接从电极表面接受电子产甲烷。
3 展 望
MEC在废水处理和产能领域的优势受到研究者广泛关注,但目前MEC技术尚处于实验室研发阶段,阴极材料昂贵、阴极催化剂长效性等问题限制其大规模应用。相比而言,不锈钢网价格便宜、性能优异、稳定性好且具有一定强度,可用于催化MEC直接产能或作为基材附着微生物产氢,在实际应用中具有良好开发前景。纳米材料作为21世纪的新型材料,具有特殊内部结构和电化学活性,将其应用于MEC电极修饰将是领域重大突破。为此,有待在以下三方面开展进一步研究。
(1)优化电极空间布局,在有限反应空间内发挥最大效能。例如,根据反应器构型将不锈钢网形成不同构型,增大其表面积,降低过电势,增加功能微生物附着量。
(2)优化电极表面特性,评估复合材料电化学参数。通过在单一基材上修饰导电聚合物、应用纳米材料提高电极导电性和比表面积,增强生物电极电子传递性能与催化活性,推进MEC技术工程应用。
(3)综合运用高通量测序、稳定同位素标记等技术手段,解析电极功能微生物菌群结构与功能,揭示基于电子介体、纳米导线、细胞色素的胞外电子转移机制,为高效MEC研发提供理论依据。
参 考 文 献
[1] BOND D R,HOLMES D E,TENDER L M,et al. Electrode-reducing microorganisms that harvest energy from marine sediments[J]. Science,2002,295(5554):483-485.
[2] BOND D R,LOVLEY D R. Electricity production by Geobacter sulfurreducens attached to electrodes[J]. Applied and Environmental Microbiology,2003,69(3):1548-1555.
[3] DEBABOV V G. Electricity from microorganisms[J]. Microbiology,2008,77(2):123-131.
[4] WAGNER R C,CALL D F,LOGAN B E. Optimal set anode potentials vary in bioelectrochemical systems[J]. Environmental Science & Technology,2010,44(16):6036-6041.
[5] MU Y,RABAEY K,ROZENDAL R A,et al. Decolorization of azo dyes in bioelectrochemical systems[J]. Environmental Science & Technology,2009,43(13):5137-5143.
[6] LEE H,TORRES C I,PARAMESWARAN P,et al. Fate of H2in an upflow single-chamber microbial electrolysis cell using a metal-catalyst-free cathode[J]. Environmental Science & Technology,2009,43(20):7971-7976.
[7] LOGAN B E,CALL D,CHENG S,et al. Microbial electrolysis cells for high yield hydrogen gas production from organic matter[J]. Environmental Science & Technology,2008,42(23):8630-8640.
[8] LU L,XING D,REN N. Pyrosequencing reveals highly diverse microbial communities in microbial electrolysis cells involved in enhanced H2production from waste activated sludge[J]. Water Research,2012,46(7):2425-2434.
[9] CALL D F,MERRILL M D,LOGAN B E. High surface area stainless steel brushes as cathodes in microbial electrolysis cells[J]. Environmental Science & Technology,2009,43(6):2179-2183.
[10] CHENG S,LOGAN B E. High hydrogen production rate of microbial electrolysis cell (MEC) with reduced electrode spacing[J]. Bioresource Technology,2011,102(3):3571-3574.
[11] KONG F,WANG A,CHENG H,et al. Accelerated decolorization of azo dye Congo Red in a combined bioanode-biocathode bioelectrochemical system with modified electrodes deployment[J]. Bioresource Technology,2014,151:332-339.
[12] LOGAN B E. Scaling up microbial fuel cells and other bioelectrochemical systems[J]. Applied Microbiology and Biotechnology,2010,85(6):1665-1671.
[13] JEREMIASSE A W,HAMELERS H V,KLEIJN J M,et al. Use of biocompatible buffers to reduce the concentration overpotential for hydrogen evolution[J]. Environmental Science & Technology,2009,43(17):6882-6887.
[14] 马淳安. 有机电化学合成导论[M].北京: 科学出版社,2002.
[15] WANG A,LIU W,CHENG S,et al. Source of methane and methods to control its formation in single chamber microbial electrolysis cells[J]. International Journal of Hydrogen Energy,2009,34(9):3653-3658.
[16] CHENG S,LOGAN B E. Sustainable and efficient biohydrogen production via electrohydrogenesis[J]. Proceedings of the National Academy of Sciences,2007,104(47):18871-18873.
[17] CALL D,LOGAN B E. Hydrogen production in a single chamber microbial electrolysis cell lacking a membrane[J]. Environmental Science & Technology,2008,42(9):3401-3406.
[18] HOU Y,LUO H,LIU G,et al. Improved hydrogen production in the microbial electrolysis cell by inhibiting methanogenesis using ultraviolet irradiation[J]. Environmental Science & Technology,2014,48(17):10482-10488.
[19] FREGUIA S,RABAEY K,YUAN Z,et al. Non-catalyzed cathodic oxygen reduction at graphite granules in microbial fuel cells[J]. Electrochimica Acta,2007,53(2):598-603.
[20] SELEMBO P A,MERRILL M D,LOGAN B E. The use of stainless steel and nickel alloys as low-cost cathodes in microbial electrolysis cells[J]. Journal of Power Sources,2009,190(2):271-278.
[21] ZHANG Y,MERRILL M D,LOGAN B E. The use and optimization of stainless steel mesh cathodes in microbial electrolysis cells[J]. International Journal of Hydrogen Energy,2010,35(21):12020-12028.
[22] SELEMBO P A,MERRILL M D,LOGAN B E. Hydrogen production with nickel powder cathode catalysts in microbial electrolysis cells[J]. International Journal of Hydrogen Energy,2010,35(2):428-437.
[23] MARTINEZ S,METIKOŠ-HUKOVIĆ M,VALEK L. Electrocatalytic properties of electrodeposited Ni-15Mo cathodes for the HER in acid solutions:synergistic electronic effect[J]. Journal of Molecular Catalysis A (Chemical),2006,245(1):114-121.
[24] HU H,FAN Y,LIU H. Hydrogen production in single-chamber tubular microbial electrolysis cells using non-precious-metal catalysts[J]. International Journal of Hydrogen Energy,2009,34 (20):8535-8542.
[25] 李金来,李伟,万新华,等. 添加 Sn 的 Ni-Al 合金生物电化学制氢阴极催化剂[J]. 化工学报,2010,61(10):2558-2564.
[26] RABAEY K. Bioelectrochemical systems:from extracellular electron transfer to biotechnological application[M]. IWA Publishing,2010.
[27] JEREMIASSE A W,HAMELERS H V,SAAKES M,et al. Ni foam cathode enables high volumetric H2production in a microbial electrolysis cell[J]. International Journal of Hydrogen Energy,2010,35(23):12716-12723.
[28] RAUSCH S,WENDT H. Morphology and utilization of smooth hydrogen-evolving raney nickel cathode coatings and porous sintered-nickel cathodes[J]. Journal of the Electrochemical Society,1996,143(9):2852-2862.
[29] NIDOLA A,SCHIRA R. Poisoning mechanisms and structural analyses on metallic contaminated cathode catalysts in chlor-alkali membrane cell technology[J]. Journal of the Electrochemical Society,1986,133(8):1653-1656.
[30] SOARES D M,TESCHKE O,TORRIANI I. Hydride effect on the kinetics of the hydrogen evolution reaction on nickel cathodes in alkaline media[J]. Journal of the Electrochemical Society,1992,139 (1):98-105.
[31] HUANG Y,LIU X,SUN X,Et al. A new cathodic electrode deposit with palladium nanoparticles for cost-effective hydrogen production in a microbial electrolysis cell[J]. International Journal of Hydrogen Energy,2011,36(4):2773-2776.
[32] CHENG I F,FERNANDO Q,KORTE N. Electrochemical dechlorination of 4-chlorophenol to phenol[J]. Environmental Science & Technology,1997,31(4):1074-1078.
[33] 吴婷婷,朱葛夫,邹然,等. 发酵制氢废液的微生物电解池产氢[J]. 化工进展,2013,32(6):1435-1438.
[34] MITOV M,CHORBADZHIYSKA E,RASHKOV R,et al. Novel nanostructured electrocatalysts for hydrogen evolution reaction in neutral and weak acidic solutions[J]. International Journal of Hydrogen Energy,2012,37(21):16522-16526.
[35] TIAN J,LIU Q,LIANG Y,et al. FeP nanoparticles film grown on carbon cloth:an ultrahighly active 3D hydrogen evolution cathode in both acidic and neutral solutions[J]. ACS Applied Materials & Interfaces,2014,6(23):20579-20584.
[36] WANG L,CHEN Y,HUANG Q,et al. Hydrogen production with carbon nanotubes based cathode catalysts in microbial electrolysis cells[J]. Journal of Chemical Technology and Biotechnology,2012,87(8):1150-1156.
[37] REZAEE A,SAFARI M,HOSSINI H. Bioelectrochemical denitrification using carbon felt/multiwall carbon nanotube[J]. Environmental Technology,2015,36(8):1057-1062.
[38] VASUDEVAN P,PHOUGAT N,SHUKLA A K. Metal phthalocyanines as electrocatalysts for redox reactions[J]. Applied Organometallic Chemistry,1996,10(8):591-604.
[39] NYOKONG T,BEDIOUI F. Self-assembled monolayers and electropolymerized thin films of phthalocyanines as molecular materials for electroanalysis[J]. Journal of Porphyrins and Phthalocyanines,2006,10(09):1101-1115.
[40] ISAACS M,ARMIJO F,RAMÍREZ G,et al. Electrochemicalreduction of CO2mediated by poly-M-aminophthalocyanines (M= Co,Ni,Fe):poly-Co-tetraaminophthalocyanine,a selective catalyst[J]. Journal of Molecular Catalysis A:Chemical,2005,229(1):249-257.
[41] ZHAO H,ZHANG Y,ZHAO B,et al. Electrochemical reduction of carbon dioxide in an MFC-MEC system with a layer-by-layer self-assembly carbon nanotube/cobalt phthalocyanine modified electrode[J]. Environmental Science & Technology,2012,46(9):5198-5204.
[42] YANG Q,JIANG Y,XU Y,et al. Hydrogen production with polyaniline/multi-walled carbon nanotube cathode catalysts in microbial electrolysis cells[J]. Journal of Chemical Technology and Biotechnology,2015,90(7):1263-1269.
[43] ZHANG S,KANG P,UBNOSKE S,et al. Polyethylenimineenhanced electrocatalytic reduction of CO2to formate at nitrogen-doped carbon nanomaterials[J]. Journal of the American Chemical Society,2014,136(22):7845-7848.
[44] LEWIS K. Symposium on bioelectrochemistry of microorganisms. IV. Biochemical fuel cells.[J]. Bacteriological reviews,1966,30(1):101.
[45] ZHANG Y,SUN J,HU Y,et al. Bio-cathode materials evaluation in microbial fuel cells:a comparison of graphite felt,carbon paper and stainless steel mesh materials[J]. International Journal of Hydrogen Energy,2012,37(22):16935-16942.
[46] AULENTA F,CATERVI A,MAJONE M,et al. Electron transfer from a solid-state electrode assisted by methyl viologen sustains efficient microbial reductive dechlorination of TCE[J]. Environmental Science & Technology,2007,41(7):2554-2559.
[47] VILLANO M,DE BONIS L,ROSSETTI S,et al. Bioelectrochemical hydrogen production with hydrogenophilic dechlorinating bacteria as electrocatalytic agents[J]. Bioresource Technology,2011,102(3):3193-3199.
[48] ZHAO H,LI J,LI J,et al. Organic loading rate shock impact on operation and microbial communities in different anaerobic fixed-bed reactors[J]. Bioresource Technology,2013,140:211-219.
[49] CHEN S,ROTARU A,LIU F,et al. Carbon cloth stimulates direct interspecies electron transfer in syntrophic co-cultures[J]. Bioresource Technology,2014,173:82-86.
[50] ROZENDAL R A,JEREMIASSE A W,HAMELERS H V,et al. Hydrogen production with a microbial biocathode[J]. Environmental Science & Technology,2007,42(2):629-634.
[51] HUANG L,JIANG L,WANG Q,et al. Cobalt recovery with simultaneous methane and acetate production in biocathode microbial electrolysis cells[J]. Chemical Engineering Journal,2014,253:281-290.
[52] BATLLE-VILANOVA P,PUIG S,GONZALEZ-OLMOS R,et al. Assessment of biotic and abiotic graphite cathodes for hydrogen production in microbial electrolysis cells[J]. International Journal of Hydrogen Energy,2014,39(3):1297-1305.
[53] LUO H,FU S,LIU G,et al. Autotrophic biocathode for high efficient sulfate reduction in microbial electrolysis cells[J]. Bioresource Technology,2014,167:462-468.
[54] PISCIOTTA J M,ZAYBAK Z,CALL D F,et al. Enrichment of microbial electrolysis cell biocathodes from sediment microbial fuel cell bioanodes[J]. Applied and Environmental Microbiology,2012,78(15):5212-5219.
[55] DUMAS C,BASSEGUY R,BERGEL A. Microbial electrocatalysis with Geobacter sulfurreducens biofilm on stainless steel cathodes[J]. Electrochimica Acta,2008,53(5):2494-2500.
[56] MALVANKAR N S,LOVLEY D R. Microbial nanowires for bioenergy applications[J]. Current Opinion in Biotechnology,2014, 27:88-95.
[57] RABAEY K,BOON N,SICILIANO S D,et al. Biofuel cells select for microbial consortia that self-mediate electron transfer[J]. Applied and Environmental Microbiology,2004,70(9):5373-5382.
[58] LIANG B,CHENG H,KONG D,et al. Accelerated reduction of chlorinated nitroaromatic antibiotic chloramphenicol by biocathode[J]. Environmental Science & Technology,2013,47(10):5353-5361.
[59] AULENTA F,REALE P,CANOSA A,et al. Characterization of an electro-active biocathode capable of dechlorinating trichloroethene and cis-dichloroethene to ethene[J]. Biosensors and Bioelectronics,2010,25(7):1796-1802.
[60] WANG Y,WANG A,LIU W,et al. Accelerated azo dye removal by biocathode formation in single-chamber biocatalyzed electrolysis systems[J]. Bioresource Technology,2013,146:740-743.
[61] 符诗雨,刘广立,骆海萍,等. 微生物电解系统生物阴极的硫酸盐还原特性研究[J]. 环境科学,2014,35(2):626-632.
[62] THRASH J C,VAN TRUMP J I,WEBER K A,et al. Electrochemical stimulation of microbial perchlorate reduction[J]. Environmental Science & Technology,2007,41(5):1740-1746.
[63] ZHU L,GAO K,QI J,et al. Enhanced reductive transformation of p-chloronitrobenzene in a novel bioelectrode-UASB coupled system[J]. Bioresource Technology,2014,167:303-309.
[64] SCHWARTZ E,FRIEDRICH B. The H2-metabolizing prokaryotes[M]//The Prokaryotes Volume 2:Ecophysiology and Biochemistry. Springer,2006:496-563.
[65] CROESE E,PEREIRA M A,EUVERINK G W,et al. Analysis of the microbial community of the biocathode of a hydrogen-producing microbial electrolysis cell[J]. Applied Microbiology and Biotechnology,2011,92(5):1083-1093.
[66] CHENG S,XING D,CALL D F,et al. Direct biological conversion of electrical current into methane by electromethanogenesis[J]. Environmental Science & Technology,2009,43(10):3953-3958.
[67] ZHANG J,ZHANG Y,QUAN X,et al. Enhanced anaerobic digestion of organic contaminants containing diverse microbial population by combined microbial electrolysis cell (MEC) and anaerobic reactor under Fe (Ⅲ) reducing conditions[J]. Bioresource Technology,2013,136:273-280.
[68] DE VRIEZE J,GILDEMYN S,ARENDS J B,et al. Biomass retention on electrodes rather than electrical current enhances stability in anaerobic digestion[J]. Water Research,2014,54:211-221.
[69] CROESE E,JEREMIASSE A W,MARSHALL I P,et al. Influence of setup and carbon source on the bacterial community of biocathodes in microbial electrolysis cells[J]. Enzyme and Microbial Technology,2014,61:67-75.
[70] AULENTA F,TOCCA L,VERDINI R,et al. Dechlorination of trichloroethene in a continuous-flow bioelectrochemical reactor:effect of cathode potential on rate,selectivity,and electron transfer mechanisms[J]. Environmental Science & Technology,2011,45 (19):8444-8451.
[71] JEREMIASSE A W,HAMELERS H V,CROESE E,et al. Acetate enhances startup of a H2-producing microbial biocathode[J]. Biotechnology and Bioengineering,2012,109(3):657-664.
[72] VILLANO M,AULENTA F,CIUCCI C,et al. Bioelectrochemical reduction of CO2to CH4via direct and indirect extracellular electron transfer by a hydrogenophilic methanogenic culture[J]. Bioresource Technology,2010,101(9):3085-3090.
[73] LEE H,RITTMANN B E. Significance of biological hydrogen oxidation in a continuous single-chamber microbial electrolysis cell[J]. Environmental Science & Technology,2009,44(3):948-954.
综述与专论
Review on optimization of cathode materials in microbial electrolysis cells
JIN Jie1,LIU Yimei2,SHAO Junjie1,XU Xiangyang1,3,ZHU Liang1,3
(1Department of Environmental Engineering,Zhejiang University,Hangzhou 310029,Zhejiang,China;2Hangzhou Environmental Monitoring Center,Hangzhou 310007,Zhejiang,China;3Zhejiang Province Key Laboratory for Water Pollution Control and Environmental Safety,Hangzhou 310029,Zhejiang,China)
Abstract:Microbial Electrolysis Cell (MEC) is a novel technology that treats wastewater using bacteria as catalyst and generates energy on the cathode simultaneously. In recent years,developing a highly-efficient while low-cost cathode is very important for the application of MEC in wastewater treatment. In this review,the regularly used cathodes and cathode catalysts including the precious metal Pt,stainless steel,metal Ni,nano-materials,conductive polymers and composites as well as biocathodes in MEC are summarized. The application of biocathodes in wastewater treatment and energy generation is highlighted. Finally,the prospects of electrode development relating layout optimization,composite materials synthesis and extracellular electron transfer mechanism are briefly discussed. Stainless steel and nano-materials have good performanceand optimization of electrode space layout and catalytic characteristics on electrode surface can strengthen the microbial adhesion,which ultimately promote the practical application of MEC.
Key words:electrochemistry;cathode material;catalyst;waste water
基金项目:国家科技支撑计划项目(2013BAC16 B04)。
收稿日期:2015-06-16;修改稿日期:2015-07-27。
DOI:10.16085/j.issn.1000-6613.2016.02.040
中图分类号:X 382;X 703
文献标志码:A
文章编号:1000–6613(2016)02–0595–09
