化学平衡题 易错须注意
2016-03-17安徽华雪莹
安徽 华雪莹
化学平衡题 易错须注意
安徽 华雪莹
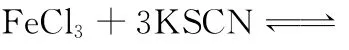
【错解】因为增大了产物K C l的浓度,平衡左移,溶液颜色变浅。
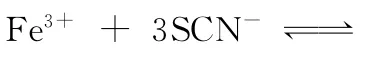
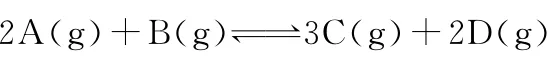
【错解】对于气相平衡问题,同学们都能够正确地分析,可是对于液相平衡问题有些同学往往感到无从入手。常常会错误地认为:由于稀释后各物质的浓度均减小,而平衡两边系数之和相等,故不移动。
【正解】因为A和B的系数是1和2,而C和D的系数是1和1,这样加水稀释后对A和B的浓度影响较大,所以右边的较小,所以要向左移。
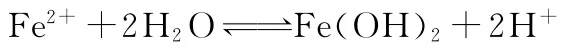
【错解】加入少量盐酸,增大了[H+],平衡左移,浅绿色加深。
【正解】加入少量盐酸后,溶液中存在较多的Fe2+、NO-3、H+,准确来说应该是亚铁离子与硝酸根离子间的氧化还原反应,虽然有氢离子参与,但没有发生电子的转移。要发生氧化还原反应而不能大量共存,使Fe2+转变为Fe3+,从而溶液的颜色变黄。
【例4】对于mA(气)+nB 幑幐pC(气)+qD(A和C为无色)的平衡,若增加B的量,平衡体系颜色加深,说明B一定为气体吗?
【错解】许多同学出现错解的原因基于这样的理解:增大固体物质的量,平衡也会移动。这样,本题B若为固体,D为有色气体,增加B反应生成D更多,也可使气体颜色加深,故推断不正确。
【正解】上述错解错在混淆了物质的量与浓度的概念。本题中如果B为固体,增加B的量,因固体物质的浓度为常数,平衡不移动,颜色不会变。故只有当B为气体时,B或D至少有一种为有色气体,增加B的量,平衡体系的颜色加深,故推断正确。
【例5】在密闭容器中发生如下反应:mA(g)+nB(g)幑幐pC(g)达平衡后,在温度一定时,将气体体积缩小到原来的一半;当达到平衡后,C的浓度为原来的1.9倍。若压缩时温度保持不变,试指出平衡如何移动?
【错解】由于C的浓度为原来的1.9倍,平衡向正反应方向移动。
【正解】在温度一定时,将气体体积缩小到原来的一半,若不考虑平衡的移动,此时C的浓度增大到原来的2倍;现C的浓度只为原来的1.9倍,其浓度已减小,所以平衡向逆反应方向移动。
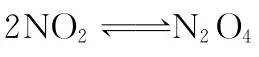
【错解】(1)平衡向右移动;(2)因通入N2O4,平衡左移,所以NO2的体积分数将增大。
【正解】该题第一问较容易,通入N2O4瞬间逆反应速率迅速增大,正反应速率不变,故平衡左移。第二小题则是一个两难选择,因平衡左移,NO2的量增加,但N2O4的量也增大,NO2体积分数的变化难于断定。为此可运用等效平衡思想求解。
假定原容器中的平衡由通入1m o l N2O4而建立,把再通入1m o l N2O4看成在同样容器中建立相同的平衡,则两容器中的NO2体积分数相同,当把两个平衡体系合二为一时,因容器体积不变,所以增大压强,平衡右移,NO2体积分数减小。若再通入的为2m o l NO2,不难得出,平衡右移,NO2体积分数同样也是减小。
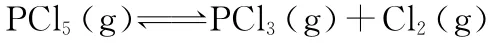
【错解】充入1m o l气态P C l5,P C l5的浓度增加,平衡向正反应方向移动,P C l5的转化率增大。
【正解】假设把后充入的1m o l气态P C l5,先放入与前面条件完全相同的容器中达到平衡,二者为等效平衡;然后将后者压入前面容器中,这就相当于增大了压强。根据平衡移动原理,平衡向逆反应方向移动,即P C l5的转化率减小。
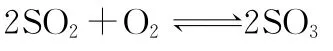
【错解】加入N2后,平衡体系压强增大,向体积减小的方向移动,故S O3的浓度增大。
【正解】上述错解没有抓住压强必须通过浓度的改变来影响平衡的移动。虽然充N2后压强增大了,但体积不变,各物质浓度不变,正逆反应速率不变,平衡不移动。故S O3浓度不变。

【错解】选A(或B)。
【错解】四个容器中的A的转化率大小次序为丙>甲>丁>乙。
【解析】甲与乙相比,我们可以把甲中的A先取出1m o l,使甲与乙完全相同,然后再往甲中充入1m o l A,则后充入的1m o l A,因为B的量减少及容器内压强增大,转化的量没有起始的1m o l多,所以甲小于乙;解答本题的难点在于乙与丙相比,可将丙先拆成两份:即1m o l A,1m o l B(与乙对应的等效平衡),每份中A的转化率与乙相同,然后把这相同的两份合并,因容积固定,则压强增大使平衡向体积缩小的方向移动(向生成A的方向移动),A的转化率减小,即丙小于乙;丙与甲相比,相当于在甲中再充入1m o l B,平衡正移,丙大于甲;同理可说明丁大于乙。故正确次序为丁>乙>丙>甲。求解此类问题应注意反应容器是否是固定容积的容器。
(作者单位:安徽省灵璧县黄湾中学)
