一种高效省时的利用磷酸钙转染DNA的改进方法
2016-03-17傅吉强张庆华
黄 进,傅吉强,张庆华*
(同济大学a.生命科学与技术学院,b.医学院,中国 上海 200092)
一种高效省时的利用磷酸钙转染DNA的改进方法
黄进a,傅吉强b,张庆华a*
(同济大学a.生命科学与技术学院,b.医学院,中国 上海200092)
摘要对传统磷酸钙转染方法进行改进,即在经胰酶消化处理成悬浮状态的293T细胞悬液中直接加入磷酸钙转染试剂,而不需待其贴壁后再加转染试剂进行转染.通过比较悬浮和贴壁状态下293T细胞的转染效率、细胞增殖和荧光强度等指标,发现这两种转染方法的各项指标没有显著性差异.结果表明,293T细胞在悬浮状态下进行磷酸钙转染与传统的贴壁转染能够达到同等效果,在用胰酶消化的单细胞悬液中直接加入磷酸钙转染试剂进行转染,不影响细胞的转染效果,节省了操作步骤,缩短了操作时间.
关键词293T细胞;磷酸钙;贴壁状态;悬浮状态;细胞转染
An Efficient and Time-Saving Method for DNA Transfection Using Calcium Phosphate
HUANGJina,FuJi-qiangb,ZHANGQing-huaa*
(a.School of Life Science and Technology, b.School of Medicine, Tongji University, Shanghai 200092, China)
AbstractThe use of calcium phosphate for the transfection of adherent cells was a traditional and popular yet complicated and time-consuming method. In this paper, this traditional method is further improved through the direct addition of calcium phosphate transfection reagent into the trypsinized 293T cell suspension solution, instead of adding transfection reagent after the cells were adhered to the bottom. By comparison with such indicators as transfection efficiency, cell proliferation and fluorescence intensity of 293T cells in suspended status and adherent status, we found no significant difference between the two transfection methods with regard to these indicators. Based on the results from this work, the use of calcium phosphate in transfecting 293T cells in suspended status could be same efficient and effective as the traditional adherent transfection method. With the transfection efficiency unaffected, our method of directly adding calcium phosphate transfection reagent into the trypsinized single-cell suspension solution is not only experimentally simplified in procedure but also time-saving in operation.
Key words293T cells; calcium phosphate; adherent status; suspended status; cell transfection
目前有多种细胞转染方法,例如脂质体转染法[1]、基因鸟枪法、电穿孔法[2]、显微注射法[3]和磷酸钙共沉淀法等.脂质体转染法虽然操作简单,转染效率较高,但脂质体价格昂贵,且细胞毒性较大;基因鸟枪法速度快,简单易行,成本较低,但不适用于真核细胞;电穿孔法转染效率高,但所需仪器较贵,对细胞损伤较大;显微注射法整合效率高,不需载体,但需精密仪器,技术难度大,且价格昂贵;磷酸钙转染所需材料价格低廉,操作简单,转染效率高,适用范围广,且细胞毒性较低.所以,在很多DNA转染细胞实验中,多用磷酸钙作为转染试剂.
利用磷酸钙将携带有外源基因的质粒DNA转染到哺乳动物细胞,是一种操作简单且应用广泛的方法[4].磷酸钙共沉淀是基于磷酸钙-DNA复合物的转染方法,在DNA的转染过程中,磷酸钙-DNA复合物黏附到细胞膜上并通过胞吞作用进入靶细胞[5],被转染的DNA随即整合到靶细胞的染色体中,从而产生有不同基因型和表型的稳定克隆.这种方法不仅适用于多种细胞,而且还具有生物相容性和降解性[6].磷酸钙与DNA形成的复合物颗粒太大或太小都会影响细胞转染效率.在磷酸钙与DNA的混合过程中,虽然在大部分的弱碱性范围内都会形成复合物颗粒,但只有在较短的孵育时间(例如1 min)、极小的pH范围内形成的颗粒才能很好地被细胞摄取,从而获得较高的转染效率[7].
通常利用磷酸钙转染293T细胞是在铺板并待其贴壁以后进行.但是在贴壁转染时,只有暴露于培养基的上半部分细胞表面可以直接接触到磷酸钙-DNA复合物.进行大规模细胞转染时,需要在转染前一天进行细胞铺板,操作繁琐且耗时[8].而细胞在悬浮状态下直接进行转染时,细胞和磷酸钙-DNA复合物都均匀分散于培养基中,293T细胞和磷酸钙-DNA复合物同时沉降,在细胞贴壁的过程中,整个细胞表面(包括贴于培养皿的下半部分细胞表面)都会附着磷酸钙-DNA复合物.所以相对来说,悬浮状态下进行细胞转染可以使细胞表面附着更多的磷酸钙-DNA复合物,保证其能摄入足量的磷酸钙-DNA复合物颗粒.因此,可以在贴壁细胞经胰酶消化成悬浮状态之后、细胞铺板之前的足量细胞悬液(例如铺10个dish)中直接加入孵育好的磷酸钙-DNA复合物,立即混匀,即进行悬浮转染,然后依次铺板.这种方法合并了细胞铺板和细胞转染过程,省去了贴壁转染时逐个平皿滴加磷酸钙-DNA复合物的过程(这个过程耗时长,磷酸钙-DNA复合物颗粒很容易过大而影响转染效果).所以,悬浮转染比传统的贴壁转染操作更简便、更省时且适合大规模操作[9].本研究基于磷酸钙转染细胞的以上特点,对比293T细胞在悬浮和贴壁状态下的转染效率、细胞增殖和荧光强度等指标,从而获得了比传统贴壁转染更加简便省时且高效的293T细胞磷酸钙转染方法,即悬浮转染.
1材料与方法
1.1材料
1.1.1菌种与质粒大肠杆菌菌株Dpα,包装质粒psPAX2,包膜蛋白质粒pMD2G,载体质粒pRRL-EF1α-eGFPLuc-WPRE,同济大学附属上海市肺科医院临床转化中心实验室保存.
1.1.2细胞株人肾胚胎(human embryonic kidney, HEK)293T细胞,同济大学附属上海市肺科医院临床转化中心实验室保存.
1.1.3试剂各种限制性内切酶购自美国New England Biolabs公司,达尔伯克改良伊格尔培养基(Dulbecco’s Modified Eagle’s Medium, DMEM) 购自美国Invitrogen Gibco公司,胎牛血清(Fetal Bovine Serum,FBS)购自美国Invitrogen Gibco公司,青霉素和链霉素溶液(以下简称双抗)购自美国Hyclone公司,聚凝胺(Polybrene)购自美国Sigma-Aldrich公司,0.25%Typsin-EDTA购自美国Invitrogen Gibco公司,氯化钙购自国药集团.
1.2方法
1.2.1载体质粒pRRL-EF1α-eGFPLuc-WPRE的设计载体质粒pRRL-EF1α-eGFPLuc-WPRE(如图1)有5′端呼吸道荷包病毒长末端重复序列5′RSV-LTR,剪接供体SD,病毒颗粒蛋白表达调节因子应答件RRE,剪接受体SA,中央多嘌呤序列cPPT,长启动子EF1α,增强型的绿色荧光蛋白eGFP,荧光素酶Luciferase,土拨鼠肝炎病毒转录后调控元件WPRE和3′端长末端重复序列等系列元件组成.运用BamHⅠ和SpeⅠ等限制性内切酶和DNA重组技术将目的基因eGFP-Luciferase克隆到慢病毒载体质粒上.
1.2.2瞬时转染取293T细胞铺于6孔板中,每孔2×105个细胞,共分3组,每组3个重复样孔,并编号,第1组为对照组,第2组为贴壁转染组,第3组为悬浮转染组,用含有双抗(青霉素终浓度为0.833 mkat/L(即50 U/mL),链霉素终浓度为50 g/L)的完全DMEM培养基(含10%FBS)2 mL进行培养.24 h后,将第3组孔中细胞用200 μL胰酶消化1 min,然后加DMEM完全培养基终止,使细胞成悬浮状态.第2组和第3组同时进行质粒的磷酸钙转染,首先每孔按照100 μL ddH2O,15 μL 2 mol/L CaCl2和2 μg载体质粒的量放于EP管中,并混匀,然后将等体积2×Hebs加入EP管中(需在液面以下加,边加边混匀,不超过20 s),静置30 s,随即将磷酸钙-DNA复合物悬液贴液面均匀散开加入到相应孔中,然后将6孔板放入细胞培养箱进行培养.30 min后,在40倍光学显微镜下观察6孔板培养基中沉淀大小及密度,然后再次将6孔板放回细胞培养箱培养.转染12~16 h后,每孔用2 mL新鲜DMEM完全培养基换液处理.
1.2.3病毒包装用三质粒系统转染293T细胞制备疱疹性口炎病毒的包膜糖蛋白(vesicular stomatitis virus envelope glycoprotein, VSV-G)假型慢病毒颗粒[10].取293T细胞铺于6孔板中,每孔1×106个细胞,共3组,每组3个重复样孔,并编号,第1组为对照组,第2组为贴壁转染组,第3组为悬浮转染组,用含有双抗的完全DMEM培养基(浓度同1.2.2)2 mL进行培养.24 h后,将第3组孔中细胞用200 μL胰酶消化1 min,然后加DMEM完全培养基终止,使细胞成悬浮状态.将第2组和第3组进行质粒的磷酸钙转染,首先将每孔按照100 μL dd H2O,15 μL 2 mol/L CaCl2,0.75 μg psPAX2,0.5 μg pMD2G和2 μg载体质粒的量放于EP管中,并混匀,然后将等体积2×Hebs加入EP管中(需在液面以下加,边加边混匀,不超过20 s),静置30 s,随即将磷酸钙-DNA复合物悬液贴液面均匀散开加入到相应孔中,然后将6孔板放入细胞培养箱进行培养.30 min后,在40倍光学显微镜下观察6孔板培养基中沉淀大小及密度,然后再次将6孔板放回细胞培养箱培养.转染12~16 h后,每孔用2 mL新鲜DMEM完全培养基换液处理.转染48 h后,分别收集6孔板中每孔的培养基于1.5 mL EP管中,2 000 r/min离心5 min使细胞碎片沉于管底.
1.2.4病毒感染取293T细胞铺于6孔板中,每孔1×106个细胞,共分3组,每组3个重复样孔,并编号,第1组为对照组,第2组为贴壁包装病毒感染组,第3组为悬浮包装病毒感染组,用含有双抗的完全DMEM培养基(浓度同1.2.2)2 mL进行培养.24 h后,吸去每孔的培养基,将1.2.3步骤收集的上清液依次贴孔壁缓慢加入到相应的孔中,组别应与1.2.3步骤中组别一一对应,即第1组每孔加1.5 mL对照组培养上清,第2组每孔加1.5 mL贴壁转染组病毒上清,第3组每孔加1.5 mL悬浮转染组病毒上清,然后将6孔板放入细胞培养箱继续培养.
1.2.5细胞计数在质粒瞬时转染48 h后,病毒包装48 h后和病毒感染48 h后,分别用200 μL胰酶消化相应细胞,然后将10 μL细胞悬液与10 μL 0.4%台盼兰染液进行混合,取10 μL混合液滴加于血球计数板盖玻片边缘,使混合液缓缓渗入血球计数室内,在10倍光学显微镜下计数,比较第1组、第2组和第3组之间细胞增殖情况.
1.2.6流式细胞检测在进行1.2.5步骤细胞计数的同时,收取足量细胞利用BD流式细胞仪在FITC通道中进行流式分析.
1.2.7荧光成像在细胞计数和流式分析前,将质粒瞬时转染48 h后,病毒包装48 h后和病毒感染48 h后的6孔板细胞置于荧光倒置显微镜下进行荧光成像检测.
1.2.8统计学分析采用SPSS 20.0统计学软件,实验数据以均数±标准差表示,样本以t检验分析其统计学意义,当P<0.05时,判定具有显著性差异.
2结果
2.1磷酸钙-DNA复合物沉淀颗粒观察
293T细胞在贴壁状态和悬浮状态下瞬时转染30 min后,在40倍光学显微镜下观察磷酸钙-DNA复合物颗粒的形成状况(如图2),发现两种状态下的细胞培养基中磷酸钙-DNA复合物颗粒大小适中,分布均匀,并且颗粒在培养基中不停地颤动.当这些复合物颗粒附着于细胞表面以后,会以胞吞的形式被摄入胞内.
2.2贴壁和悬浮状态下293T细胞的瞬时转染效果比较
细胞转染48 h以后,分别对两种状态下转染的细胞进行流式分析(如图3),每组进行3次独立重复实验.发现贴壁状态下转染的第2组转染效率为91.3%±1.2%,在悬浮状态下转染的第3组转染效率为89.5%±1.5%,第2组和第3组经统计学分析比较,P>0.05,没有显著性差异,说明在悬浮状态下细胞转染效率与贴壁状态一致,两组转染效率均较高,达到了细胞转染实验所需要求.瞬时转染48 h以后,对照组、贴壁转染组和悬浮转染组的细胞数分别为(1.24±0.18)×106/mL,(9.13±0.18)×105/mL和(9.25±0.35)×105/mL.每组进行3次独立重复实验,B组和C组经统计学分析比较,P>0.05,没有显著性差异.由于转染试剂对细胞本身有毒性作用,导致实验组细胞数目略低于对照组,但贴壁转染组和悬浮转染组细胞计数没有统计学差异,说明在悬浮状态下进行细胞转染对细胞增殖没有影响.将6孔板置于10倍荧光倒置显微镜下进行荧光成像(如图4,彩图见封三),可见贴壁转染组和悬浮转染组细胞阳性率均较高,且两组荧光强度相近.通过流式分析发现,贴壁转染组和悬浮转染组荧光强度分别为(3.23±0.08)×106和(3.02±0.15)×106,悬浮状态下进行细胞转染的荧光强度与贴壁状态下转染细胞的荧光强度对比,P>0.05,没有显著性差异.根据以上结果得出,293T细胞在悬浮状态下进行磷酸钙转染并不影响细胞的转染效果,且转染效率高,荧光强度好,满足了细胞转染实验的要求.

A:贴壁细胞;B:悬浮细胞A: adherent cells; B suspended cells图2 两种细胞状态下磷酸钙-DNA复合物颗粒形成状况Fig.2 The distribution of calcium phosphate-DNA complex in two status of cells
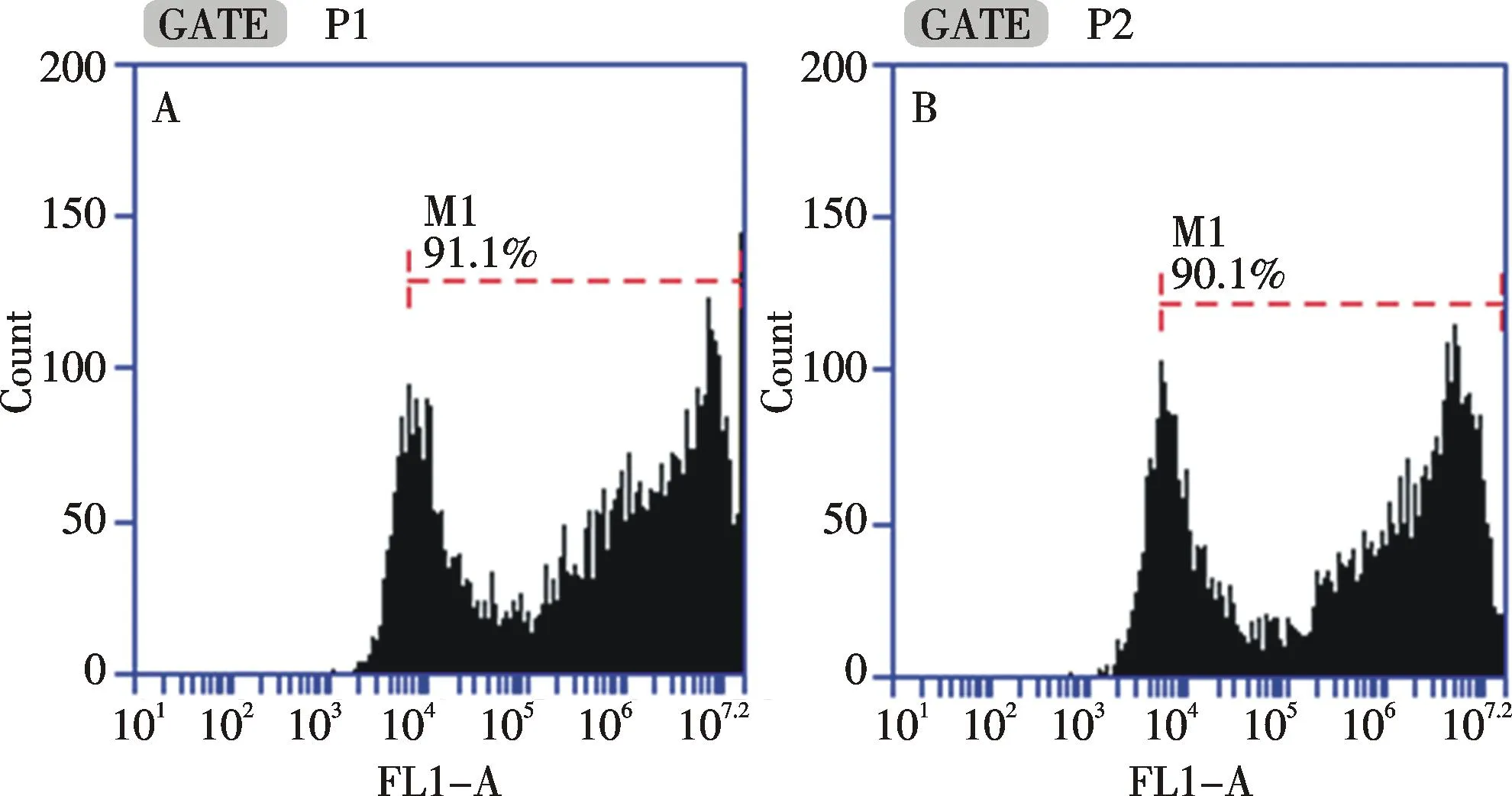
A:贴壁转染组;B悬浮转染组A: Cell transfection in adherent status; B: Cell transfection in suspended status图3 两种细胞状态下的细胞瞬时转染流式检测Fig.3 Flow cytometry of cell transient transfection in two status

A:对照组明场图;B:对照组荧光图;C:贴壁转染组明场图;D:贴壁转染组荧光图;E:悬浮转染组明场图;F:悬浮转染组荧光图A: Bright filed image of the control group; B: Fluorescence image of the control group; C: Bright filed image of the adherent transfection group; D: Fluorescence image of the adherent transfection group; E: Bright filed image of the suspended transfection group; F: Fluorescence image of the suspended transfection group图4 瞬时转染48 h后的细胞荧光成像Fig.4 Fluorescence image after 48 h of transient transfection
2.3贴壁和悬浮状态下的病毒包装及病毒感染效果比较
以磷酸钙为转染试剂,在贴壁和悬浮状态下进行三质粒系统的病毒包装,每组进行3次独立重复实验.转染48 h后,对细胞进行流式分析(如图5)和计数.流式检测发现,贴壁和悬浮状态下转染后的细胞转染效率为94.6%±1.7%和96.5%±2.1%.通过细胞计数得到对照组、贴壁转染组和悬浮转染组的细胞数分别为(5.65±0.21)×106/mL,(3.55±0.07)×106/mL和(3.60±0.14)×106/mL,贴壁转染组和悬浮转染组细胞数经统计学分析,P>0.05,没有显著性差异.同时,收集病毒上清感染293T细胞,每组进行3次独立重复实验.感染48 h后,细胞感染效率分别为50.9%±1.3%和48.1%±1.6%(如图6),对照组、贴壁包装感染组和悬浮包装感染组细胞数分别为(3.98±0.04)×106/mL,(4.00±0.07)×106/mL和(3.99±0.08)×106/mL.三组细胞数经统计学分析,P>0.05,没有显著性差异.每组进行3次独立重复实验.通过荧光成像检测发现,贴壁包装感染组和悬浮包装感染组细胞阳性率均较高,荧光强度较高(如图7,彩图见封三).通过流式分析发现,贴壁包装感染组和悬浮包装感染组细胞荧光强度为(1.77±0.37)×105和(2.04±0.30)×105,两组细胞荧光强度经统计学分析,P>0.05,没有显著性差异.根据以上结果,转染48 h后,贴壁和悬浮状态下进行病毒包装的细胞转染效率均达到90%以上,且没有统计学差异;贴壁包装和悬浮包装得到的病毒感染效率均较高,细胞阳性率可达50%,且没有统计学差异.因此,293T细胞在悬浮状态下进行病毒包装得到的病毒和贴壁状态包装得到的病毒感染效果一致.

A:贴壁转染组;B悬浮转染组A: Cell transfection in adherent status; B: Cell transfection in suspended status图5 两种细胞状态下的病毒包装流式检测Fig.5 Flow cytometry of virus packaging in two status

A:贴壁状态下包装得到的病毒液感染效率;B:悬浮状态下包装得到的病毒液感染效率A: Infection efficiency of viruses obtained in adherent status; B: Infection efficiency of viruses obtained in suspended status图6 两种细胞状态下包装得到的病毒液感染293T细胞48 h后的流式检测Fig.6 Flow cytometry of 293T cells infected by viruses obtained in different status after 48 h

A:对照组荧光图;B:贴壁包装病毒感染荧光图;C:悬浮包装病毒感染荧光图A: Fluorescence image of the control group; B: Fluorescence image of the infection of virus packaged in adherent status; C: Fluorescence image of the infection of virus packaged in suspended status图7 病毒感染48 h后的细胞荧光成像Fig.7 Fluorescence image after 48 h of virus infection
3讨论
磷酸钙共沉淀法是Graham等[11]于1973年建立的,利用细胞的内吞作用将磷酸钙-DNA复合物摄入细胞[12-13],虽然磷酸钙转染试剂对细胞也有一定毒性[14],但其毒性较弱,因此该法常作为常规方法用于多种细胞的基因转染,且转染效率高,可获得短暂或长期表达.细胞的磷酸钙转染是一项相对复杂的过程,且中间操作环节不能有效控制,所以很容易导致细胞转染效率时高时低.在转染过程中,如果能有效掌握操作的关键点,比如溶液的pH值、颗粒的大小、质粒DNA的用量、培养基中的细胞数目等,将会极大地提高细胞的转染效率[15].由于传统磷酸钙转染贴壁细胞过程较为复杂,操作不当很容易使转染效率降低.因此,本实验将磷酸钙转染过程进行进一步优化与改进,将贴壁细胞处理成悬浮状态,分别从细胞转染效率、细胞增殖和荧光强度等方面评估细胞在贴壁和悬浮状态下的转染效果,对比发现在两种状态下细胞的转染效果没有明显差别,且转染效率高、荧光强度好,悬浮状态转染完全可以满足实验需要.所以,在磷酸钙转染293T细胞过程中,可以在细胞传代铺板的同时,直接在细胞悬浮状态下进行转染,这样能有效缩短实验周期,操作也更为简便,且有利于进行大规模细胞转染实验.
参考文献:
[1]RECILLAS-TARGA F. Multiple strategies for gene transfer, expression, knockdown, and chromatin influence in mammalian cell lines and transgenic animals[J]. Mol Biotechnol, 2006,34(3):337-354.
[2]POTTER H, HELLER R. Transfection by electroporation[M]. Neuroscience: Wiley Online Library, 2011.
[3]ROSEN J N, SWEENEY M F, MABLY J D. Microinjection of zebrafish embryos to analyze gene function[J]. J Vis Exp, 2009(25):1115.
[4]CHEN C, OKAYAMA H. High-efficiency transformation of mammalian cells by plasmid DNA[J]. Mol Cell Biol, 1987,7(8):2745-2752.
[5]GIGER E V, CASTAQNER B, RAIKKONEN J,etal. SiRNA transfection with calcium phosphate nanoparticles stabilized with PEGylated chelators[J]. Ad Healthc Mater, 2013,2(1):134-144.
[6]JORDAN M. Transient gene expression in mammalian cells based on the calcium phosphate transfection method[J]. Cell Eng, 2000,2:56-79.
[7]JORDAN M, WURM F. Transfection of adherent and suspended cells by calcium phosphate[J]. Methods, 2004,33(2):136-143.
[8]SONG W, LAHIRI D K. Efficient transfection of DNA by mixing cells in suspension with calcium phosphate [J]. Nucleic Acids Res, 1995,23(17):3609-3611.
[9]GIRARD P, JORDAN M, TSAO M,etal. Small-scale bioreactor system for process development and optimization[J]. Biochem Eng J, 2001,7(2):117-119.
[10]DEMAISON C, PARSLEY K, BROUNS G,etal. High-level transduction and gene expression in hematopoietic repopulating cells using a human immunodeficiency[correction of immunodeficiency] virus type1 based lentiviral vector containing an internal spleen focus forming virus promoter[J]. Hum Gene Ther, 2002,13(7):803-813.
[11]GRAHAM F L, VAN DER EB A J. Transformation of rat cells by DNA of human adenovirus 5[J].Virology, 1973,54(2):536-539.
[12]ALAM J, COOK J L. Reporter genes: application to the study of mammalian gene transcription[J]. Anal Biochem, 1990,188(2):245-254.
[13]CHEN C A, OKAYAMA H. Calcium phosphate-mediated gene transfer: a highly of ficient transfection system for stably transforming cells with plasmid DNA[J]. Biotechniques, 1988,6(7):632-38.
[14]FENG L, GUO M, ZHANG S,etal. Optimization of transfection mediated by calcium phosphate for plasmid rAAV-LacZ (recombinant adeno-associated virus-beta-galactosidase reporter gene)production in suspension-cultured HEK-293 (human embryonic kidney 293) cells[J]. Biotechnol Appl Biochem, 2007,46(Pt2):127-135.
[15]JORDAN M, KOHNE C, WURM F M. Calcium-phosphate mediated DNA transfer into HEK-293 cells in suspension: control of physicochemical parameters allows transfection in stirred media.Transfection and protein expression in mammalian cells[J]. Cytotechnology, 1998,26(1):39-47.
(编辑WJ)
中图分类号Q813.1
文献标识码A
文章编号1000-2537(2016)01-0018-06
*通讯作者,E-mail:qinghua_zhang@shbiochip.com
基金项目:国家自然科学基金资助项目(81272325);上海市浦江人才计划资助项目(12PJ1433700)
收稿日期:2015-04-28
DOI:10.7612/j.issn.1000-2537.2016.01.004
