DPC4和Smurf2在子宫内膜腺癌中的表达及临床意义
2016-03-15蔡阳阳梁丽丹袁红瑛
张 新,何 涛,蔡阳阳,梁丽丹,袁红瑛
·基础医学·
DPC4和Smurf2在子宫内膜腺癌中的表达及临床意义
张新1,何涛1,蔡阳阳1,梁丽丹1,袁红瑛2
摘要:目的检测胰腺癌缺失基因(DPC4)及Smad泛素化调节因子2(Smurf2)在增殖期子宫内膜、子宫内膜不典型增生及子宫内膜腺癌组织中的表达,探讨两者与子宫内膜腺癌发生发展的关系。方法采用免疫组化SP法检测DPC4和Smurf2在上述3种组织中的表达情况,并结合年龄、病理分期、组织学分级、肌层浸润深度及淋巴结转移等临床特征进行相关性分析。结果与增殖期子宫内膜表达相比在子宫内膜腺癌中,DPC4呈低表达,而Smurf2呈高表达(均P<0.05),两者呈负相关(r=-0.525,P<0.05),两因子在子宫内膜腺癌中的表达均与其病理分级和临床分期相关(均P<0.05),而与淋巴结转移、癌肿浸润肌层深度及年龄无关(均P>0.05)。结论DPC4和Smurf2均与子宫内膜腺癌的发生发展相关,两者均与其病理分级和临床分期有关,而与淋巴结转移及癌肿浸润肌层深度无关,可作为肿瘤恶性程度及预后指标。
关键词:子宫内膜腺癌;DPC4;Smurf2;免疫组化
作者单位:1.河南科技大学第一附属医院,河南洛阳 471003
2.河南科技大学医学院,河南洛阳 471003
子宫内膜腺癌是发生于子宫内膜的一组上皮性恶性肿瘤,占女性生殖道恶性肿瘤的 20%~30%[1],在美国位居女性恶性肿瘤第4位,而在我国发病率居妇科恶性肿瘤第2位,并且发病人群也越来越年轻[2]。虽然有外科手术、放疗、化疗等、治疗手段,但针对肿瘤复发,对放疗和化疗抵抗的患者,仍然迫切需要替代疗法[3]。因而,针对肿瘤标志物或信号通路的靶向分子治疗策略逐渐成为研究热点[4]。本研究收集河南科技大学第一附属医院手术切除子宫内膜石蜡标本91例,应用免疫组化技术比较胰腺癌缺失基因(deleted in pancreatic cancer locus 4,DPC4)和Smad泛素化调节因子2(smad ubiquitin regulatory factor 2,Smurf2)在子宫内膜腺癌表达情况,探讨两者与子宫内膜腺癌发生发展的关系。
1资料与方法
1.1一般资料收集河南科技大学第一附属医院2006年1月至2009年1月手术切除的子宫内膜标本91例。其中,子宫内膜腺癌石蜡标本53例,术前均未行放、化疗以及激素治疗,所有诊断均经手术后病理组织学确定。参照国际妇产科联盟(federation international of gynecology and obstetrics,FIGO) 2009年手术病理分期标准进行临床分期,Ⅰ~Ⅱ期35例,Ⅲ~Ⅳ期18例,其中高分化(G1)10例,中分化(G2)31例。低分化(G3)12例;肌层浸润深度<1/2肌层29例,≥1/2肌层24例;有淋巴结转移12例,无淋巴结转移21例;年龄<50岁24例,≥50岁29例。选取手术切除的增殖期子宫内膜组18例,子宫内膜不典型增生组20例作为对照组。
1.2方法每块石蜡标本持续切片5 μm,并通过免疫组化SP法(streptavidin-peroxidase,SP)检测,分别检测子宫内膜腺癌、子宫内膜不典型增生及增殖期子宫内膜组织中DPC4和Smurf2的表达。操作严格按照DPC4和Smurf2免疫组化试剂盒(北京博奥森公司)说明书进行,用PBS代替一抗作为阴性对照。结果判断标准:两因子阳性表达均位于胞质,根据染色程度和阳性细胞数综合计算评分。染色程度:未染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞数:10个随机高倍镜视野下无阳性细胞为0分,阳性细胞平均百分数<25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分。最后计算a+b之和0~3分为阴性,>4分为阳性。
1.3统计方法采用SPSS16. 0统计软件分析,计数资料采用百分比(%)表示,组间比较采用χ2检验及Spearman等级相关分析,以P<0.05为差异有统计学意义。
2结果
2.1DPC4在子宫内膜组织中的表达DPC4在53例子宫内膜腺癌中的表达率为33.96%,低于在18例增殖期子宫内膜组的88.89%(χ2=16.244,P<0.001)和20例不典型增生组的55.00%(χ2=2.684,P>0.05);3组比较χ2=16.533,P<0.001,差异有统计学意义。DPC4在增殖期子宫内膜组表达,见图1。DPC4在子宫内膜不典型增生组表达,见图2。
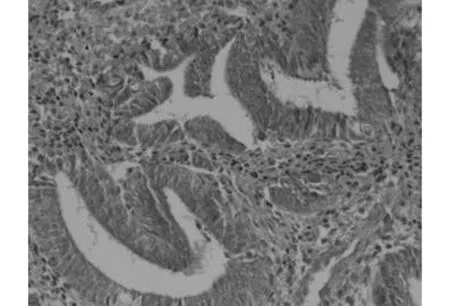
图1 DPC4在增殖期子宫内膜中的表达(SP,×200)

图2 DPC4在不典型增生子宫内膜中的表达(SP,×200)
2.2Smurf2在子宫内膜组织中的表达Smurf2在53例子宫内膜腺癌中的表达率为83.02%,高于在18例增殖期子宫内膜组的44.44%(χ2=10.201,P<0.05)和20例不典型增生组的60.00%(χ2=4.307,P>0.05);三组比较,差异有统计学意义(χ2=10.892,P<0.005)。Smurf2在子宫内膜不典型增生组表达,见图3。
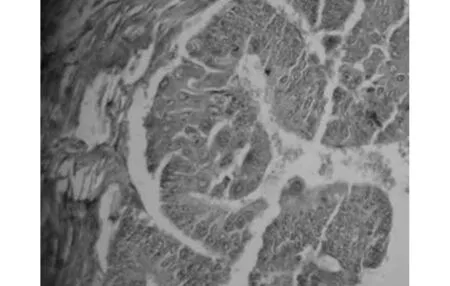
图3 Smurf2在不典型增生子宫内膜中的表达(SP,×200)
2.3DPC4和Smurf2在子宫内膜腺癌的表达DPC4在子宫内膜腺癌中的表达率与病理分级和临床分期呈负相关,在病理分级中的表达逐渐降低(χ2=6.489,P<0.05),随着临床分期的增高而降低,差异有统计学意义(χ2=6.346,P<0.05);而与淋巴结转移、癌肿浸润肌层深度及年龄无关(均P>0.05)。Smurf2在子宫内膜腺癌的表达与病理分级和临床分期呈正相关,在高分化、中分化和低分化分级中的表达逐渐增高(χ2=11.701,P<0.05);随着临床分期的增高而增高,差异有统计学意义(χ2=3.900,P<0.05);而与淋巴结转移、癌肿浸润肌层深度及年龄差异无统计学意义(P>0.05),见表1。DPC4与Smurf2在子宫内膜腺癌表达情况分别见图4、图5。
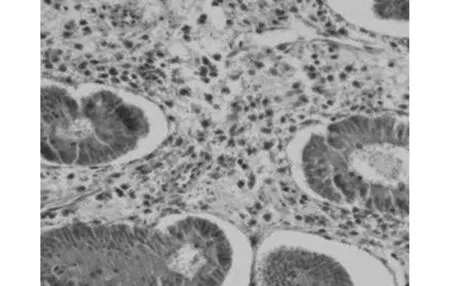
图4 DPC4在中分化子宫内膜腺癌中的表达(SP,×400)
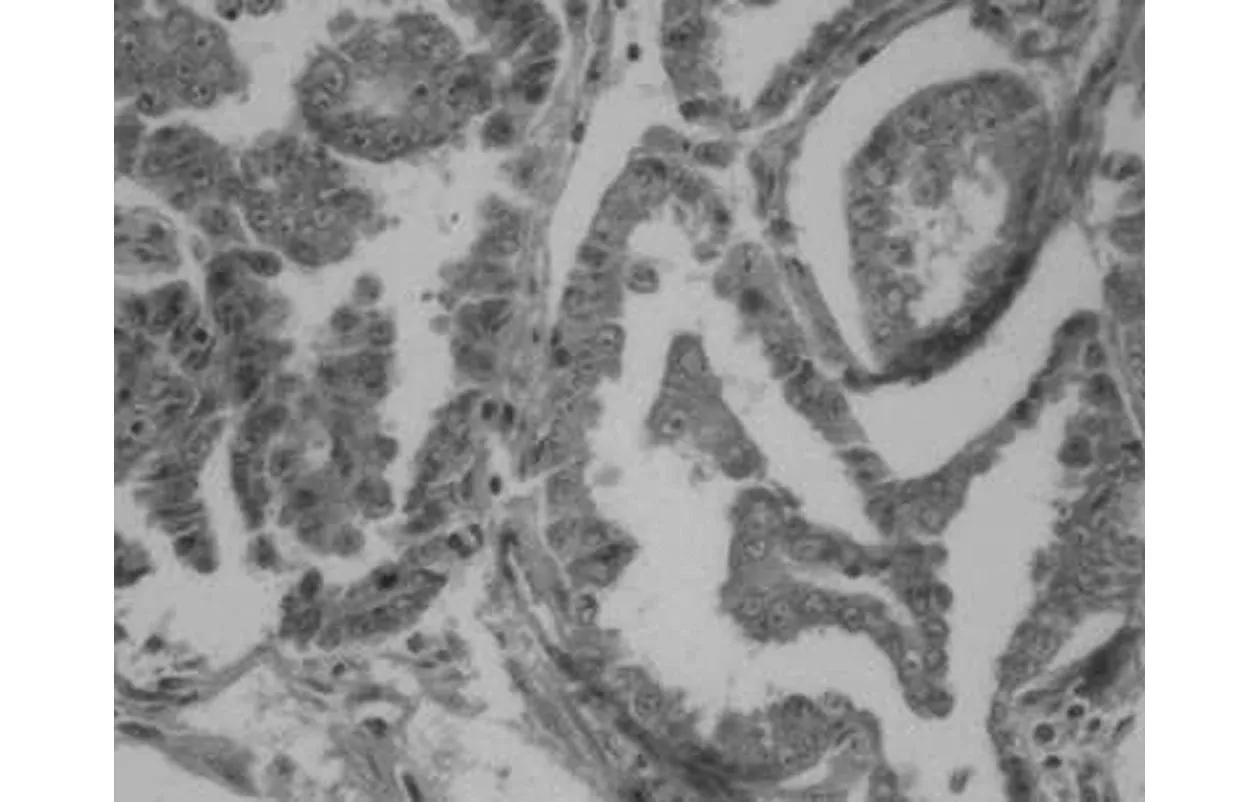
图5 Smurf2在中分化子宫内膜腺癌中的表达(SP,×400)

例(%)
2.4DPC4与Smurf2表达的关系在53例子宫内膜腺癌组织中,DPC4阳性表达18例,阴性表达35例;Smurf2阳性表达44例,阴性表达9例;DPC4和Smurf2共同阳性表达为10例,共同阴性表达为1例。采用Spearman等级相关分析,DPC4和Smurf2表达呈负相关(rs=-0.525,P<0.001)。
3讨论
子宫内膜腺癌是常见的恶性肿瘤,且发病年龄也越来越低,对女性的健康产生严重的影响。对子宫内膜腺癌复发、放疗和化疗抵抗的患者,肿瘤标志物或信号通路的靶向分子治疗策略逐渐成为研究热点。DPC4位于染色体18q21.1上,与胰腺癌的发生发展过程有极其密切的关系[5]。DPC4是胰腺癌发生发展中比较特异的肿瘤抑制基因[7],首先由Hahn等于1996年报道[6]。它编码的DPC4蛋白与果蝇的MAD(mather against pp-de-capentaplgic)和线虫的Smad2、Smad3、Smad4蛋白同源[8],所以DPC4亦称Smad4。Smad4是转移生长因子β(TGF-β)信号传导通路的中心分子[9],参与调节细胞的增殖分化与凋亡。经典的TGF-β,Smad依赖性信号通路,主要通过TGF-β结合于的TGF-βⅠ类受体(ALK-5)/Ⅱ类受体复合体,使Ⅰ类受体激活并产生磷酸化,促使Smad2、Smad3蛋白激活并磷酸化,后者与Smad4结合形成三聚体复合体。这种复合体进入并聚集于细胞核,调控靶基因的表达[10],抑制肿瘤细胞增殖。本研究中DPC4在子宫内膜腺癌组中的表达低于在增殖期子宫内膜组及不典型增生子宫内膜组,并与子宫内膜腺癌病理分级和临床分期相关,但DPC4的表达与淋巴结转移及癌肿浸润肌层深度无关,提示其可能在子宫内膜腺癌的发生发展中发挥重要作用。
Smurf2属于泛素蛋白水解酶途径中的E3泛素连接酶,TGF-β信号通路中Smad7又称为抑制性Smad蛋白[11],主要与激活后的TGF-β1类受体结合,并阻止信号在ALK-5至Psmad2/3与Smad4之间传递,而Smurf2主要存在于TGF-β信号通路中与Smad7结合,增强Smad7在TGF-β信号系统中的抑制效应,另一方面Smurf2介导Smad2、Smad3和Smad4三聚体复合体的降解,抑制TGF-β信号通路的活性[12],从而促进了肿瘤的发生发展。本研究中Smurf2在子宫内膜腺癌组中的表达高于增殖期子宫内膜组及不典型增生子宫内膜组,与病理分级和临床分期相关,也与淋巴结转移及癌肿浸润肌层深度无关,提示其也可能在子宫内膜腺癌的发生发展中发挥作用。
DPC4和Smurf2共同通过TGF-β信号传导通路调节肿瘤的发生发展,共同参与子宫内膜腺癌的发生发展,而且两者在子宫内膜腺癌的表达呈负相关,联合检测两个因子可能对子宫内膜腺癌的复发和预后提供检测指标。
参考文献:
[1]谢幸,苟文丽.妇产科学[M]. 8版.北京:人民卫生出版社,2013:313-317.
[2]Dowdy SC,Borah BJ,Bakkum-Gamez JN,et a1.Factors predictive of postoperative morbidity and cost in patients with endometrial cancer[J].Obstet Gynecol,2012,120(6):1419-1427.
[3]Kyo S, Maida Y, Inoue M. Stem cells in endometrium and endometrial cancer: accumulating evidence and unresolved questions[J].Cancer Lett ,2011,308 (2):123-133.
[4]Millis SZ,Ejadi S,Demeure MJ.Molecular profiling of refractory adrenocortical cancers and predictive biomarkers to therapy[J].Biomark Cancer,2015,7:69-76.
[5]李赞滨,孙大伟,邱法波,等.胰腺癌组织中MUC1和hTERT 及DPC4的表达及意义[J].中国现代普通外科进展,2013,16(11):850-854.
[6]Hahn SA,Schutte M,Hoque AT,et al.DPC4,a candidate tumor suppressor gene at human chromosome 18q21[J].Science,1996,271(5247):350-353.
[7]Perren A,Saremaslani P,Schmid S,et al.DPC4/Smad4: no mutations,rare allelic imbalances,and retained protein expression in pancreatic endocrine tumors[J],Diagn Mol Pathol,2003,12(4):181.
[8]Yingling JM,Datto MB,Wong C,et al.Tumor suppressor SMAD4 is transforming growth factor β-inducible DNA binding protein[J].Mol Cell Biol,1997,17(12) :19-28.
[9]王大东.DPC4基因与肿瘤[J].国外医学(生理、病理科学与临床分册),2000,20(3):169-172.
[10]潘大彬.探讨PDGF-BB对VSMCs内TGF-β-1及其信号系统的影响以及其调节VSMCs内PCNA表达的机制[D].南京医科大学第一附属医院,2007.
[11]Abd EI-Fattah AA,Sadik NA,Shaker OG,et al.Are Smad7 rs4939827 and CHI3L1 rs4950928 polymorphisms associate with colorectal cancer in Egyptian patients[J].Tumour Biol,2016,16:1-11.
[12]Li X,Diao Z,Ding J,et al.The downregulation of SnoN expression in human renal proximal tubule epithelial cells under high glucose conditions is mediated by an increase in Smurf2 expression through TGF-β1 signaling[J].Int J Mol Med,2015,31(10):415-422.
Expression and Clinical Significance of DPC4 and Smurf2 in Endometrial Carcinoma
ZHANG Xin1, HE Tao1, CAI Yang-yang1, LIANG Li-dan1, YUAN Hong-ying2
(1.First Affiliated Hospital,Henan University of Science and Technology, Luoyang 471003,China;2.Medical College,Henan University of Science and Technology, Luoyang 471003,China)
Abstract:ObjectiveTo detect the expression of deleted in pancreatic cancer locus (DPC4) and Smad ubiquitin regulatory factor 2 (Smurf2) in the normal endometrium, atypical hyperplasia and endometrial adenocarcinoma, and explore the relationship between the expression and the development of endometrial adenocarcinoma.MethodsThe immunohistochemistry of streptavidin-peroxidase method was used to detect the expression of DPC4 and Smurf2 in the endometrial tissue. The relationship were analyzed between the expression and clinical characteristics of age, pathological stage, differentiation degree, tumor invasive depth and lymph node metastasis. ResultsDPC4 was lowly expressed in endometrial adenocarcinoma, however Smurf2 was showed high expression (P<0.05). The expression of the two facters were a negative correlation in endometrial adenocarcinoma (r=-0.525, P<0.05). They were correlation with the pathological grade and clinical stage of endometrial adenocarcinoma (P<0.05), but not a relationship between the expression and lymph node metastasis, tumor invasive depth and age (P>0.05). ConclusionDPC4 and Smurf2 were correlation with the development of endometrial adenocarcinoma. The expression of two factors were correlation with the pathological grade and clinical stage, but not with lymph node metastasis,tumor invasive depth. It can be used as an indicator malignant degree and prognosis of endometrial adenocarcinoma.
Key words:endometrial adenocarcinoma;deleted in pancreatic cancer locus 4;smad ubiquitin regulatory factor 2;immunohistochemistry
通信作者:袁红瑛,女,教授,E-mail:125492984@qq.com
作者简介:张新(1987-),女,河南安阳人,医师,从事妇科肿瘤研究工作。
收稿日期:2016-01-02
中图分类号:R737.33
文献标志码:B
DOI:10.15926/j.cnki.issn1672-688x.2016.01.001
文章编号:1672-688X(2016)01-0001-04
