血液分析仪新型荧光血小板计数法的基本性能评价
2016-03-14崔晓阳冯春颜朱彩云张刘兵周卫
崔晓阳 冯春颜 朱彩云 张刘兵 周卫
血液分析仪新型荧光血小板计数法的基本性能评价
崔晓阳①深圳市龙华新区人民医院检验科 广东 深圳 518109冯春颜①朱彩云①张刘兵①周卫①

[摘要]目的:对XN3000血细胞分析流水线新型荧光血小板(PLT-F)计数法的基本性能进行评价。方法:对新型PLT-F计数的总重复性、精密度、携带污染率、线性稀释、抗红细胞碎片干扰以及与显微镜血小板(PLT-M)计数法的相关性等基本性能进行评估。同时进行鞘流电阻抗血小板(PLT-I)计数和光学血小板(PLT-O)检测。结果:总重复性为1.40%,平均批内精密度为1.36%,批间精密度为1.93%,携带污染率为0.00%~0.97%,均值为0.48%;在线性稀释试验中,测试值与理论值的相关系数(r)为0.999;PLT-F对红细胞碎片有较强的抗干扰能力;PLT-F血小板计数值与PLT-M结果相关性良好,且低值血小板组(PLT<100×109/L),3种检测方法的相关系数r值PLT-F>PLT-O>PLT-I。结论:PLT-F法精密度、准确度及线性较好,红细胞碎片的抗干扰能力强。低值血小板计数与PLT-M相关性好,优于PLT-I法。日常检验中使用PLT-I法计数血小板,若计数血小板异常减少或出现散点图异常干扰时,必须用显微镜计数法或PLT-F法进行复查。
[关键词]XN系列血液体液分析仪;血小板计数;性能评价
[First-author’s address] Department of Laboratory Medicine, People’s Hospital of New District Longhua Shenzhen, Shenzhen 518109, China.
XN3000血细胞分析流水线是由2台XN10全自动血液体液分析仪与1台SP10推片机组成。XN系列可定制化的全自动模块式血液体液分析系统,可提供全血模式33个报告参数和31个研究参数,体液模式6个报告参数和12个研究参数。XN系列血液体液分析仪改进和新增了一系列检测通道,包括用于测量白细胞分类(white cell differential channel,WDF)、测量有核白细胞(white cell nucleated channel,WNR)、嗜碱性细胞和红细胞、测量异常和(或)未成熟细胞及白细胞前体(white cell precursor channel,WPC)和用于荧光血小板(fluorescent platelet channel,PLT-F)计数通道。在血小板计数方法上,XN系列同时保留上一代XE系列血细胞分析仪鞘流电阻抗(impedance,PLT-I)法和光学(optics,PLT-O)法。PLT-F法采用新型核酸荧光染料并增加了血小板计数粒子量,使得血小板计数的准确性和精度得到进一步提高。本研究采用PLT-I、PLT-O和PLT-F的3种方法对血小板进行检测,并对3种检测方法的总重复性、精密度、线性范围、携带污染、抗红细胞碎片干扰以及与手工(manual,PLT-M)法相关性等性能进行评估[1]。
1 材料与方法
1.1 评价样本
选取门急诊患者、住院患者及体检者送检样本120例,其中各种病因引起PLT减少血样43例(100×109)/L。
1.2 仪器设备与试剂
采用日本Sysmex公司XN3000血细胞分析流水线,Olympus光学显微镜以及改良牛鲍计数板等。
Sysmex XN3000血细胞分析流水线试剂为原装配套试剂、配套全血质控品。血小板计数草酸铵法稀释液按《全国临床检验操作规程》第3版要求严格配制[2]。
1.3 检测方法
1.3.1 总重复性试验
随机选择高值、低值PLT样本5例,中值样本10例,在0 h、2 h和4 h时分别以PLT-I、PLT-O以及PLT-F方法进行测量[3];所得数据计算总重复性变异系数CV(%)值为公式1:

式中n为重复测定次数(本试验重复测定次数为3次);u为样本数;x-为均值。
1.3.2 批内精密度试验
随机选取低值、中值及高值PLT样本各1份,分别采用PLT-I、PLT-O以及PLT-F方法连续测量10次,分别计算标准差(SD)和变异系数CV(%)值。
1.3.3 批间精密度试验
选择省临检中心全血质控品1例,每日随常规样本进行检测,连续测量20 d,计算均值(x-)、SD和CV(%)值。
1.3.4 携带污染试验
高值PLT样本测量(H1、H2、H3)3次后,立即对低值样本进行重复测量(L1、L2、L3)3次后,计算携带污染率采用公式2:

1.3.5 线性稀释试验
选择PLT-M计数均值为482×109/L的血样1例,再以稀释度(5点法)计算值作为理论值,各稀释度以PLT-I、PLT-O和PLT-F的3种测试方法分别进行测量2次,取平均值与理论值作回归分析,并以100×109/L为界分组进行相关性分析。
1.3.6 红细胞碎片干扰试验
取血离心后,取红细胞层0.5 ml并加入蒸馏水破坏RBC,再次离心,用生理盐水洗涤3次后,稀释至5 ml,作为高浓度RBC碎片备用(实验时加20 μl至试验血样中);再取0.5 ml稀释至5 mL作为低浓度RBC碎片备用(实验时加20 μL至试验血样中);对照管中加等量生理盐水。最后,采用PLT-I、PLT-O和PLT-F测试方法进行测试,对照组和干扰组测试值作配对t检验。
1.3.7 相关性试验
随机抽取日常送检样本100例,采用PLT-I、PLT-O和PLT-F的3种测试方法分别进行测量2次,PLT-M由2名经验丰富,具有中级职称的检验师采用双盲法进行计数,结果取2人均值。以PLT-M法为参考方法,PLT-I、PLT-O及PLT-F测定值分别与PLT-M法进行相关性和线性回归分析。
1.4 统计学方法
采用SPSS 17.0软件处理所有数据,计数资料以均数±标准差(x-±s)表示,测试值作配对t检验。
2 结果
2.1 总重复性试验结果
采用PLT-I、PLT-O和PLT-F检测的3种方法总重复性分别为1.46%、1.53%和1.40%。
2.2 批内精密度结果
对低值、中值和高值3份不同浓度的血小板血样进行检测,3种方法在各水平上的血小板检测精密度均符合仪器范围(<4%),其结果见表1。

表1 PLT-I、PLT-O和PLT-F法批内精密度结果(x-±s)
2.3 批间精密度结果
连续20 d,每日同一时间段测定全血质控品,测试计算结果显示,PLT-I、PLT-O和PLT-F的3种检测方法的批间精密度分别为2.56%、2.14%和1.93%,符合仪器精密度宣称范围(<4%)。
2.4 携带污染试验结果
进行10组血小板高、低值样本携带污染实验,检测计算结果显示,PLT-I、PLT-O和PLT-F的3种检测方法的平均携带污染率分别为0.78、0.60和0.48,符合仪器精密度宣称范围(<1%)。
2.5 线性稀释试验
在PLT的3个浓度范围内,PLT-I、PLT-O和PLT-F的3种检测方法检测结果与理论值之间均有良好的相关性,其结果见表2。
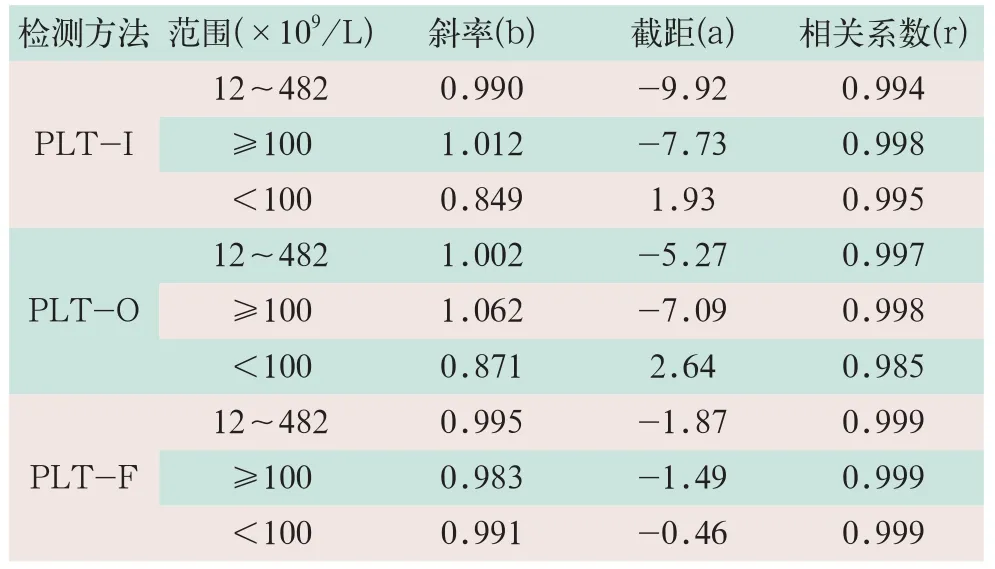
表2 PLT-I、PLT-O和PLT-F法线性稀释实验
2.6 红细胞碎片干扰试验
本研究共进行10组高浓度和低浓度RBC碎片干扰实验,3种检测方法的RBC碎片干扰组分别与对照组进行配对t检验,其结果见表3。
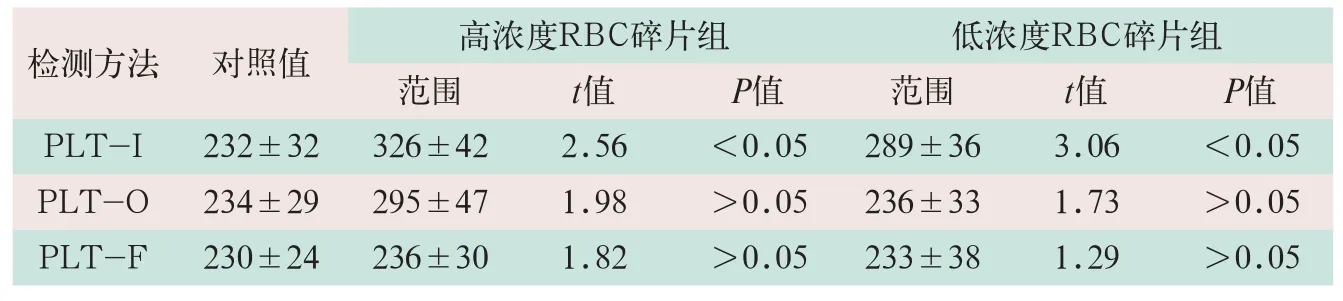
表3 PLT-I、PLT-O和PLT-F检测法红细胞碎片干扰实验(x-±s)
表3显示,PLT-I方法高浓度和低浓度RBC碎片组测定值与对照组之间的差异具有统计学意义(t=2.56,t=3.06;P<0.05);而PLT-O和PLT-F则有较强的抗RBC碎片干扰能力。
2.7 与手工法PLT-M相关性评价
随机选取100例血样分别进行PLT-I、PLT-O和PLT-F仪器法以及PLT-M手工法计数,将3种检测方法检测结果分别与PLT-M法进行相关性和线性回归分析。计数范围<100×109/L血样记为低值血小板组,单独进行回归分析,结果见表4。
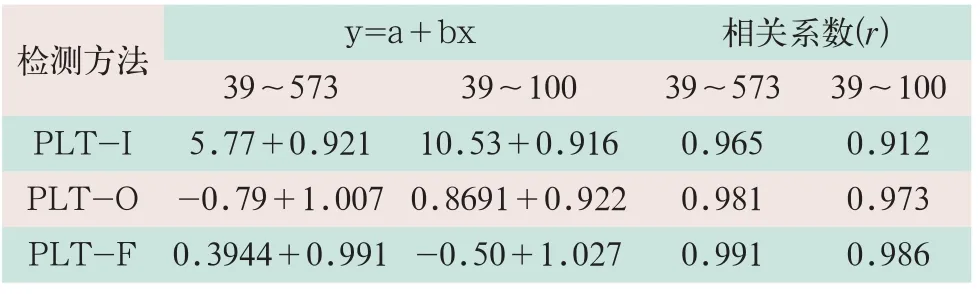
表4 3种检测法与PLT-M手工法相关性评价(x-±s)
表4显示,PLT-I、PLT-O和PLT-F的3种检测方法与手工法相关性良好。低值血小板组的r值PLT-F=0.986>PLT-O=0.973>PLT-I=0.912,表明血小板计数<100×109/L时,PLT-F法优于PLT-O法,这两种方法明显优于PLT-I法。
3 讨论
血小板由骨髓造血组织中的巨核细胞分化产生,具有维持血管内皮完整性以及粘附、聚集、释放、促凝和血管收缩等功能。血小板计数是临床止血和凝血检查最常用的筛查实验之一,其对出血性疾病、放射治疗及化疗患者的疗效监测具有重要参考价值,也是血液系统疾病诊断的重要指标之一[4]。
目前,计数血小板的方法主要有3类:①显微镜目视计数法。采用草酸铵溶液作溶血稀释液,在相差显微镜下肉眼直接计数血小板。该方法容易受到充池是否均匀、血小板在计数板上的分布等误差因素影响,不同医生之间计数变异系数可达10%~25%之间,已不适用于临床工作的需求[5];②流式细胞仪法。用荧光标记的血小板抗体CD61/CD41标记血小板,通过流式细胞仪检测荧光计数。流式细胞仪法准确度和精密度极高,是国际血液学标准委员会(ICSH)推荐的参考方法,也是我国卫生行业标准所规定的血小板计数的参考方法[6-7]。但该方法操作复杂、成本昂贵,因此难以在临床上推广使用,一般仅用于方法建立和仪器校准;③全自动血细胞分析仪法。因其具有测定速度快、重复性好及准确度高,能同时提供多项指标,是目前常规筛查PLT的主要方法[8]。
大部分全自动血细胞分析仪血小板计数原理是PLT-I,即在同一通道中通过颗粒大小来鉴别红细胞与血小板,PLT-I法每次可检测20~25万个细胞,理论上具有较好的准确性和重复性。然而,PLT-I法仅通过颗粒体积大小来识别检测血小板,易受非血小板颗粒(nonplatelet particles,NPPs),如小红细胞、红细胞碎片、白细胞碎片、细菌和真菌以及免疫复合物等干扰[9]。为了提高血小板计数的准确性,增强对NPPs的辨识能力,国内外各大血液分析仪厂商纷纷推出新的血小板计数方法,目前最具代表性的血小板光学计数法有[10]:①以西门子ADVIA®2120血液分析仪为代表的二维激光光散射计数法,此法主要检测原理是当血小板经过检测区时,利用测量双角度检测器接受激光光束照射细胞而产生散射光信号,低角度散射光(2~3o)用于测量细胞体积;高角度(5~15o)散射光测量血小板细胞的折射指数。二维激光光散射计数法能有效的鉴别某些NPPs,如红细胞碎片和小红细胞与血小板体积相似,但折射指数较大,在血小板散点图上分布在右下角,鬼影红细胞由于折射指数较小,则分布在左上角。然而,二维激光光散射计数法仍是单纯利用PLT的物理特性进行检测,其检测灵敏度和准确度均存在一定的局限[11];②以Sysmex XE 2100血液分析仪为代表的荧光光学血小板计数法,此法采用聚次甲基等核酸染料对血小板的RNA/DNA进行染色,在前向散射光-荧光强度的二维散点图上,对血小板进行检测计数,同时还可以提供未成熟血小板比率(IPF)等参数。此法对上述NPPs具有较强的抗干扰能力,且对低值血小板计数(100×109/L)检测的可靠性更高[12]。
XN系列是Sysmex公司最新推出的多参数全自动血液体液分析仪,采用了多种创新手段,增加了血细胞计数精度,改进了细胞分类和异常细胞识别报警能力[13]。PLT-F是XN系列血液体液分析仪新增的用于血小板计数的独立检测通道,应用了新型核酸荧光染料,使得血小板细胞在前向散射光和(或)荧光强度的二维散点图上更容易与其他细胞区分开。同时PLT-F法采用的5倍粒子计数量也在一定程度上提高了低值血小板计数的精度[14-15]。
本研究中PLT-I、PLT-O和PLT-F检测方法精密度指标:总重复性、批内和批间精密度变异系数均<4%,满足仪器宣称水平;3种检测方法平均携带污染率分别为0.78、0.60和0.48,均<1%,也符合厂商宣称水平;线性稀释实验表明,在一定范围内,PLT-I、PLT-O和PLT-F检测方法的3种检测值与理论值之间有良好的相关性,在低值PLT时,PLT-O和PLT-F法与理论值之间拟合性较PLT-I法好;红细胞碎片干扰实验表明,PLT-O和PLT-F法具有相似的抗RBC碎片能力,明显优于PLT-I法;在相关性评价实验中,低值血小板组(<100×109/L),3种检测方法与手工法的相关系数rPLT-F>rPLT-O>rPLT-I,表明低值血小板计数时,PLT-F法优于PLT-O法,这两种方法明显优于PLT-I法[16-17]。
4 结语
本研究结果表明,PLT-F计数法基本性能优良,能够满足临床检验需求。线性稀释实验和相关性评价结果均表明,在进行低值血小板计数时,与PLT-I和PLT-O法相比,PLT-F法的准确性更高。虽然PLT-F法在血小板计数方面性能优异,但由于其需要消耗额外的荧光染料,检测成本高,检测速度慢(68样本/h),并不适合日常临床筛查。本研究在个性化定制XN3000流水线时,充分利用了其自动复检功能,自定义复检规则,将第一台XN10设置为主检测机型,采用CBC+DIFF模式(PLT-I法)进行大规模常规筛查,将第二台XN10设置为复检机型。当PLT检测结果触发相应复检规则时,通过轨道自动将相应血样导入第二台XN10血液分析仪采用CBC+DIFF+PLT-F模式(PLT-F法)进行复查。通过2台血细胞分析仪的合理搭配,可有效降低工作量,且能够为临床诊断和治疗提供更准确的信息[18-19]。
参考文献
[1]胡丽涛,王薇,王治国.血液分析仪的方法确认和性能验证[J].检验医学与临床,2011,32(13):2727-2729.
[2]叶应妩,王毓三,申子瑜.全国临床检验操作规程[M].3 版.南京:东南大学出版社,2006:22-23.
[3]Ye Yingwu,Wang Yusan,Shen Ziyu.National Guide to Clinical Laboratory Procedures[M]. Third Edition.Nanjing:Southeast University Press,2006:22-23.
[4]李红林,王庆伟,陆银宝,等.Excel在血细胞分析仪总重复性评价中的应用[J].现代检验医学杂志, 2009,24(5):28-29.
[5]刘成玉,罗春丽.临床检验基础[M].5版.北京:人民卫生出版社,2012:67-69.
[6]Liu Chengyu,Luo Chunli.Basic Clinical Laboratory Medicine [M].Fifth EditionBeijing:People's Medical Publishing House,2012:67-69.
[7]Harrion P,Horton A,Grant D,et al.Immunoplatelet counting:a proposed new reference procedure[J].Br J Haematol,2000,108(2):228-235.
[8]Harrion P,Ault KA,Chapman S,et al.An interlaboratory study of a candidate reference method for platelet counting[J].Am J Clin Pathol,2001,115(3):448-459.
[9]International Council for Standardization in Haematology Expert Panel on Cytometry; International Society of Laboratory Hematology Task Force on Platelet Counting.Platelet counting by the RBC/platelet ratio method a reference method[J].Am J Clin Pathol,2001,115(3):460-464.
[10]Briggs C.Quality counts:new parameters in blood cell counting[J].Int J Lab Hematol,2009, 31(3):277-297.
[11]Dadu T,Sehgal K,Shaikh A,et al.Comparison of platelet counts by sysmex XE 2100 and LH-750 with the international flow reference method in thrombocytopenic patients[J].Indian J Pathol Microbiol,2013,56(2):114-119.
[12]丛玉隆,乐家新,袁家颖.实用血细胞分析技术与临床[M].北京:人民军医出版社,2011:304-306,375.
[13]Cong Yulong,Yue Jiaxin,Yuan Jiaying.Pratical Hematology Analysis Technology and Clinical Application[M].Beijing:People's MilitaryMedical Press,2011:304-306,375.
[14]Bauer N,Nakagawa J,Dunker C,et al.Evaluation of the automated hematology analyzer Sysmex XT-2000iV™compared to the ADVIA®2120 for its use in dogs,cats,and horses:Part I--precision,linearity,and accuracy of complete blood cell count[J].J Vet Diagn Invest,2011,23(6): 1168-1180.
[15]吴敏,文艳,刘爱胜,等.Sysmex XN-9000血液分析仪检测低值血小板的性能评价[J].中国医学装备, 2015,12(8):51-53.
[16]Marionneaux S,Francisco N,Chan V,et al. Comparison of automated platelet counts and potential effect on transfusion decisions in cancer patients[J].Am J Clin Pathol,2013,140(5):747-754.
[17]Briggs C,Longair I,Kumar P,et al.Performance evaluation of the Sysmex hematology XN modular system[J].J Clin Pathol,2012,65(11): 1024-1030.
[18]Tanaka Y,Tanaka Y,Gondo K,et al.Performance evaluation of platelet counting by novel fluorescent dye staining in the XN-series automated hematology analyzers [J].J Clin Lab Anal,2014,28(5):341-348.
[19]魏峰,潘扬.国际血液分析仪41条复检规则的临床应用评价及实验室复检标准的建立[J].检验医学与临床, 2011,8(22):2727-2729.
Research on performance evaluation of new fluorescence platelet count method of hematology analyzer/CUI Xiao-yang, FENG Chun-yan, ZHU Cai-yun, et al// China Medical Equipment,2016,13(1):70-74.
[Abstract]Objective: To evaluate the platelet (PLT) count performance of Sysmex XN 3000 automatic hematology analyzer. Methods: PLT was counted by Sysmex XN 3000 automatic hematology analyzer with electric impedance (PLT-I), optical (PLT-O) and fluorescence (PLT-F) method to test the precision, linear range, carryover and the red blood cell fragment interference. The count results of PLT-I, PLT-O and PLT-F were compared with those of microscopic count method (PLT-M) respectively. Results: The within batch precision of PLT-F was 1.36%and the between batch precision was 1.93%. The ranges of carryover ratio are from 0 to 0.97%with PLT-F, and the average carryover ratio was 0.48%. The correlation coefficient (r) was 0.999 in lower, medium and high value specimens. The result showed that the PLT-F method had great ability of anti-interference in RBC fragment interference experiment. There was significant correlation in the results between PLT-F and PLT-M, and the accuracy of PLT-F was higher especially in low PLT specimens group (rPLT-F>rPLT-O>rPLT-I). Conclusion: The measuring item is of high accuracy, good repeatability, quickness and anti- interference for platelet count. When specimens are hemolysis or the PLT count abnormalities, PLT-F or microscopic method are recommend to review the result.
[Key words]Automatic hematology analyzer; Platelet count; Performance evaluation
收稿日期:2015-03-18
DOI:10.3969/J.ISSN.1672-8270.2016.01.022
[文章编号]1672-8270(2016)01-0070-05
[中图分类号]R446.111
[文献标识码]A
作者简介
崔晓阳,女,(1981- ),硕士,主管检验师。深圳市龙华新区人民医院检验科,从事血液学临床检验工作。
杂志排行
中国医学装备的其它文章
- 基于可编程逻辑控制器和分布式控制系统的医用电子直线加速器控制系统设计**基金项目:广东省引进创新科研团队计划(201001D0104732255)“电子加速器关键核心技术研发及产业化”
- 基于单片机的双通道静脉输液装置的设计
- 高频电刀输出功率的测试与分析
- 高频电刀的质量检测
- 体外诊断试剂质量控制标准研究
- 我国医用耗材管理研究热点的文献计量学社会网络分析**基金项目:辽宁省教育厅(GXDJ2014-B057)“高校基层组织建设研究的文献计量学分析”;卫生计生委中国卫生经济学会招标课题(CHEA1011060301)“卫生装备技术的双向功能配置评估模式体系研究”;沈阳市科学技术项目(F12-264-4-01)“分子细胞计量学实验技术数字资源共享服务平台”*通讯作者:labczs@mail.cmu.edu.cn;wangfei@mail.cmu.edu.cn
