紫金化毒栓制备工艺研究*
2016-03-13李燕英吴佳妮张保献
钱 俊,刘 军,吴 云,李燕英,吴佳妮,张保献,萧 伟**
(1.江苏康缘药业股份有限公司 连云港 222001;2.中药制药过程新技术国家重点实验室连云港 222001;3.北京因科瑞斯医药科技有限公司 北京 102209)
紫金化毒栓制备工艺研究*
钱 俊1,2,刘 军3,吴 云1,2,李燕英3,吴佳妮3,张保献3,萧 伟1,2**
(1.江苏康缘药业股份有限公司 连云港 222001;2.中药制药过程新技术国家重点实验室连云港 222001;3.北京因科瑞斯医药科技有限公司 北京 102209)
目的:优选最佳紫金化毒栓制剂工艺。方法:以外观性状、融变时限、指标成分溶出度为考察指标,优选基质,确定栓剂的载药量、附加剂种类和用量、基质熔融温度、注模及固化温度等工艺条件及参数。结果:栓剂中药物占比37%,辅料为吐温80 1.0%、单硬脂酸甘油酯5.0%、硬脂酸3.0%、半合成脂肪酸甘油酯(36)54.0%。栓剂基质在65℃熔融完全后,加入膏粉,搅拌均匀;待降温至约50℃时,将挥发油用吐温80溶解,加入到药液中,搅拌均匀;待降温至约40℃时,灌注于栓模内,5℃固化10 min,脱模,即得。结论:通过对制剂处方及工艺条件的研究,确定了最佳工艺,并进行了3批中试工艺验证,表明紫金化毒栓制剂工艺合理可行,可用于工业化生产。
紫金化毒栓 绿原酸 制备工艺 高效液相色谱法
紫金化毒栓主要由金银花、连翘、莪术等中药组成,具有清热解毒、活血燥湿、消肿生肌的功效,用于湿热瘀阻所致的带下病及宫颈高危型人乳头瘤病毒感染(Human Papillomavirus,HPV)。在前期研究已确定其中间体提取纯化工艺的基础上,本试验对其栓剂制备所需的基质、附加剂及工艺的参数等进行优选,为该制剂的开发提供试验依据。
1 材料
LC-2010Aht液相色谱仪(日本岛津公司);BT25S电子分析天平(德国赛多利斯公司);BS124S电子分析天平(德国赛多利斯公司);RBY-4型自动融变时限检查仪(天津市天大天发科技有限公司);ZRS-8GD溶出试验仪(天津市天大天发科技有限公司)。
甲醇、乙腈为色谱纯(均购自北京迪马科技有限公司,批号分别为:70116、70122);乙醇、磷酸、三氯甲烷为分析纯(均购自北京化学试剂厂,批号分 别 为:20130926、20131101、20121213);硅 藻土为分析纯(北京益利精细化学品有限公司,批号:12112305);绿原酸对照品(中国食品药品检定研究院,批号:110753-200413);聚乙二醇4000、6000(均购自湖南尔康制药有限公司,批号分别为:20121028、20130301);半合成脂肪酸甘油酯36(湖北新河化工,批号:121115、121207);聚氧乙烯(40)硬脂酸酯(S-40,巴斯夫中国有限公司,批号:20130113);吐温80(南京威尔化工有限公司,批号:20130402);单硬脂酸甘油酯(巴斯夫中国有限公司,批号:20130424);硬脂酸(上海倍特化工有限公司,批号:20120911);紫金化毒栓(江苏康缘药业股份有限公司,批号:140301)。
金银花、连翘、莪术等药材均购自亳州药材市场,经本公司检测分析部检验符合2010版《中国药典》标准。
2 方法与结果
2.1 绿原酸含量测定
2.1.1 色谱条件[1]
色谱柱Ultimate LP-C18色谱柱(250 mm×4.6 mm,5 μm);以乙腈-0.4%磷酸(9:91)为流动相,检测波长为327 nm,柱温30℃,流速1 mL·min-1,进样量10 μL。
2.1.2 对照品溶液制备
精密称取绿原酸对照品9.97 mg,置25 mL量瓶中,加50%甲醇适量使溶解并定容至刻度,摇匀,作为储备液。
2.1.3 线性关系的考察
分别精密量取对照品储备液适量,配制成7.976、19.94、39.88、79.76、119.64、199.4 μg·mL-1的对照品溶液,摇匀,经0.45 μm微孔滤膜滤过,取续滤液10 μL按“2.1.1”项下方法测定,以进样量为横坐标,峰面积为纵坐标,得回归方程:y= 3 140 417.177 2x-94 926.322 0,相关系数r=0.999 8。结果表明,绿原酸在0.079 76-1.994 00 μg范围内线性良好。
2.1.4 供试品溶液制备[2,3]
取本品,切碎,取约0.5 g,精密称定,置具塞锥形瓶中,加硅藻土1 g,精密加水50 mL,称定重量,置60℃水浴5 min,溶散均匀,取出,40℃超声处理(功率250 W,频率40 kHz)30 min,放冷,再称定重量,用水补足减失的重量,摇匀,冷冻(-10℃)30 min,取出,离心(转速为4 000 转/min)10 min,取上清液,经0.45 μm微孔滤膜滤过,取续滤液,即得。
2.1.5 专属性试验
取除金银花外的其它各味药材,制成不含金银花的阴性制剂,按“2.1.4”项下方法制成阴性样品溶液。取供试品溶液、对照品溶液及阴性样品溶液各10 μL,按“2.1.1”项下方法测定。结果显示,该处方中其余药材对绿原酸的含量测定无干扰,见图1。
2.1.6 仪器精密度
精密吸取同一供试品溶液10 μL,按“2.1.1”项下方法连续进样6次,绿原酸峰面积的RSD为0.07%,表明仪器精密度良好。
2.1.7 稳定性试验
取同一供试品溶液,分别在0、2、4、8、12、24 h按“2.1.1”项下方法进样测定,绿原酸峰面积的RSD 为0.25%,表明供试品溶液在24 h内稳定。

图1 紫金化毒栓中绿原酸HPLC图
2.1.8 重复性试验
取同一批样品6份,分别按“2.1.4”项下方法制备供试品溶液,按“2.1.1”项下方法测定,绿原酸含量的RSD为0.18%,表明本法重复性良好。
2.1.9 加样回收率试验
取本品同一批号已知含量的样品约0.25 g,共6份,精密称定,置锥形瓶中,精密加入一定量绿原酸对照品,按“2.1.4”项下方法制备供试品溶液,按“2.1.1”项下方法测定,绿原酸平均加样回收率为98.53%,RSD为1.49%,表明该方法准确可靠。
2.2 制剂工艺研究
2.2.1 紫金化毒栓干膏粉制备
金银花等用80%乙醇回流提取2次,每次1.5 h,过滤,滤液备用;连翘等用水提取2次,每次1.5 h,过滤,滤液备用;莪术用水蒸气蒸馏提取挥发油,挥发油另器收集,备用。上述提取液合并浓缩、干燥,干膏粉碎后过120目筛,备用。
2.2.2 基质选择
栓剂常用基质有水溶性和油溶性的基质[4,5],水溶性的基质常用的有聚乙二醇类、明胶、聚氧乙烯(40)硬脂酸酯等,油溶性的基质有可可豆脂、半合成脂肪酸甘油酯等。根据本制剂的使用特点和实际生产中常用的基质,选择聚乙二醇4000、聚乙二醇6000、半合成脂肪酸甘油酯36、聚氧乙烯(40)硬脂酸酯为基质,以栓剂外观、融变时限、溶出度等为指标进行制剂的优选。
2.2.2.1 供试样品制备
称取各基质,分别置于烧杯中,在恒温水浴锅上加热融解(65-75℃),加入膏粉,搅拌均匀,待降温至约50℃时,将适量挥发油用吐温80溶解,加入到药液中,搅拌均匀,灌注于栓模内,在2-5℃固化约10 min,削去溢出部分,脱模,即得样品。
2.2.2.2 外观性状及融变时限检查[6-8]
采用目视观察药物外观性状及切面性状。分别取4种栓各3粒,根据《中国药典》2010版一部附录XII B融变时限检查法测定,结果显示,以半合成脂肪酸甘油酯36为基质的栓剂在30 min内全部软化,触压无硬芯,切面均匀,其余3种基质制得的栓剂1 h内尚有少量硬芯,且切面不匀,有沙粒感。
2.2.2.3 溶出度测定[9-11]
用《中国药典》2010版二部浆法测定栓剂中绿原酸溶出度。释放介质为pH4.5的盐酸溶液700 mL,温度为(37.0±0.5)℃,转速100 r·min-1。取栓剂1枚,放入溶出杯中,分别于5、10、15、20、30、40、60、90 min取样5 mL,同时补加5 mL等温溶出递质。溶出液经微孔滤膜过滤,弃去初滤液,精密量取续滤液1 mL,蒸干,加甲醇溶解并定容至25 mL容量瓶中。分别进液相测定,计算各时间点各样品的绿原酸溶出量,并求出各样品不同时间的累积溶出率,绘制溶出曲线,见图2。
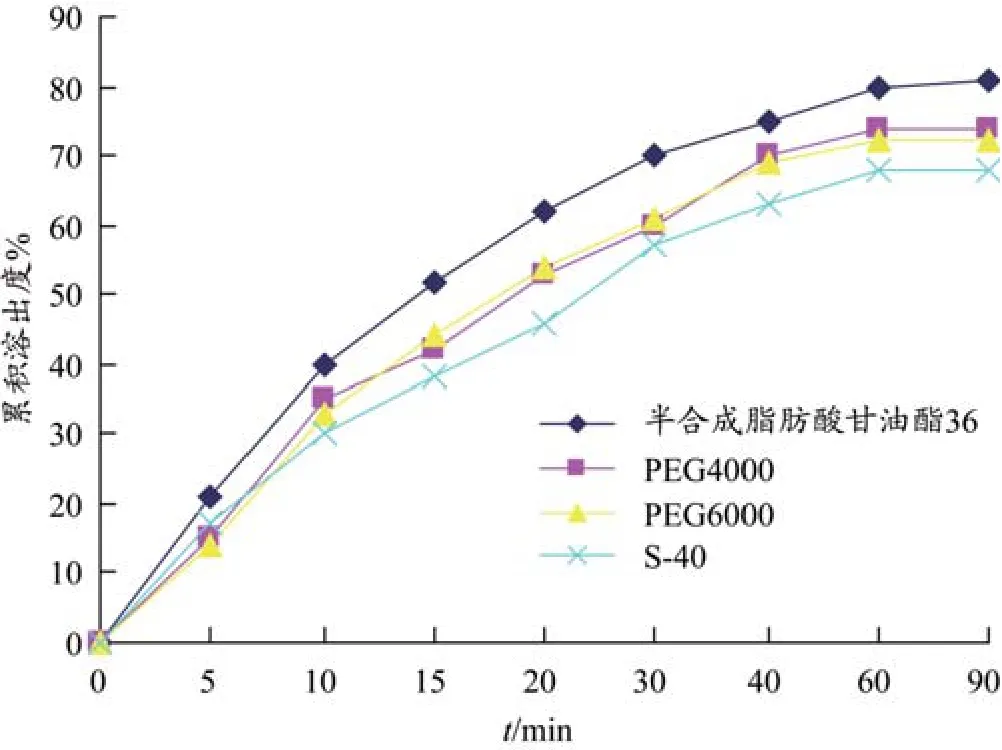
图2 不同基质栓剂溶出度曲线
实验结果表明,以半合成脂肪酸甘油酯36制备的栓剂外观、切面、融变时限及溶出度最佳,故选择半合成脂肪酸甘油酯36为栓剂基质。
2.2.3 栓剂载药量
本品日用生药材量较大,按上述的载药量27.75%折算,一日使用的栓剂重量为4.0 g,使用栓剂较大,患者顺应性较差,故需对栓剂的载药量作进一步的优化,增大载药量,降低使用的栓剂重量。
根据每日用膏粉的量及栓剂的用法用量,设定栓剂载药药量分别为55.55%(2.0 g/粒)、44.44% (2.5 g/粒)、37.0%(3.0 g/粒)、31.71%(3.5 g/粒),以半合成脂肪酸甘油酯36为基质,进行栓剂成型试验。以栓剂外观、融变时限、药液混合均匀性、混合物流动性、稳定性(30℃,放置7天)等为指标进行载药量优选。
称取各个基质,分别置于烧杯中,在恒温水浴锅上加热融解(65-75℃),加入膏粉,搅拌均匀,待降温至约50℃时,将挥发油用吐温80溶解,加入到药液中,搅拌均匀,灌注于栓模内,在2-5℃固化约10 min,削去溢出部分,脱模,即得样品。
试验结果表明,当载药量在37.0%左右时(栓剂重量3.0 g/粒),制备的栓剂外观形态、稳定性、融变时限等均较好,并符合标准规定,故确定制备的栓剂规格为每粒3.0 g(载药量为37.0%左右)。
2.2.4 栓剂基质的优化[12,13]
为增加栓剂的弹性,降低脆性,增加栓剂硬度,便于储存,同时增加膏粉在基质中的溶解性、分散性,需加入助溶剂、硬化剂、增稠剂等辅料。优选常用辅料吐温80、单硬脂酸甘油酯、硬脂酸为附加剂,并对其用量进行优选。
按配比称取各基质,分别置于烧杯中,在恒温水浴锅上加热融解(65-75℃),加入膏粉,搅拌均匀,待降温至约50℃时,将挥发油用吐温80溶解,加入到药液中,搅拌均匀,灌注于栓模内,2-5℃固化约10 min,削去溢出部分,脱模,即得样品,结果见表1。
根据以上的试验,表明处方5制备的栓剂成型及稳定性较好,故确定处方5为紫金化毒栓的成型处方。即吐温80 1.0%、单硬脂酸甘油酯5.0%、硬脂酸3.0%、半合成脂肪酸甘油酯36 54.0%(根据膏粉量可适当调整比例)。
2.2.5 温度选择
2.2.5.1 基质熔融温度考察[14,15]
按比例称取各基质,分别置于烧杯中,分别于55、60、65、70、75℃水浴锅上,加热熔融至2/3时,停止加热,搅拌使完全融解,加入膏粉,搅拌均匀,待降温至约50℃时,将挥发油用吐温80溶解,加入到药液中,搅拌均匀,灌注于栓模内,2-5℃固化约10 min,削去溢出部分,脱模,即得样品。
结果表明,当温度在65-75℃时,能满足成型要求,所得栓剂外观色泽均匀,光滑细腻,切面均匀,故基质熔融温度定在65℃。
2.2.5.2 注模药液温度及固化温度考察
按比例称取各基质,分别置于烧杯中,分别于65℃水浴锅上,加热熔融至2/3时,停止加热,搅拌使完全融解,加入膏粉,搅拌均匀,待分别降温至40、45、50、60℃时,将挥发油用吐温80溶解,加入到药液中,搅拌均匀,灌注于栓模内,分别放置于0、5、10、15℃固化约10 min,削去溢出部分,脱模,即得样品。

表1 栓剂成型的优化结果
结果表明,注模药液温度为40-45℃,固化温度为0-5℃时,栓剂成型较好。
2.3 中试工艺放大验证
经上述试验,优化后紫金化毒栓制剂工艺为:栓剂基质在65℃熔融完全后,加入膏粉,搅拌均匀,待降温至约50℃时,将挥发油用吐温80溶解,加入到药液中,搅拌均匀,待降温至约40℃时,灌注于栓模内,在5℃固化约10 min,脱模,即得。
按照该工艺中试试制了3批样品,每批8 000粒,结果见表2。
结果表明,该工艺符合生产实际,可用于工业化生产。
3 讨论
绿原酸为处方中君药金银花的主要有效成分,故以该成分的溶出度为指标选择适宜的基质。
制剂中加入的硬脂酸作为增塑剂可增加栓剂弹性,降低脆性;吐温80、单硬脂酸甘油酯是表面活性剂,可促进药物与基质混合均匀,改善药物外观。
药液熔融、注模及固化温度对栓剂的成型有较大影响。熔融时温度过低,基质不能完全熔融,浸膏粉与基质不易混合均匀,制得栓剂外表粗糙,不够光滑细腻,切面不匀;注模时药液温度过低,溶液的流动性下降,影响注模,温度过高,冷却时间延长,膏粉易沉积,导致药物分散不均匀;固化温度低,栓剂注模后迅速固化,尾部无明显凹陷,固化温度过高,制剂尾部凹陷明显。因此,控制基质熔融温度为65℃、注模温度为40℃、固化温度为5℃能较好地解决这一问题。

表2 3批中试生产结果
本文通过一系列试验,确定了紫金化毒栓的基质配比及熔融、灌注、冷却温度等关键工艺参数,该工艺合理可行,符合生产实际,可用于工业化生产。
1 国家药典委员会.中国药典:2010年版一部.北京:中国医药科技出版社, 2010: 205.
2 毕宇安,孙晓萍,王振中,等.热毒宁注射剂在大鼠体内的药代动力学研究.世界科学技术-中医药现代化, 2010, 12(6): 941-944.
3 高红宁,金万勤,郭立玮,等.不同精制工艺对金银花水提液中绿原酸含量的影响.世界科学技术-中医药现代化, 2010, 12(2):241-244.
4 张兆旺.中药药剂学(第2版).北京:中国中医药出版社, 2007: 291.
5 陈惠红.栓剂基质研究进展.中国药业, 2009, 18(4): 59-60.
6 胡慧香,张智敏.复方苦豆子栓剂的制备及临床应用.山西中医, 2009, 25(5): 50-51.
7 田振坤.腔道给药新剂型——泡腾胶囊栓的研究设计.世界科学技术-中医药现代化, 2011, 13(2): 359-361.
8 陈华.妇阴康洁栓剂制备工艺研究.中国药业, 2006, 15(6): 30.
9 丁大勇,张妍妍,高菲,等.蛇柏妇炎栓提取及制备工艺优选.中国实验方剂学杂志, 2011, 17(23): 25-28.
10 李莉,何谨,黄家宇,等.杠板归缓释栓剂的制备及体外释放度研究.贵阳医学院学报, 2013, 38(4): 369-371.
11 王淑萍,陈虹,张莉,等.蛇床子栓的制备工艺研究.武警医学院学报, 2007, 16(1): 57-59.
12 彭贤东,唐志立,王龙飞,等.氟甲栓的制备及质量控制.中国药房, 2010, 21(1): 61-63.
13 尚飞,李融来,钱春梅.影响中药栓剂融变时限的因素研究.中成药, 2005, 27(11): 1341-1342.
14 笔雪艳,张清波.关于中药栓剂融变时限检查的建议.中国药品标准, 2007, 8(4): 7-8.
15 马素英,尚校军,徐红珍,等.复方司帕沙星中空栓的制备及质量控制.中国药房, 2008, 19(1): 43-45.
Optimization on Preparation Technology of Zi-Jin Hua-Du Suppository
Qian Jun1,2, Liu Jun3, Wu Yun1,2, Li Yanying3, Wu Jiani3, Zhang Baoxian3, Xiao Wei1,2
(1. Jiangsu Kanion Pharmaceutical Co. Ltd., Lianyungang 222001, China; 2. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China; 3. Institute of Beijing Increase Biological Products, Beijing 102209, China)
This study was aimed to optimize the preparation technology of Zi-Jin Hua-Du (ZJHD) suppository. The examining indexes contained appearance, characteristics, melting time, and dissolution of indicators. The matrix was optimized. Technological conditions and indexes, which included the suppository drug-loading rate,the type and amount of additives, matrix melting temperature, temperature of molding and solidification, were identified. The results showed that the best prescription index of ZJHD suppository was drug-Tween 80-glycerin monostearate-stearic acid-adeps solidus (36) at 37%: 1.0%: 5.0%: 3.0%: 54.0%. When the suppository matrix was totally melted at the temperature of 65℃, powder was added and mixed evenly. When the temperature was decreased to about 50℃, the essential oil was dissolved with Tween 80, added into the medical liquid, and mixed evenly. When the temperature decreased to about 40℃, the liquid was added into the mold. The solidification was 10 min at the temperature of 10℃. The suppository was received after the mold was removed. It was concluded that through the study on the prescription and the technological conditions, the best technology was identified. This technology was verified with three batches of pilot trials. It showed that the ZJHD suppository preparation technology was rational and practicable, which can be used in the industrial manufacture.
Zi-Jin Hua-Du suppository, chlorogenic acid, preparation technology, HPLC
10.11842/wst.2016.01.015
R283
A
(责任编辑:刘馨雨 张志华,责任译审:王 晶)
2014-11-15
修回日期:2014-11-19
* 科学技术部国家重大新药创制项目(2013ZX09402203):现代中药创新集群与数字制药技术平台,负责人:王振中。
** 通讯作者:萧伟,本刊编委,博士,研究员级高级工程师,主要研究方向:中药新药研究。
