壳聚糖-纳米铁去除上覆水和底泥中Cr(Ⅵ)、Pb2+、Cd2+的研究*
2016-03-13宋文杰宋伟男胡保安柳听义
赵 林 宋文杰 宋伟男 胡保安 柳听义
(1.天津大学环境科学与工程学院,天津 300072;2.中交天津港航勘察设计研究院有限公司,天津 300450;3.天津市水资源与水环境重点实验室,天津 300387)
壳聚糖-纳米铁去除上覆水和底泥中Cr(Ⅵ)、Pb2+、Cd2+的研究*
赵 林1宋文杰1宋伟男1胡保安2柳听义3
(1.天津大学环境科学与工程学院,天津 300072;2.中交天津港航勘察设计研究院有限公司,天津 300450;3.天津市水资源与水环境重点实验室,天津 300387)
利用具有较好抗氧化性和分散性的壳聚糖-纳米铁(CS-NZVI)颗粒去除上覆水-底泥系统中的Cr(Ⅵ)、Pb2+、Cd2+,分析了Cr(Ⅵ)、Pb2+、Cd2+去除的动力学特征,考察了pH和盐度对去除效果的影响。结果表明,CS-NZVI颗粒能够有效去除上覆水及底泥中的Cr(Ⅵ)、Pb2+、Cd2+,Cr(Ⅵ)、Pb2+、Cd2+的去除过程满足准一级反应动力学方程;随着pH的升高,上覆水中Cr(Ⅵ)的去除率逐渐降低,而Pb2+、Cd2+去除率逐渐升高,底泥中Cr(Ⅵ)去除率先大幅降低后小幅上升,而Cd2+、Pb2+去除率总体呈降低趋势;高盐度不利于上覆水中Cr(Ⅵ)的去除,但对底泥中Cd2+和Pb2+的去除具有促进作用,对底泥中Cr(Ⅵ)的去除没有明显影响。
壳聚糖-纳米铁 底泥 重金属 去除效果
由于工业和城市化的快速发展,大量污水排放及大气沉降导致河湖底泥中积累一定重金属,受污染的底泥又作为污染源向水体释放重金属导致水体二次污染,造成水质环境恶化,并进一步危害整个生态系统[1]。目前关于重金属污染底泥的治理方法有原位修复法和异位修复法,在治理过程中可以采用物理、化学、生物技术或将几种技术联合使用[2-4]。
近年来,纳米技术的发展为地表水和土壤的污染修复提供了新的方法和思路。对现有研究进行梳理发现,纳米零价铁(NZVI)具有粒径小、比表面积大、反应活性高等性能,对Cr(Ⅵ)、Pb2+、Cd2+等重金属离子有很强的去除能力[5],但NZVI稳定性差,在环境中易氧化甚至自燃,且NZVI粒径小,极易团聚,使其在工程应用中受到极大限制。NZVI的性质与环境因素密不可分,环境中盐度、pH等自然因素变化时,NZVI的性质也随之发生改变,进而影响其对重金属的处理效果。本研究制备了具有较好抗氧化性和分散性的壳聚糖-纳米零价铁(CS-NZVI)颗粒,并将其用于修复受Cr(Ⅵ)、Pb2+和Cd2+污染的上覆水及底泥,考察了pH和盐度对处理效果的影响,分析了影响机制,以期为重金属污染底泥的修复提供理论指导和科学依据。
1 材料与方法
1.1 CS-NZVI颗粒的制备
将0.5 g壳聚糖(CS)溶解于100 mL体积分数为2%的醋酸中,在55 ℃下持续搅拌4 h后停止加热,缓慢冷却至27 ℃时加入0.5 g NZVI(纯度95%),继续搅拌使NZVI均匀分散在CS和醋酸的混合液中。用注射器将上述溶液逐滴滴加到2.0 mol/L脱氧的NaOH稳定剂中,立刻形成CS-NZVI颗粒,将CS-NZVI颗粒在NaOH中保存24 h后,用脱氧去离子水冲洗直至冲洗液pH与脱氧去离子水pH相同,即得到具有较好抗氧化性和分散性的CS-NZVI颗粒,将CS-NZVI颗粒保存在脱氧去离子水中备用,整个制备过程在高纯氮气保护下完成。
1.2 上覆水-底泥系统
以天津大学青年湖中的表层底泥作为供试底泥,样品带回实验室后静置数小时,滤去上覆水,自然风干,剔除较大石块、水草等杂物,用去离子水去除样品中的可溶性成分。取底泥干样品50.0 g于250 mL烧杯中,加入40 mL混合储备液(K2Cr2O70.05 mol/L、Pb(NO3)20.10 mol/L、CdCl20.10 mol/L)及160 mL去离子水,模拟上覆水-底泥系统。向系统中通入高纯氮气10 min排出氧气,保证底泥的厌氧环境,密封,避光保存。上覆水和底泥中的Cr(Ⅵ)、Cd2+和Pb2+的质量浓度见表1。
1.3 扫描电镜测试与分析
利用 Nova Nano SEM 230 型扫描电镜(SEM)对CS-NZVI颗粒的粒度和形貌进行观察,结果见图1。
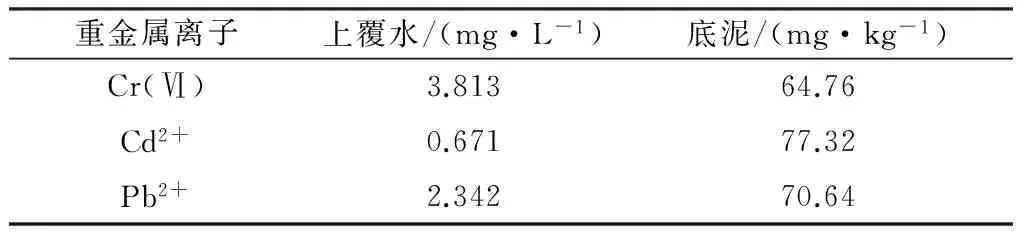
表1 上覆水和底泥中Cr(Ⅵ)、Cd2+和Pb2+的初始质量浓度
由图1可见,CS-NZVI颗粒内部呈多孔结构,孔径大小不均,在9.8~103.8 μm,平均孔径为41.6 μm,孔内表面凸凹不平,有利于CS-NZVI颗粒与Cr(Ⅵ)、Pb2+、Cd2+的传质和反应。
1.4 CS-NZVI颗粒对Cr(Ⅵ)、Cd2+、Pb2+的去除试验
向上覆水-底泥系统中加入0.5 g CS-NZVI颗粒,置于25 ℃恒温水浴中60 r/min下振荡,在CS-NZVI颗粒加入后0.5、1.0、2.0、4.0、6.0、10.0、24.0、72.0 h采用注射器取样,每次取样前用pH计测定上覆水-底泥系统的pH,取样后由抽滤装置将样品进行泥水分离,水样过0.42 μm针头过滤器,取1 mL过滤后水样注入比色管,加去离子水稀释至10 mL,加入3%(质量分数,下同)的HNO3溶液2~3滴,冷藏保存,待测。
将泥水分离后的底泥样品冷冻干燥,称取0.05 g置于Teflon消解罐中,加入2 mL HNO3(16.0 mol/L)和1 mL HF (33.3 mol/L),放入微波消解仪中,待混合酸液呈澄清透明状时倒入特氟龙烧杯中,置于电热板上110 ℃加热,直至溶液呈黏稠状,无明显液体,趁热用3% HNO3溶解完全并定容至50 mL,冷藏保存,待测。
采用电感耦合等离子发射光谱仪(ICP)测定上覆水及底泥样品中的Cr(Ⅵ)、Cd2+、Pb2+含量。工作条件如下:ICP功率1 kW,冷却气流量15 L/min,辅助气流量和载气流量均为1 L/min,样品提取量为1 mL/min。

图1 CS-NZVI颗粒的SEM图Fig.1 SEM microgram of the CS-NZVI beads
1.5 pH和盐度影响试验
pH影响试验:以5%(质量分数)盐酸溶液或0.1 mol/L NaOH溶液调整上覆水-底泥系统的pH分别为3.11、4.12、5.17、6.05、7.10、8.13、9.13,反应72.0 h后测定上覆水及底泥中Cr(Ⅵ)、Cd2+、Pb2+含量,考察pH对Cr(Ⅵ)、Cd2+、Pb2+去除效果的影响。
盐度影响试验:向上覆水-底泥系统中分别加入1、2、4、8 g NaCl,使系统盐度分别为0.5%(质量分数,下同)、1.0%、2.0%、4.0%,以不加NaCl的系统为对照组,反应72.0 h后测定上覆水及底泥中Cr(Ⅵ)、Cd2+、Pb2+含量,考察盐度对Cr(Ⅵ)、Cd2+、Pb2+去除效果的影响。
2 结果与讨论
2.1 CS-NZVI颗粒对Cr(Ⅵ)、Cd2+和Pb2+的去除效果
2.1.1 CS-NZVI颗粒对上覆水中Cr(Ⅵ)、Cd2+和Pb2+的去除效果
CS-NZVI颗粒对上覆水中Cr(Ⅵ)、Cd2+、Pb2+的去除效果见图2。由图2(a)、图2(b)、图2(c)可见,加入CS-NZVI颗粒后,上覆水中的Cr(Ⅵ)、Cd2+和Pb2+均得到有效降低,而系统pH则由7.68升高至10.23。反应进行到6.0 h时,Cr(Ⅵ)、Cd2+、Pb2+质量浓度分别降至0.185、0.067、0.211 mg/L,此后Cr(Ⅵ)质量浓度逐渐增大,Cd2+、Pb2+浓度稍有降低。
2.1.2 CS-NZVI颗粒对底泥中Cr(Ⅵ)、Cd2+和Pb2+的去除效果
CS-NZVI颗粒对底泥中Cr(Ⅵ)、Cd2+和Pb2+的去除效果见图3。由图3(a)、图3(b)、图3(c)可见,加入CS-NZVI颗粒后,底泥中3种重金属离子的浓度均开始缓慢降低,反应进行到6.0 h时,底泥中的Cr(Ⅵ)、Cd2+、Pb2+含量降至最低,质量浓度分别为11.12、14.03、13.42 mg/kg,此后底泥中Cr(Ⅵ)、Cd2+、Pb2+浓度逐渐增大。
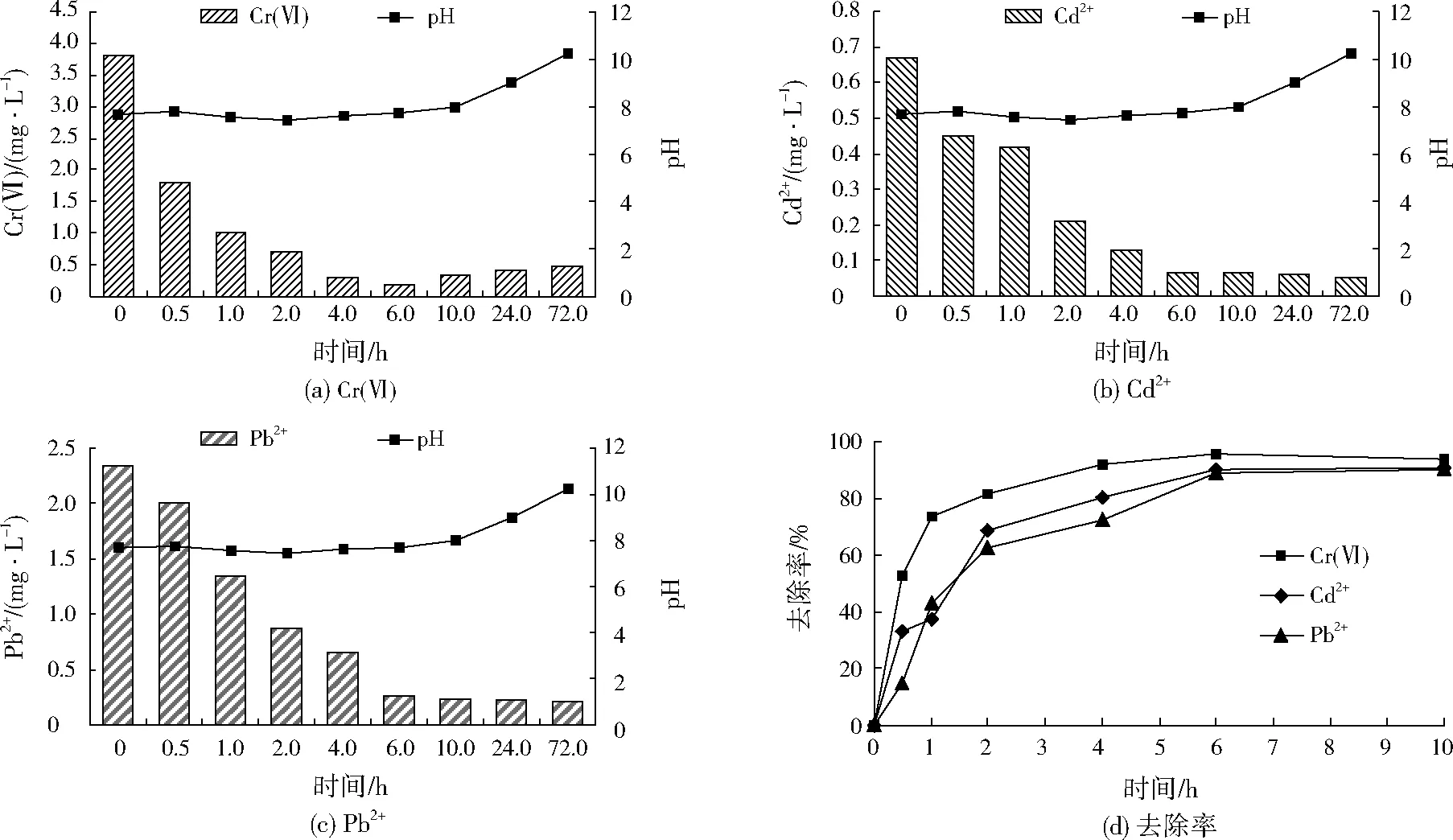
图2 CS-NZVI颗粒对上覆水中Cr(Ⅵ)、Cd2+、Pb2+的去除效果Fig.2 Effect of CS-NZVI beads on Cr(Ⅵ),Cd2+ and Pb2+ removal from overlying water
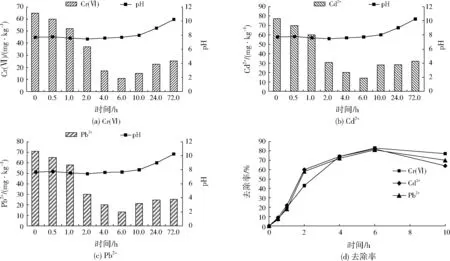
图3 CS-NZVI颗粒对底泥中Cr(Ⅵ)、Cd2+和Pb2+的去除效果Fig.3 Effect of CS-NZVI beads on Cr(Ⅵ),Cd2+ and Pb2+ removal from sediment
由图3(d)可见,反应进行到6.0 h时Cr(Ⅵ)、Cd2+和Pb2+的去除率达到最高,均在80%左右,随着反应时间的延长,去除率呈逐渐减小的变化趋势,这与系统的pH变化有关。存在于底泥中的重金属可以分为4种形态,分别为弱酸溶解态、铁锰结合态(可还原态)、有机结合态和残渣态。在中性偏碱性的底泥中,底泥中的有机物随着pH的增加溶解性增大,本研究系统pH由7.68逐渐升高至10.23,有机物含量相应增加,其对重金属离子的络合能力增强,导致反应后期底泥中Cr(Ⅵ)、Cd2+、Pb2+去除率逐渐降低。本研究模拟的上覆水-底泥系统有机质含量较低,故随着pH的增大,Cr(Ⅵ)、Cd2+、Pb2+去除率的降低幅度较小。
2.2 CS-NZVI颗粒去除Cr(Ⅵ)、Cd2+、Pb2+的动力学特征
CS-NZVI颗粒与重金属离子在上覆水-底泥系统中的反应属于多项体系、多项界面的非均相反应,相界面的特性对反应动力学的影响较大。本研究将CS-NZVI与重金属离子的反应简化为固-液两相间的反应,反应过程主要包含4个步骤:(1)重金属离子由底泥表面(固相)脱附至上覆水中(液相);(2)重金属离子向CS-NZVI颗粒(固相)表面扩散并被吸附;(3)重金属离子在CS-NZVI颗粒表面反应生成产物分子;(4)产物分子经扩散作用远离CS-NZVI颗粒。其中步骤(3)是将重金属离子转化为毒性较低或无毒物质,在反应过程中起关键作用。而步骤(1)、步骤(2)虽然不涉及化学反应,但对反应的进行以及重金属离子的去除速率有着一定影响。
通常情况下,污染物通过吸附、共沉淀作用去除时可采用零级反应动力学方程、准一级反应动力学方程、Elovich方程来描述[10],而污染物通过氧化还原和吸附作用去除时可采用准一级反应动力学方程进行描述[11-12]。本研究采用准一级反应动力学方程(见式(1))拟合0~360 min时上覆水和底泥中Cr(Ⅵ)、Cd2+、Pb2+的去除过程,拟合曲线见图4,拟合结果见表2、表3。
(1)
式中:c为t时刻重金属离子的质量浓度,mg/L或mg/kg;c0为重金属离子的初始质量浓度,mg/L或mg/kg;Kobs为一级表观速率常数,min-1,t为反应时间,min。
由表2、表3可见,拟合方程的R2均在0.95以上,说明上覆水和底泥中3种重金属离子的去除过程符合准一级反应动力学方程。上覆水中3种离子的去除速率为Cr(Ⅵ)>Cd2+>Pb2+(见表2),底泥中3种离子的去除速率为Cd2+>Cr(Ⅵ)>Pb2+(见表3);底泥中Cr(Ⅵ)、Pb2+的Kobs低于上覆水,主要是由于反应时底泥颗粒表面的重金属离子通过脱附释放至临近的液相空间,再向CS-NZVI颗粒表面扩散,反应过程较上覆水更复杂。
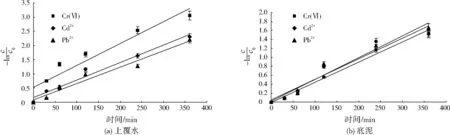
图4 CS-NZVI颗粒去除Cr(Ⅵ)、Cd2+、Pb2+的准一级反应动力学曲线Fig.4 First-order reaction kinetic curves of Cr(Ⅵ),Cd2+ and Pb2+ removal by CS-NZVI beads
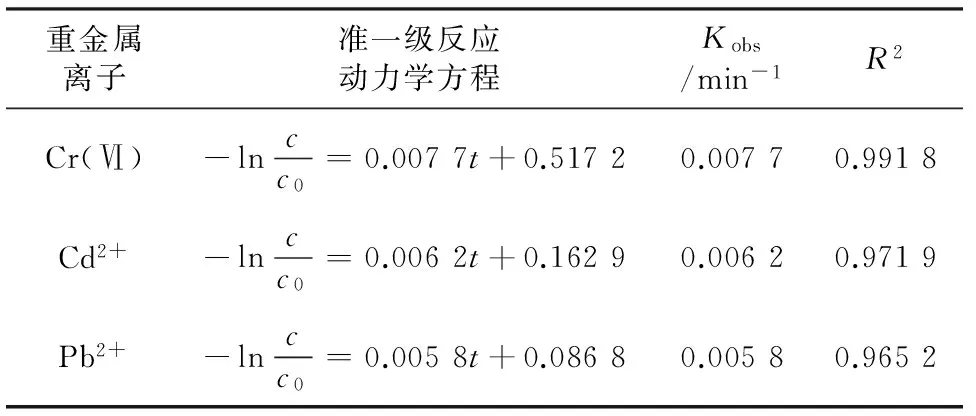
表2 CS-NZVI颗粒去除上覆水中Cr(Ⅵ)、Cd2+、Pb2+的动力学特征
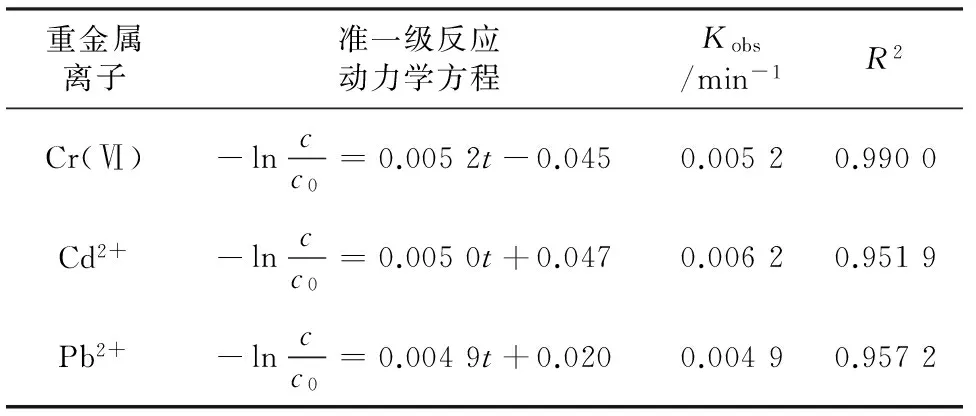
表3 CS-NZVI颗粒去除底泥中Cr(Ⅵ)、Cd2+、Pb2+的动力学特征
2.3 pH的影响
由图5(b)、图5(c)可见,Cd2+、Pb2+去除率随pH增加逐渐增加,与Cr(Ⅵ)相反,这是因为pH较低时,大量H+与Cd2+、Pb2+竞争CS-NZVI颗粒表面的氧化还原点位,增加对CS-NZVI的腐蚀与消耗[13],且反应生成的Fe2+与Fe3+不会形成铁氢氧化物,减少了对Cd2+、Pb2+的絮凝和吸附,导致Cd2+、Pb2+去除率相对较低。系统呈弱酸性时,CS-NZVI颗粒将Cd2+、Pb2+还原为Cd0、Pb0的过程将产生Fe2+、Fe3+,由此形成的铁氧化物和铁氢氧化物可吸附水溶液中的Cd2+、Pb2+,使Cd2+、Pb2+去除率增大;pH较大时,大量负电荷占据CS-NZVI颗粒表面,增加CS-NZVI颗粒对Cd2+、Pb2+的吸附和絮凝作用[14]。此外,水溶液pH较高时Cd2+、Pb2+易形成Cd(OH)2、Pb(OH)2沉淀,从而使水溶液中Cd2+、Pb2+的去除率增大。
pH对底泥中重金属的影响主要包括以下几个方面:(1)通过影响底泥中重金属的形态组成从而影响重金属的释放;(2)影响CS-NZVI颗粒的表面电荷;(3)影响铁氧化物或铁氢氧化物与重金属的络合反应。因此,pH对底泥中重金属去除的影响比上覆水更复杂。
pH对底泥中Cr(Ⅵ)、Cd2+、Pb2+去除率的影响见图6。由图6可见,Cr(Ⅵ)去除率随pH的升高呈现先大幅降低后小幅上升的趋势,当系统pH由3.11升高至6.05时,Cr(Ⅵ)的去除率由85.76%降低至78.01%,pH由6.05升高至9.13时,Cr(Ⅵ)的去除率由78.01%升高至81.26%。Cd2+和Pb2+去除率均随pH的升高逐渐降低,当系统pH由3.11升高至9.13时,Cd2+的去除率由82.32%降低至79.17%,Pb2+的去除率由86.23%降低至81.25%。分析原因,pH降低一方面会导致碳酸盐和氢氧化物溶解使重金属离子释放出来,H+的竞争作用也会提高重金属离子的解吸量;此外,酸性条件下重金属离子的溶解度明显增加,因此pH较低时底泥中Cr(Ⅵ)、Cd2+、Pb2+去除率均较高。SONG等[15]在研究中也发现,Pb和Cd的化学形态在pH为6时变化较小,而当pH低于5时,Pb和Cd的化学形态发生显著的变化,其中交换态Pb、Cd含量明显增加,而碳酸盐结合态Pb、Cd的比例迅速下降,其他形态的变化相对较小。随着pH下降,底泥中不同金属元素的活性形态比例增加,显著促进其他形态Pb、Cd向可交换态Pb、Cd的转化[16],可交换态Pb、Cd逐步在CS-NZVI颗粒表面还原,从而使底泥颗粒中的Pb2+、Cd2+含量降低。因此,随着pH降低,CS-NZVI颗粒对底泥中Pb2+、Cd2+的去除率增大。
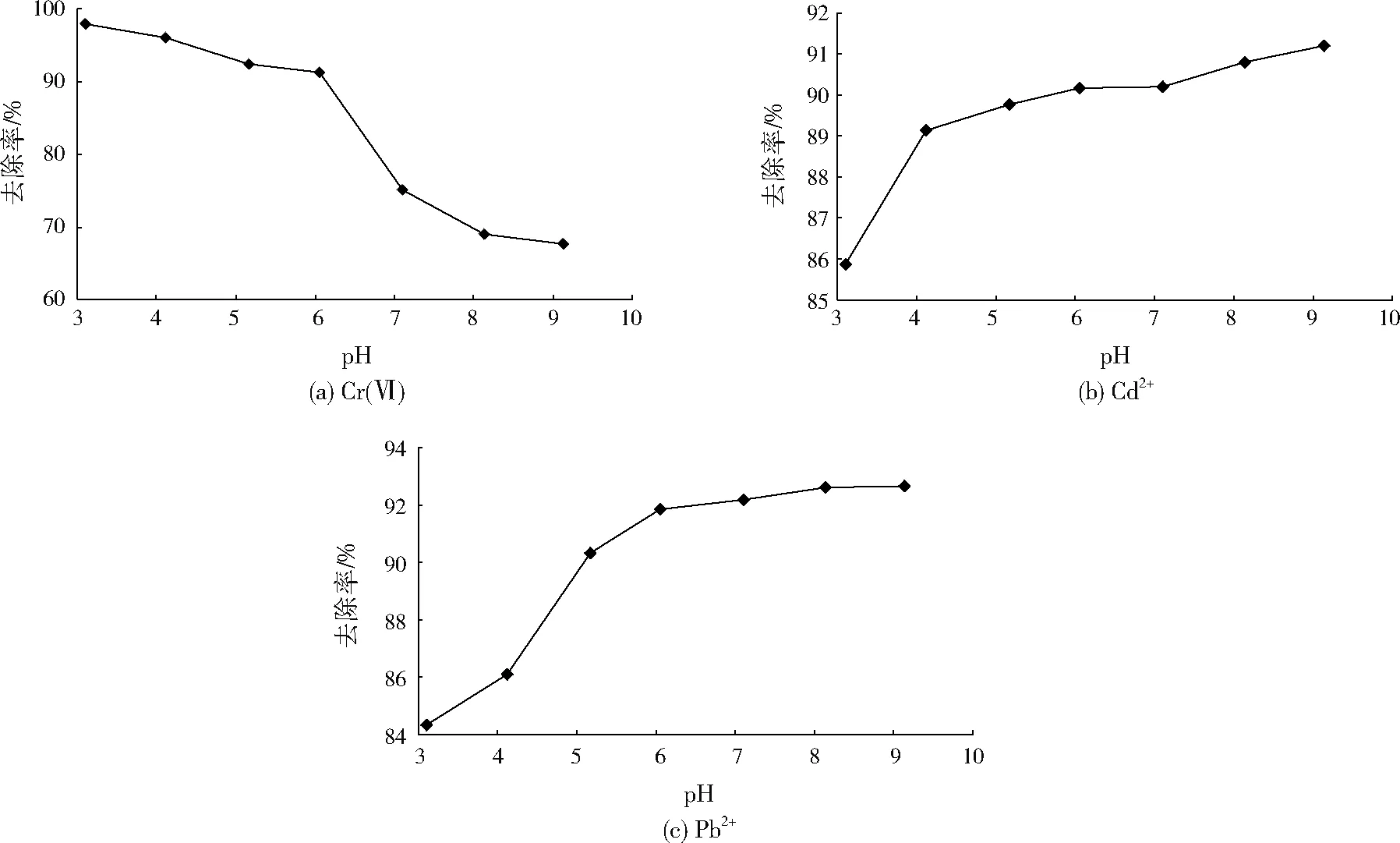
图5 pH对上覆水中Cr(Ⅵ)、Cd2+、Pb2+去除率的影响Fig.5 Effect of pH on the removal rate of Cr(Ⅵ),Cd2+and Pb2+in the overlying water

图6 pH对底泥中Cr(Ⅵ)、Cd2+、Pb2+去除率的影响Fig.6 Effect of pH on the removal rate of Cr(Ⅵ),Cd2+,Pb2+ in the sediment
需要说明的是,底泥中Cr(Ⅵ)去除率的变化与Cd2+、Pb2+不同,这是由于Cr(Ⅵ)具有酸碱两性的特点[17],因此酸性条件和碱性条件都有利于Cr(Ⅵ)的释放,导致底泥中的Cr(Ⅵ)随pH的增大先下降后上升,在中性条件下Cr(Ⅵ)去除率最低。
2.4 盐度的影响
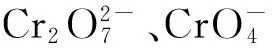

图7 盐度对Cr(Ⅵ)、Cd2+、Pb2+去除率的影响Fig.7 Effect of the salinity on the removal rates of Cr(Ⅵ),Cd2+ and Pb2+
由图7(b)可见,与对照组相比,当盐度提高到4.0%时,Cd2+的去除率由82.36%升高至85.61%,Pb2+的去除率由81.16%升高至91.26%,可见盐度的升高对Cd2+、Pb2+的去除具有促进作用。这是因为盐度升高使Na+与吸附在底泥颗粒上的Cd2+、Pb2+进行竞争,增大底泥中Cd2+、Pb2+的释放量,而Cl-与Fe2+、Fe3+反应生的Fe4(OH)8Cl有助于吸附释放的Cd2+、Pb2+。盐度为2.0%时,底泥中Cr(Ⅵ)的去除率最低为71.26%,与对照组(79.67%)相比降低了8.41百分点;盐度为0.5%、1.0%、4.0%时,Cr(Ⅵ)去除率分别为79.42%、78.81%、80.11%,与对照组相近,可见,盐度对CS-NZVI颗粒去除底泥中的Cr(Ⅵ)没有明显影响。
3 结 论
(1) CS-NZVI颗粒能有效去除上覆水-底泥系统中的Cr(Ⅵ)、Cd2+和Pb2+,投加CS-NZVI颗粒6.0 h后,上覆水中3种重金属离子的去除率在90%左右,底泥中3种重金属离子的去除率在80%左右。
(2) 在上覆水-底泥系统中,CS-NZVI颗粒对3种重金属离子的去除过程均符合准一级反应动力学方程。
(3) pH对CS-NZVI去除Cr(Ⅵ)、Cd2+和Pb2+具有重要影响,上覆水中Cr(Ⅵ)去除率随pH的增加而降低,Cd2+和Pb2+随pH的增加而升高;底泥中Cr(Ⅵ)去除率随pH的升高呈现先大幅降低后小幅上升的趋势,Cd2+和Pb2+去除率均随pH的升高逐渐降低。
(4) 高盐度不利于上覆水中Cr(Ⅵ)的去除,但对底泥中Cd2+和Pb2+的去除具有促进作用,而对底泥中Cr(Ⅵ)的去除没有明显影响。
[1] 许秀琴,朱勇,杨挺.水体重金属的污染危害及其修复技术[J].污染防治技术,2007,20(4):67-69.
[2] 李明明,甘敏,朱建裕,等.河流重金属污染底泥的修复技术研究进展[J].有色金属科学与工程,2012,3(1):67-71.
[3] 孟红明,张振克.石梁河水库沉积物中重金属的累积污染研究[J].环境科学研究,2008,21(3):44-50.
[4] KELDERMAN P,OSMAN A A.Effect of redox potential on heavy metal binding forms in polluted canal sediments in Delft (The Netherlands)[J].Water Research,2007,41(18):4251-4261.
[5] 孙昌梅,曲荣君,王春华,等.基于壳聚糖及其衍生物的金属离子吸附剂的研究进展[J].离子交换与吸附,2004,20(2):184-192.
[6] 何燕,高月,封文江.纳米科技的发展与应用[J].沈阳师范大学学报(自然科学版),2010,28(2):211-213.
[7] PONDER S M,DARAB J G,MALLOUK T E.Remediation of Cd(Ⅱ) and Pb(Ⅱ) aqueous solutions using supported nanoscale zero-valent iron[J].Environmental Science & Technology,2000,34(12):2564-2569.
[8] LIU Tingyi,YANG Xi,WANG Zhongliang,et al.Enhanced chitosan beads-supported Fe0-nanoparticles for removal of heavy metals from electroplating wastewater in permeable reactive barriers[J].Water Research,2013,47(17):6691-6700.
[9] KANEL S,GRENECHE J,CHOI H.Arsenic(V) removal from groundwater using nano scale zero-valent iron as a colloidal reactive barrier material[J].Environmental Science & Technology,2006,40(6):2045-2050.
[10] 唐兰模,符迈群,张萍.用壳聚糖除去溶液中微量铬(Ⅵ)的研究[J].化学世界,2001,42(2):59-62.
[11] 柳听义,赵林,谭欣,等.纳米零价铁去除垃圾渗滤液中铬(Ⅵ)的性能及机理研究[J].环境化学,2010,29(3):429-433.
[12] LIU Tingyi,WANG Zhongliang,YAN Xiaoxing,et al.Removal of mercury (Ⅱ) and chromium (Ⅵ) from wastewater using a new and effective composite: pumice-supported nanoscale zero-valent iron[J].Chemical Engineering Journal,2014,245:34-40.
[13] SHI Li,ZHANG Xin,CHEN Zuliang.Removal of chromium (Ⅵ) from wastewater using bentonite-supported nanoscale zero-valent iron[J].Water Research,2011,45(2):886-892.
[14] 郝向英,宝迪,赵慧,等.黄河水中pH值对镉与底泥相互作用的影响[J].内蒙古师大学报(自然科学汉文版),2001,30(2):136-138.
[15] SONG H,CARRAY E R.Reduction of chlorinated ethanes by nanosized zero-valent iron:kinetics,pathways,and effects of reaction conditions[J].Environmental Science & Technology,2005,39(16):6237-6245.
[16] GENG Bing,JIN Zhaohui,LI Tielong,et al.Kinetics of hexavalent chromium removal from water by chitosan-Fe0nanoparticles[J].Chemosphere,2009,75(6):825-830.
[17] ATKINSON C A,JOLLEY D F,SIMPSON S L.Effect of overlying water pH,dissolved oxygen,salinity and sediment disturbances on metal release and sequestration from metal contaminated marine sediments[J].Chemosphere,2007,69(9):1428-1437.
[18] 柳听义.包埋型纳米铁(NZVI)的制备及其去除废水中铬[Cr(Ⅵ)]的研究[D].天津:天津大学,2011.
[19] KANEL S,MANNING B,CHARLET L,et al.Removal of arsenic(Ⅲ) from groundwater by nanoscale zero-valent iron[J].Environmental Science & Technology,2005,39(5):1291-1298.
[20] PENG Jianfeng,SONG Yonghui,YUAN Peng,et al.The remediation of heavy metals contaminated sediment[J].Journal of Hazardous Materials,2009,161(2/3):633-640.
RemovingCr(Ⅵ),Pb2+andCd2+fromoverlyingwaterandsedimentbynanoscalezero-valentironentrappedinchitosanbeads
ZHAOLin1,SONGWenjie1,SONGWeinan1,HUBaoan2,LIUTingyi3.
(1.SchoolofEnvironmentalScienceandEngineering,TianjinUniversity,Tianjin300072;2.TianjinPort&WaterwayProspection&DesignResearchInstituteCo.,Ltd.,Tianjin300450;3.TianjinKeyLaboratoryofWaterResourcesandEnvironment,Tianjin300387)
Nanoscale zero-valent iron supported chitosan (CS-NZVI) was successfully prepared which had good oxidation resistance and dispersion. The obtained CS-NZVI beads was used to remove Cr(Ⅵ),Pb2+and Cd2+from the polluted overlying water and sediment. The kinetics of Cr(Ⅵ),Pb2+and Cd2+removal was investigated,and the effect of pH and salinity on Cr(Ⅵ),Pb2+and Cd2+removal was also demonstrated. Results showed that Cr(Ⅵ),Cd2+and Pb2+in the overlying water and sediments could be effectively removed by CS-NZVI beads. Kinetics of Cr(Ⅵ),Pb2+and Cd2+removal was found to follow the pseudo-first-order rate equation. With the increasing of pH,the removal rate of Cr(Ⅵ) in overlying water gradually reduced,while the removal rate of Pb2+and Cd2+was increased,the Cr(Ⅵ) removal rate of sediment was significantly reduced at first and then increased a little,while the Cd2+and Pb2+removal rate of sediment was overall decreased. High salinity was not conducive to Cr(Ⅵ) removal from overlying water,but it had a promoting effect on Cd2+and Pb2+removal from sediments,while its effect on Cr(Ⅵ) removal from sediments was not obvious.
CS-NZVI; sediment; heavy metals; removal performance
赵 林,男,1961年生,博士,教授,主要从事环境污染生态修复研究。
*“十二五”国家科技支撑计划项目(No.2012BAC07B02)。
10.15985/j.cnki.1001-3865.2016.12.003
编辑:丁 怀 (
2016-05-20)
