骨肽注射液细菌内毒素检查方法的建立
2016-03-11王婷婷连云港市药品检验所江苏连云港006正大天晴药业集团股份有限公司江苏连云港006
王婷婷,周 瑞(1.连云港市药品检验所,江苏连云港 006;.正大天晴药业集团股份有限公司,江苏连云港 006)
骨肽注射液细菌内毒素检查方法的建立
王婷婷1*,周 瑞2(1.连云港市药品检验所,江苏连云港 222006;2.正大天晴药业集团股份有限公司,江苏连云港 222006)
目的:建立骨肽注射液细菌内毒素的检查方法。方法:依据2015年版《中国药典》“细菌内毒素检查法”项下凝胶法的要求,通过干扰试验确定样品主成分最大无干扰质量浓度,并进行方法学验证。结果:样品主成分质量浓度稀释至0.333 mg/ml或以下时对鲎试剂与细菌内毒素的凝集反应无干扰作用。结论:所建立的方法可用于骨肽注射液的细菌内毒素检查。
骨肽注射液;细菌内毒素检查;凝胶法;干扰试验
骨肽注射液是由新鲜或冷冻的猪或胎牛四肢骨提取制成,在临床上主要用于促进骨折的愈合,也用于增生性骨关节疾病及风湿、类风湿关节炎等的辅助治疗[1]。该制剂目前执行的国家药品标准中所采用的热原检查法易受家兔自身因素干扰而出现假阳性或者假阴性结果[2-3]。为了提高该制剂的质量控制水平,笔者依据2015年版《中国药典》(四部)通则1143“细菌内毒素检查法”项下凝胶法的要求[4],并参考相关文献[5-8]对骨肽注射液的细菌内毒素检查方法进行了研究。
1 材料
1.1 仪器
MET-50型智能恒温加热仪(天津市天大天发科技有限公司)。
1.2 药品与试剂
骨肽注射液(安徽宏业药业有限公司,批号:150208、150504、150652,规格:2 ml:10 mg);细菌内毒素工作标准品(中国食品药品检定研究院,批号:150601-201478,规格:80 EU/支);细菌内毒素检查用水(BET水,中国食品药品检定研究院,批号:160006-201401,规格:5 ml/支);鲎试剂(TAL,湛江博康海洋生物有限公司,批号:1501071、标示灵敏度:0.25 EU/ml,批号:1503101、标示灵敏度:0.125 EU/ml;湛江安度斯生物有限公司,批号:1502021、标示灵敏度:0.25 EU/ml,批号:1505041、标示灵敏度:0.125 EU/ml)。
2 方法与结果
2.1 样品细菌内毒素限值(L)的确定
根据公式L=K/M[4]计算L。式中,K为人每kg体质量在1 h内最大可接受的内毒素剂量,以EU/(kg·h)表示,注射剂K=5 EU/(kg·h);M为人用每kg体质量在1 h内最大样品剂量,根据样品说明书静脉滴注1次最大剂量为20 ml,我国人均体质量按60 kg计,滴注时间按1 h计(不足1 h的仍按1 h计),故M=20 ml/(60 kg·1 h)=0.333 ml/(kg·h)。则L=5 EU/(kg· h)/0.333 ml/(kg·h)=15 EU/ml。因此,本研究拟定骨肽注射液的L为每1 ml该制剂中含细菌内毒素的量应<15 EU。
2.2 干扰试验最大有效稀释倍数(MVD)的确定
根据公式MVD=c·L/λ[4]计算MVD。式中,L=15 EU/ml;c为供试品溶液的浓度,当L以EU/ml表示时,则c=1.0 ml/ml;λ为TAL的标示灵敏度(《中国药品检验标准操作规范》[5]建议干扰试验使用0.5 EU/ml或0.25 EU/ml的TAL,本试验选择λ=0.25 EU/ml的TAL,而进行方法学验证时选择λ值较低的TAL),MVD=(1.0 ml/ml·15 EU/ml)/0.25 EU/ml=60。
2.3 TAL灵敏度复核
将细菌内毒素工作标准品用BET水溶解,配制成2.0 λ、1.0 λ、0.5 λ、0.25 λ的溶液,按2015年版《中国药典》(四部)通则1143[4]方法操作,以BET水做2支阴性对照管(NC),对2个厂家生产的TAL进行λ复核。结果,4批TAL复核灵敏度均在0.5λ~2.0 λ范围内,符合规定,详见表1(注:“+”表示阳性反应,“-”表示阴性反应,下表同)。

表1 TAL的λ复核结果Tab 1 Recheck results of TAL
2.4 干扰预试验
取1支细菌内毒素工作标准品,加入1 ml的BET水溶解,混匀后备用。取3批样品各1瓶,用BET水分别稀释2、4、8、15、30倍作为供试品阴性对照系列溶液(NPC);同时,每一稀释倍数下制备供试品阳性对照系列溶液(PPC,即用该浓度的供试品稀释液将细菌内毒素标准品制备成2.0 λ浓度)。用λ=0.25 EU/ml的2个厂家生产的TAL分别与上述2种系列溶液反应,每一稀释倍数平行做2支管。另取2支管加入BET水作为阴性对照(NC),2支管加入2.0 λ浓度的细菌内毒素标准溶液作为阳性对照(PC)。取以上4种溶液进行干扰预试验,结果见表2。
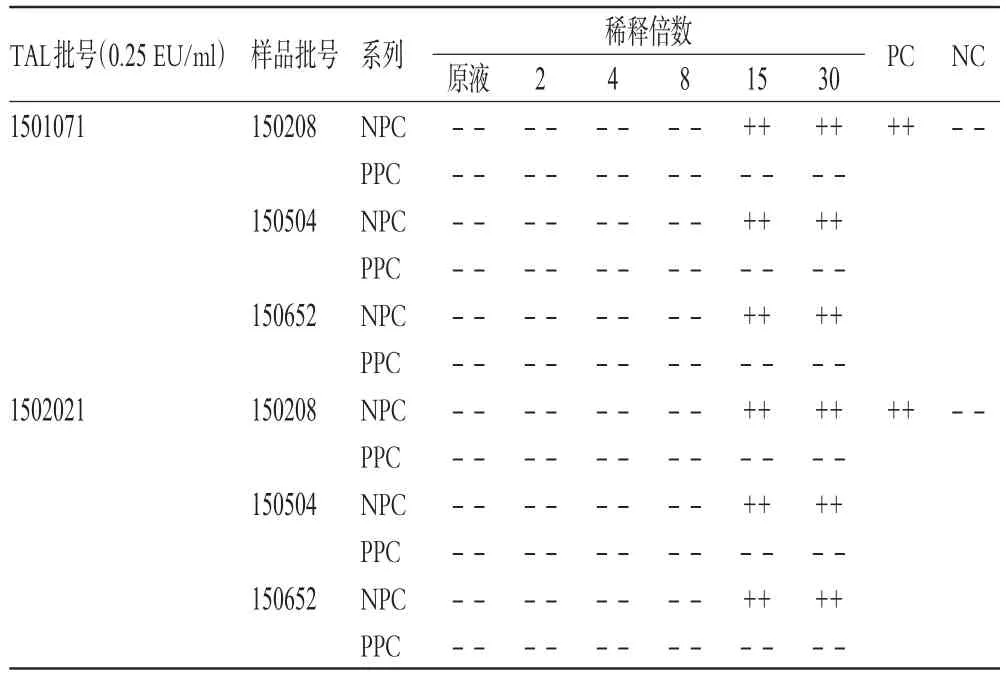
表2 样品干扰预试验结果Tab 2 Results of interference pretest of samples
由表2可见,3批样品均分别稀释15倍后,对2个厂家生产的λ=0.25 EU/ml的TAL与细菌内毒素的凝集反应无干扰作用。
2.5 干扰试验
根据干扰预试验结果,取3批样品用BET水分别稀释15倍后作为供试品溶液;用供试品溶液和BET水分别稀释细菌内毒素工作标准品,制成细菌内毒素浓度为0.5、0.25、0.125、0.062 5 EU/ml的系列溶液,每个浓度平行做4支管,分别与2个厂家生产的λ=0.25 EU/ml的TAL反应。另取供试品溶液和BET水做2支阴性对照管(NC),参考相关文献[4-8]进行干扰试验,按公式Es=lg-1(∑Xs/4)和Et=lg-1(∑Xt/4)[式中,Es为用BET水制成的细菌内毒素标准溶液的反应终点浓度的几何平均值;Et为用供试品溶液或稀释液制成的细菌内毒素溶液的反应终点浓度的几何平均值;Xs、Xt分别为用BET水和供试品溶液或稀释液制成的细菌内毒素(标准)溶液的反应终点浓度的对数值(lg)][5]计算各系列溶液反应终点细菌内毒素浓度的绝对值,结果见表3。
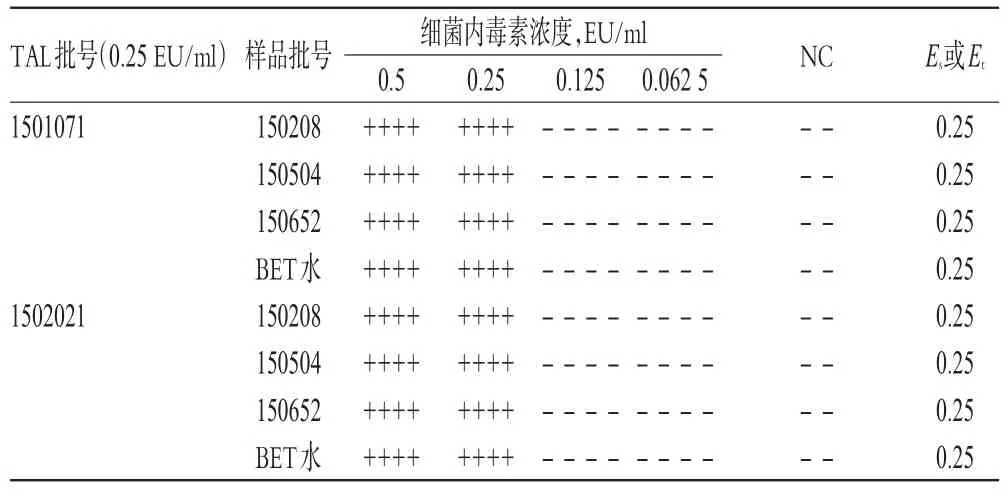
表3 样品干扰试验结果Tab 3 Results of interference test of samples
由表3可见,Es均在0.5 λ~2.0 λ范围内,且Et均在0.5 Es~ 2.0 Es范围内,表明样品稀释15倍后对TAL(λ=0.25 EU/ml)与细菌内毒素的凝集反应无干扰作用,可用于细菌内毒素检查。
2.6 样品细菌内毒素检查
取3批样品各1瓶,分别用BET水稀释15倍(主成分质量浓度为0.333 mg/ml),使用λ=0.125 EU/ml的2个厂家生产的TAL进行细菌内毒素检查,并按相关文献[4-5]方法做阳性(PPC、PC)、阴性(NPC、NC)对照,结果均符合规定,详见表4。
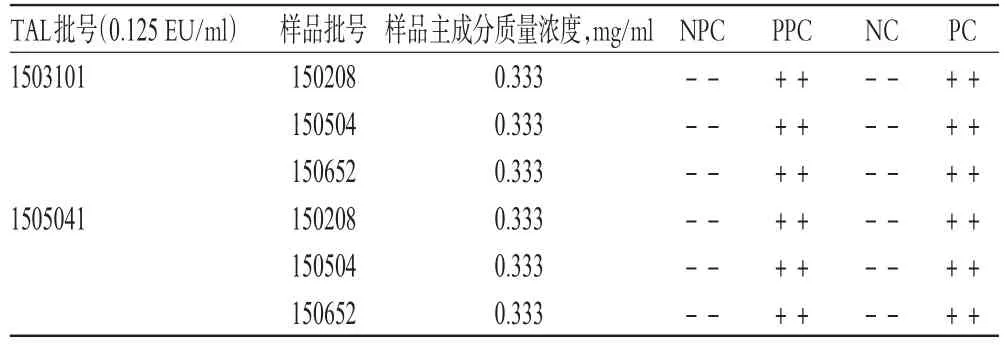
表4 样品细菌内毒素检查结果Tab 4 Results of bacterial endotoxins test of samples
3 讨论
骨肽注射液是复方制剂,其主要成分是多肽类物质、有机钙、磷、无机钙、无机盐、微量元素等。在建立骨肽注射液细菌内毒素的检查方法时,首先通过干扰预试验评价该制剂对TAL与细菌内毒素凝集反应的干扰程度,初步筛选出对细菌内毒素检查无干扰的样品主成分质量浓度范围。最终的干扰试验和细菌内毒素检查结果表明,该制剂主成分质量浓度稀释至0.333 mg/ml或以下时,对TAL(λ=0.125 EU/ml)与细菌内毒素的凝集反应未见干扰作用,即该制剂采用L=15 EU/ml进行细菌内毒素检查是可行的。
本试验采用的细菌内毒素检查方法相比于家兔热原检查法具有简便经济、重现性强的优点,适合于骨肽注射液生产和流通中的快速质量控制。而本试验的结果可为该制剂在新版的国家药品标准中将家兔热原检查法修订为细菌内毒素检查法提供科学依据。
[1] 王常禹,岳云飞,牛惠玲,等.骨肽注射液质量分析及研究[J].药物分析杂志,2010,30(11):2 197.
[2]国家食品药品监督管理局.国家药品标准WS1-XG-035-2000[S].2003.
[3] 田祥学.细菌内毒素检查法及其在药品检验中的应用[J].中国医药指南,2015(23):278.
[4] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:154-157.
[5] 中国药品生物制品检定所.中国药品检验标准操作规范[S].2010年版.北京:中国医药科技出版社,2010:310-325.
[6] 丁秀旻.骨肽注射液中细菌内毒定量检查研究[J].海峡药学,2007,19(12):62.
[7] 张娟,祝清芬,范治云,等.氢溴酸山茛菪碱注射液细菌内毒素检查法的建立[J].中国药房,2014,25(45):4 285.
[8] 贾瑞波,刘静,耿欣.注射用奈达铂细菌内毒素检查法的建立[J].中国药师,2014,17(2):332.
(编辑:周 箐)
Establishment of Bacterial Endotoxin Test Method for Ossotide Injection
WANG Tingting1,ZHOU Rui2(1.Lianyungang Institute for Drug Control,Jiangsu Lianyungang 222006,China;2.Chia-tai Tianqing Pharmaceutical Co.Ltd.,Jiangsu Lianyungang 222006,China)
OBJECTIVE:To establish the bacterial endotoxin test method of Ossotide injection.METHODS:According to the appendix of the gel method under“bacterial endotoxin test method”in Chinese Pharmacopiea(2015 edition),the maximal non-interference concentrations of samples were determined by interference test,and then methodology validation was conducted.RESULTS:The agglutination of LAL with bacterial endotoxin had no interference when the sample was diluted to 0.333 mg/ml or below.CONCLUSIONS:The established method can be used to detect the bacterial endotoxin of Ossotide injection.
Ossotide injection;Bacterial endotoxin test;Gel method;Interference test
R927
A
1001-0408(2016)36-5151-02
2015-12-30
2016-10-28)
*主管药师。研究方向:药物分析。E-mail:124603079@qq.com
DOI10.6039/j.issn.1001-0408.2016.36.35
