海水中天然细菌对不同生源要素有机物的矿化作用
2016-03-10谭丽菊CraigCarlson王江涛
谭丽菊,肖 慧,Craig A. Carlson,王江涛,*
1 中国海洋大学化学化工学院,青岛 266100
2 中国海洋大学海洋生命学院,青岛 266003
3 美国加州大学圣芭芭拉分校生态、演变和海洋生物系,加州 圣芭芭拉 CA93106- 6150
海水中天然细菌对不同生源要素有机物的矿化作用
谭丽菊1,肖慧2,Craig A. Carlson3,王江涛1,*
1 中国海洋大学化学化工学院,青岛266100
2 中国海洋大学海洋生命学院,青岛266003
3 美国加州大学圣芭芭拉分校生态、演变和海洋生物系,加州 圣芭芭拉 CA93106- 6150
摘要:海洋异养细菌是微食物网中非常重要的一部分,它消耗海洋中的溶解有机物并进行细菌的二次生产。细菌对不同种类的溶解有机物分解速率不同,并且有机物的生物利用率影响细菌的生长。研究了含有不同生源要素的4种溶解有机物(DOM)在海洋异养细菌存在下的矿化作用及对细菌生长的影响。结果表明:添加不同生源要素的有机物,对海洋天然异养细菌的生长均有促进作用,其比生长速率(μ)的大小顺序为:N >C >P >S >对照组,说明含氮有机物更有助于细菌的生长;细菌生长效率(BGE)的大小顺序为:对照组> C > P >N >S,说明细菌的二次生产跟有机物的分解速率没有直接相关性;单个细菌对有机物的消耗速率I为:N >C >P >S >对照组,说明细菌生长速率与有机物消耗速率直接相关;有机物的生物可利用性顺序为:N >C >P >S >对照组,与有机物的消耗速率顺序一致。上述结果表明,具有相同结构但不同生源要素的有机物的矿化速率存在差异,含氮有机物最容易分解,其次是含碳有机物,然后是含磷有机物,含硫有机物分解最慢,说明细菌对含有不同生源要素有机物的分解利用存在差异。
关键词:异养细菌;溶解有机物;生源要素;矿化作用
海洋细菌是海洋生物群落的重要组成部分,与海洋动、植物有着密切的关系,在海洋生态系统中的物质转化,如C、N、S、P等元素的生物循环中起着重要的作用[1]。众多研究表明,海洋中有25%—40%的浮游植物初级生产以溶解有机物(DOM)的形式被异养细菌吸收,并通过微食物网向上传递给浮游动物[2- 3]。相对DOM的总量而言,其组分结构和可利用程度与细菌的二次生产有着更为密切的关系[4]。通过矿化作用,细菌对与有机物密切相关的生源要素的再生和循环过程起着重要作用。对碳而言,浮游细菌能积累从大气中固定的碳,通过微食物网进入传统食物链,直至海洋深处,从而促进碳在全球范围内的循环[5],在寡营养海区,DOC的分解和细菌生物量的增加有直接的关系[6],在淡水中也有类似的规律[7]。有机物中的不稳定组分,如葡萄糖和氨基酸等,在细菌每天吸收的有机碳中比例占到10%—30%,甚至更高[8]。因此,这种低分子量的有机分子是细菌能量的主要提供者。氮是核酸及蛋白质的主要组成成分,是构成生物体的必需元素。细菌的碳氮比较低,因此,它在氮循环中的功能更为受到重视[9]。磷在海洋中循环主要是靠生物进行的,生物作用是造成海洋磷分布不均的主要因素。海洋环境中浮游植物只能吸收溶解无机磷,细菌能够利用溶解态有机磷,通过细胞质膜外的酶将有机磷分解为无机磷[10],然后提供给浮游植物。硫是构成生命物质所必须的元素,它是一些必需氨基酸、蛋白质、多糖、维生素和辅酶的组成成分。硫的氧化过程是由多种化能自养硫细菌完成的,它的转化是一个复杂的过程[11]。由此可见,细菌对以上各元素的生物地球化学循环都具有重要作用。在天然的海洋环境中,存在着不同的可溶性有机物和种类丰富的海洋异养细菌。不同种类的细菌可能会优先选择某一种或者某几种特定的可溶性有机物分解利用[6,8],天然海洋中的细菌可能会出现只利用有机物中的氨基、磷基或硫基,而不破坏其他碳链的情况,但是还有一部分细菌可以利用所有类型的可溶性有机物[8],所以这些细菌可以继续分解那些没有被破坏的碳链。因此,在实验室条件下,用DOC浓度的变化衡量有机物的降解是目前常用的方法[5- 6,12]。本论文在实验室条件下培养天然异养细菌,研究异养细菌和含有不同生源要素有机物的相互作用,讨论不同类型有机物的矿化速率和对细菌生长的影响。
1材料和方法
1.1样品收集和处理
海水采集时间为2012年3月,地点为美国加利福尼亚州圣芭芭拉近岸海水,采样深度5m。水样采集后,先用孔径为3.0μm的聚碳酸酯滤膜过滤,除去浮游藻类,再用0.22μm核孔滤膜过滤,除去细菌。用8体积除去细菌的过滤海水和2体积仅除去浮游藻类的海水混合成4L的培养液,置于系列具塞聚四氟乙烯桶中,分别加入不同种类的有机物,使培养液中的有机物浓度(以碳计)升高10μmol/L左右,在16℃恒温条件下避光培养。每个培养条件平行做双份。培养液所含有机物种类及浓度如表1所示。
1.2有机物分子结构
葡萄糖具有简单的碳链结构,普遍存在于海水中,属于最易分解的有机分子之一。为了消除有机物本身分子结构的影响,选择了具有葡萄糖基本结构的有机物。细菌对这些有机物碳链部分的分解作用类似,但天然水体中细菌因其自身生命活动需要会选择性分解含有不同生源要素的有机物。天然海水中有机物种类繁多,本文只考虑了4种有机分子作为研究对象(图1)。有机试剂均购自美国Sigma公司。
1.3细菌生物量测定
采用DAPI(4′6-二脒基- 2-苯基吲哚)染色,荧光显微镜计数,按照文献12的方法进行细菌生物量的测定,简述如下:

表1 培养体系所含有机物种类及浓度(以碳计)
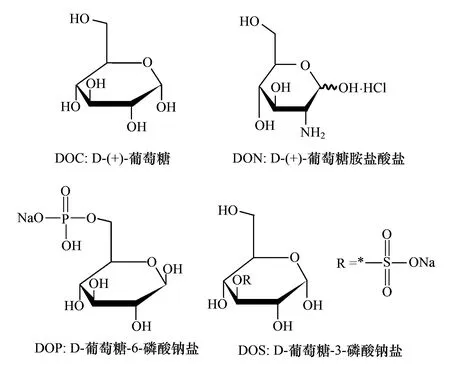
图1 培养液中所添加的有机物Fig.1 Organic matters added in the bacteria inoculums
1.3.1准备工作
从接种开始每隔12h取样对细菌生物量进行分析。取8mL水样,加入10%的福尔马林固定液2mL,置于4℃冰箱中冷藏保存,在3d之内测定完毕。将孔径为0.22μm的核孔滤膜置于Irgalan Black染料中浸泡15min染色,用于细菌的过滤。DAPI染液用0.22μm核孔滤膜过滤过的Milli-Q水配制,浓度为20μg/mL,避光冷藏保存。
1.3.2细菌生物量计算
取2mL(细菌生物量少时,为5mL)已固定的水样到专用滤器中,在<0.07atm负压下抽滤到0.5mL,停止抽气,加入0.5mL DAPI溶液,避光染色3min,继续抽滤至干。在载玻片上滴加少量无荧光显微镜油,将滤膜取下放在镜油上,再在滤膜上滴加少量镜油,盖上盖玻片,压实,编号之后在专用盒中冷冻保存,用Olympus AX- 70荧光显微镜计数,随机均匀选取10个视野计数被染色的细菌个体。细菌丰度(BA)用公式(1)计算:
(1)
式中,A为10个视野的平均细菌数;S1为滤膜的有效过滤面积;S2为视野面积;V为过滤水样体积。用换算因子15fgC/个(将每个细菌数换算成碳含量)计算细菌生物量(BB)[12](μmolC/L)。
1.4DOC分析
从接种开始定时取样,对培养液中的DOC进行分析。采用高温燃烧法,用岛津TOC-VCPH有机碳自动分析仪测定[12]。为了消除可能存在的玷污,样品从培养桶中直接取样到DOC测样瓶中。DOC含量包括浮游细菌中的碳含量,但是浮游细菌碳含量占DOC的含量较小,因此可以忽略不计。
2结果和讨论
2.1细菌生物量和有机物浓度的变化
由于细菌的指数生长期较短,一般在3d左右,之后由于大量存在的噬菌体摄食,生物量会出现较大波动,因此,细菌生物量监测到第6天。体系中有机物的分解较缓慢,监测到第15天。细菌生物量和有机物浓度随时间的变化曲线如图2所示。由图2可以看出,在含碳、含氮和含磷有机物的培养液中,细菌生长较快,指数生长期结束时生物量较大,而对照组和含硫有机物体系中细菌生长缓慢,最终生物量较小。由有机物分解曲线可见,虽然有机物的初始浓度不同,在培养结束时,DOC浓度均为70μmol/L左右,说明此时有机物已经比较稳定,在短时间内不易分解。

图2 培养过程中细菌生物量和有机物浓度的变化Fig.2 Organic matter concentration and bacteria biomass in the whole cultivation process
2.2细菌比生长速率(μ)
细菌在指数生长期的生长速率用比生长速率(μ)来表示,按公式(2)进行计算[13]:
(2)
式中,BA0是初始t0时的细菌数,BA1为指数生长末期t1时的细胞数,由图2可见,大部分体系的指数生长末期为第3天,因此,本文选取第3天的生物量和时间计算μ值。不同体系中的μ值如表2所示。
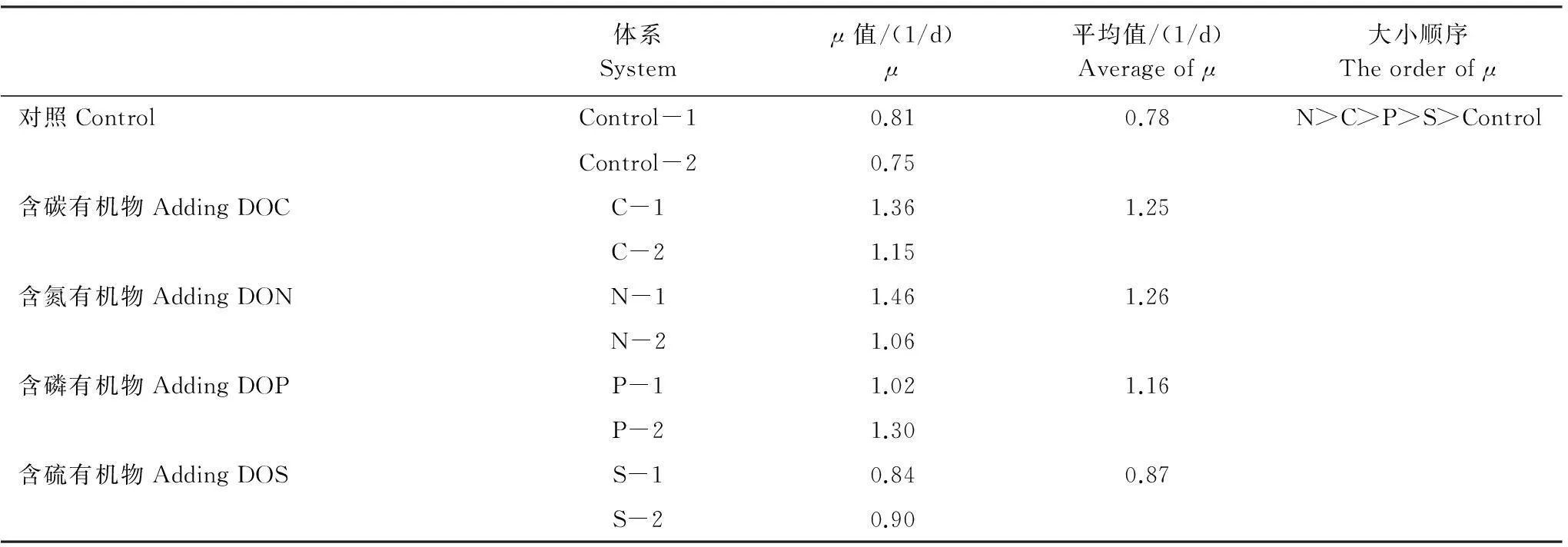
表2 不同体系中的比生长速率值
C- 1和C- 2分别表示含碳有机物的2个平行样,N- 1和N- 2分别表示含氮有机物的2个平行样,以此类推
由表2可以看出,加入含氮有机物的体系细菌生长速率最高(μ=1.26),其次是碳(μ=1.25),二者差异非常小;含磷有机物体系中细菌生长速率(μ=1.16)比含有机氮和有机碳的体系要低,但明显高于含硫有机物(μ=0.87)和对照组的细菌生长速率(μ=0.78)。比生长率的高低,反映了细菌活性的强弱[12],通过结果中的大小顺序,可以看出在含氮和含碳有机物体系中细菌活性最强。细菌比生长速率可能受到溶解有机物质量、无机盐、温度等各种因素的影响[14],在本文其他因子一致的情况下,有机物种类不同决定了细菌的活性,含氮有机物最能促进细菌的生长,含硫有机物的促进作用最弱,跟对照组数值差异不大。
2.3细菌增长效率(BGE)
BGE是水生系统中细菌通过二次生产将DOC转化为自身颗粒有机物的效率,是一个描述水体细菌功能和生态角色的重要参数[15- 16],也是评价微生物群落碳收支的关键指标[17]。该参数有不同的计算方法,本文用Carlson等[18]提出的公式(3)进行计算:
(3)
式中,ΔBB为指数生长期前后细菌生物量的变化,ΔDOC为细菌指数生长期前后体系中DOC浓度的变化。由图2可见,大部分体系在第3天时能达到指数生长期,因此,本文计算BGE的公式为:
(4)
式中,BB3和BB0分别为第3天和初始时细菌生物量,DOC0和DOC3分别为体系中初始和第3天时有机物的含量。该公式的优点是可以利用指数生长期细菌生物量和DOC的数据,误差相对较小,且不需要测定细菌呼吸所消耗的碳量。不同体系中BGE的值见表3。
由表2可见,BGE的值从含硫有机物的24%到对照组的54%,不同体系有较大的差异。大小顺序与细菌比生长速率的顺序不同,说明细菌生长和转化有机物为自身组织的效率没有直接的关系。
作为评价微生物群落碳收支的关键指标[19],BGE与细菌本身的生理条件密切相关。BGE旨在对异养微生物次级生产与呼吸代谢两大生态过程之间的相对关系进行综合比较[20],可以更客观地反映细菌生长过程中对有机碳源的利用效率,更有助于了解异养微生物对微食物网能量流动与物质循环的贡献[19]。研究表明,BGE与多种因素有关。一般认为温度和营养物质的可利用性是影响BGE的最主要影响因子。Lee等认为相对于温度,底物质量是调控BGE最主要的因子[21],而DOC的浓度高低对其影响不大[12]。Halewood等研究了圣芭芭拉近岸水体的BGE,结果显示,在一年中,BGE最高值出现在12月,为52%,最低值出现在3月,为5%,其大小与海水中DOC浓度没有相关性[12]。本文对照组用同海域的水样测得的BGE为54%,比文献值略高,可能是由于文献所用培养体系的温度为12—20℃之间,跟本文固定的16℃恒温不同导致。另外,由表3可见,在本文温度、光照和菌种等其他因子完全一致的情况下,只有有机物的种类不同,而不同体系的BGE有相对较大的差异,说明不同有机物转化为细菌自身组织的比例不同。由结果可知,相对于外源有机物,海洋本身所产生的有机物更有助于转化为细菌自身物质,而含硫有机物被细菌的利用效率最低。

表3 不同培养体系中的细菌增长效率(BGE)
2.4有机碳的消耗速率
用2种方法分析了不同有机物的矿化速率,一种为体系总体情况,一种为单个细菌分解有机物的速率,分别计算如下。
2.4.1DOC生物可利用性
引用参数%BDOC表示有机物分解速率,也可以表示有机物的生物可利用性[12],用公式(5)计算:
(5)
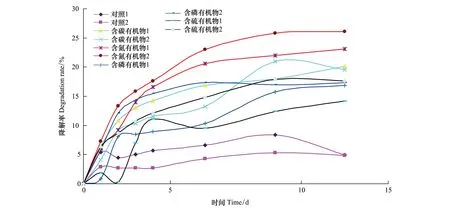
图3 在培养周期内有机物的生物可利用性Fig.3 The bioavailability of different DOC in the whole culture process in various bacterial cultures
式中,CDOC0和CDOC1分别表示培养初期和结束时DOC的浓度。计算结果如图3和表4所示。由图3可见,含氮有机物分解的最充分,然后是含碳有机物,含磷和含硫有机物分解略慢,天然水体中的有机物分解最慢。
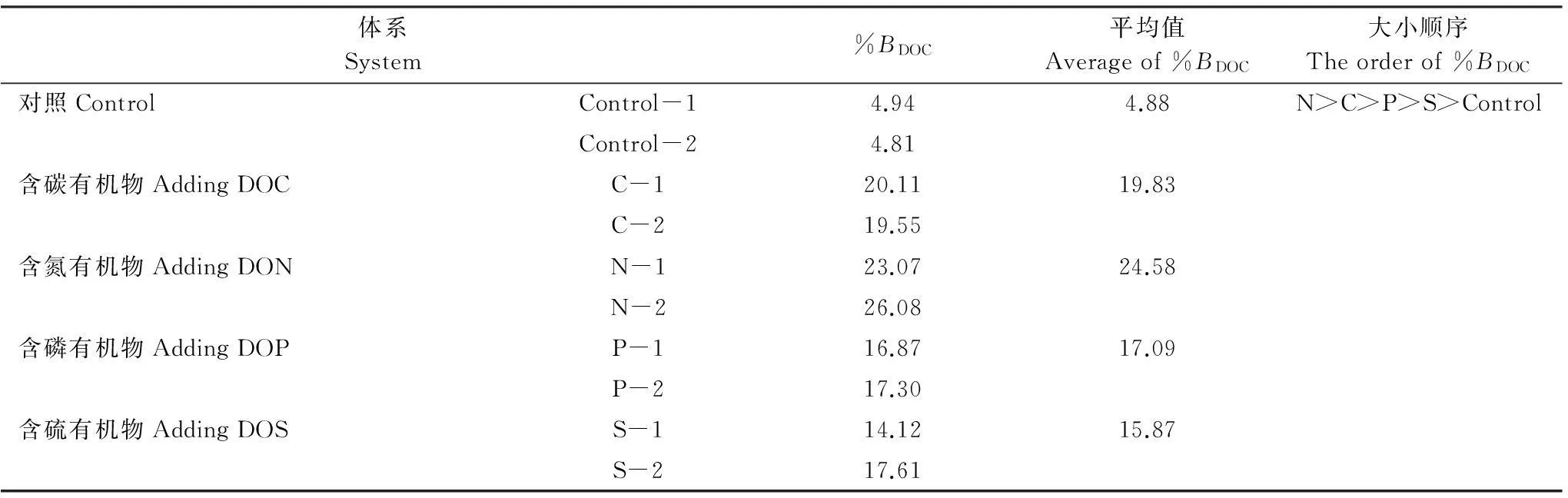
表4 DOC的生物可利用性%BDOC值
%BDOC: 有机物的生物可利用性bioavailability of DOC
由表4可以看出,含氮有机物的生物利用性最强,分解最快。其次是含碳有机物,然后是含磷有机物,天然有机物的生物可利用性最小。本文所取圣芭芭拉近岸天然海水中DOC浓度在66.6—80.4μmol/L之间,3月时,DOC浓度为(71.5±0.8)μmol/L[12]。Halewood等研究了该海区DOC的降解速率,结果表明,在7d内,DOC浓度降低为69μmol/L,26d时降低为68μmol/L,降低幅度为4.3%左右[12],跟本文对照组研究结果相近。在有外源性有机物加入的培养体系中,有机物的增加给细菌生长提供了相对丰富的营养,导致细菌生命活动加快,从而使有机物的分解量增加。研究表明,DOM的生物可利用性与其来源和性质有密切的关系[22],同时与水体中可能存在的无机营养盐有关[23- 24]。在本文其他条件均一致的情况下,有机分子的生源要素组成成为影响其生物可利用性的唯一因子。在海水中各元素相对平衡的条件下,加上外源有机物后,其降解要同时伴随着N的参与,因此含氮有机物的降解速率更快一些,其生物利用性也最高。
2.4.2有机碳的平均消耗速率
为了消除体系中细菌总量对分解有机物的影响,参照营养盐在藻类生长过程中的吸收速率[25- 26],提出单个细菌对有机碳的消耗速率公式:
(6)
式中,I为单个细胞对有机碳的消耗速率(μmol 个-1d-1);C0、C1分别为起始和指数生长期结束时的DOC浓度(μmol/L),t0、t1分别为起始和指数生长期结束时的时间,B(个/L)为指数生长期间细菌丰度的平均含量,用公式(7)计算:
(7)
式中,B0和B1分别为起始和指数生长期时的细菌丰度(个/L)。
不同体系中单个细菌对有机碳的消耗速率如表5所示。通过表5可以看出,在有外源性有机物添加的体系中,含氮有机物的平均消耗速率最高,含硫有机物的平均消耗速率最低,与细菌比生长速率和有机物消耗百分数的大小顺序一致,表明含有不同生源要素的有机物对细菌生长的促进作用有差异,从而造成有机物本身的矿化作用速率不同。其中,含氮有机物最容易被细菌吸收利用,同时矿物作用速率也最快,含硫有机物则相反。
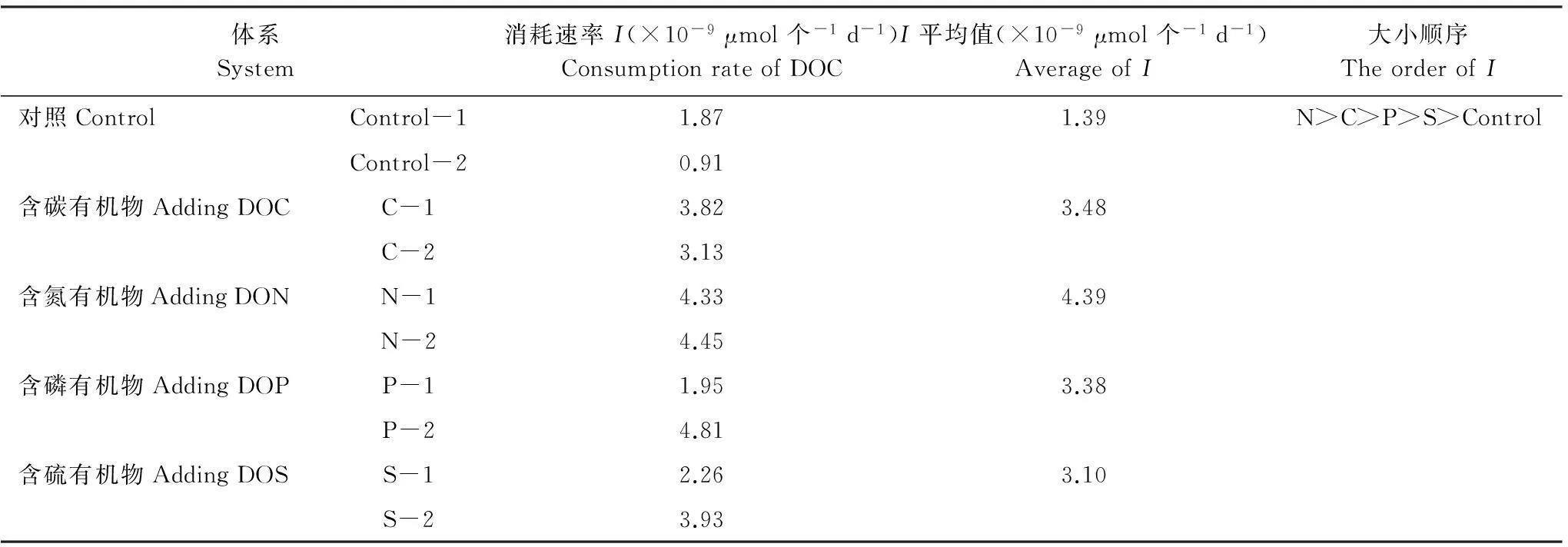
表5 不同体系中单个细菌对有机碳的消耗速率
3结论
由以上结果和分析可见,含有不同生源要素的有机物会对异养细菌的生长产生不同的影响,其中,含氮有机物对细菌生长的促进作用最明显,其生物利用性最强,分解速率也最快,其次是含磷有机物,含硫有机物对细菌生长的促进作用最弱,分解速率也最慢,生物利用性最低。可见,天然水体中的有机物种类和细菌成长密切相关,但细菌生长效率与有机物种类关系不大。
参考文献(References):
[1]陈碧鹃, 李秋芬, 陈聚法, 马绍赛, 崔毅, 辛福言. 乳山湾东流区细菌数量的分布及与环境因子关系的研究. 海洋水产研究, 1997, 18(2): 79- 85.
[2]Cheerier J, Bauer J E, Druffel E R M. Utilization and turnover of labile dissolved organic matter by bacterial heterotrophs in eastern North Pacific surface waters. Marine Ecology-Progress Series, 1996, 139: 267- 279.
[3]孙书存, 陆健健. 微型浮游生物生态学研究概述. 生态学报, 2001, 21(2): 302- 308.
[4]Uwe Münster, Ryszard J Chróst. Origin, composition, and microbial utilization of dissolved organic matter // Overbeck J, Chróst R J, eds. Aquatic Microbial Ecology: Biochemical and Molecular Approaches. New York: Springer-Verlag, 1990: 8- 46.
[5]Craig A Carlson, Dennis A Hansell, Norman B Nelson, David A Siegel, William M Smethie, Samar Khatiwala, Meredith M Meyers, Elisa Halewood. Dissolved organic carbon export and subsequent remineralization in the mesopelagic and bathypelagic realms of the North Atlantic basin. Deep Sea Research Part II: Topical Studies in Oceanography, 2010, 57(16): 1433- 1445.
[6]Craig E Nelson, Craig A Carlson. Tracking differential incorporation of dissolved organic carbon types among diverse lineages of Sargasso Sea bacterioplankton. Environmental Microbiology, 2012, 14(6): 1500- 1516.
[7]Masanori Fujii, Hisaya Kojima, Tomoya Iwata, Jotaro Urabe, Manabu Fukui. Dissolved organic carbon as major environmental factor affecting bacterioplankton communities in mountain lakes of Eastern Japan. Microbial Ecology, 2012, 63(3): 496- 508.
[8]Laura Gomez-Consarnau, Markus V Lindh, Josep M Gasol, Jarone Pinhassi. Structuring of bacterioplankton communities by specific dissolved organic carbon compounds. Environmental Microbiology, 2012, 19(4): 2361- 2378.
[9]David L Kirchman, Richard G Keel, Meinhard Simon, Nicholas A Welschmeyer. Biomass and production of heterotrophic bacterioplankton in the oceanic subarctic pacific. Deep Sea Research PartⅠ: Oceanographic Research Papers, 1993, 40(5): 967- 988.
[10]Karin Björkmen, David W Karl. Bioavailability of inorganic and organic phosphorus compounds to natural assemblages of microorganisms in Hawaiian coastal waters. Marine Ecology Progress Series, 1994, 111: 265- 273.
[11]张晓华. 海洋微生物学. 青岛: 中国海洋大学出版社, 2007.
[12]Elisa R Halewood, Craig A Carlson, Mark A Brzezinski, Daniel C Reed, Jo Goodman. Annual cycle of organic matter partitioning and its availability to bacteria across the Santa Barbara Channel continental shelf. Aquatic Microbial Ecology, 2012, 67: 189- 209.
[13]李洪波, 肖天, 赵三军, 岳海东. 海洋异养浮游细菌参数的测定和估算. 海洋科学, 2005, 29(2): 58- 63.
[14]Nelson D Sherry, Philip W Boyd, Kugako Sugimoto, Paul J Harrison. Seasonal and spatial patterns of heterotrophic bacterial production, respiration, and biomass in the subarctic NE Pacific. Deep Sea Research PartⅡ: Topical Studies in Oceanography, 1999, 46(11- 12): 2557- 2578.
[15]Enora Briand, Olivier Pringault, Séverine Jacquet, Jean-Pascal Torrtéon. The use of oxygen microprobes to measure bacterial respiration for determining bacterioplankton growth efficiency. Limnology and Oceanography, 2004, 2: 406- 416.
[16]Ram A S P, Nair S, Chandramohan D. Bacterial growth efficiency in the tropical estuarine and coastal waters of Goa, southwest coast of India. Microbial Ecology, 2003, 45(1): 88- 96.
[17]Paul A del Giorgio, Jonathan J Cole. Bacterial growth efficiency in natural aquatic systems. Annual Review of Ecology and Systematics, 1998, 29: 503- 541.
[18]Craig A Carlson, Hugh W. Ducklow. Growth of bacterioplankton and consumption of dissolved organic carbon in the Sargasso Sea. Aquatic Microbial Ecology, 1996, 10: 69- 85.
[19]王生福, 宋星宇, 黄良民, 谭烨辉. 海洋浮游细菌生长效率研究进展. 海洋科学, 2012, 36(5): 130- 138.
[20]Paul A del Giorgio, Jonathan J Cole, André Cimbleris. Respiration rates in bacteria exceed phytoplankton production in unproductive aquatic systems. Nature, 1997, 385(6612): 148- 151.
[21]Choon Weng Lee, Chui Wei Bong, Yiisiang Hii. Temporal variation of bacterial respiration and growth efficiency in tropical coastal waters. Applied and Environmental Microbiology, 2009, 75(24): 7594- 7601.
[22]Michael W Lomas, Nicholas R Bates. Potential controls on interannual partitioning of organic carbon during the winter/spring phytoplankton bloom at the Bermuda Atlantic time-series study (BATS) site. Deep Sea Research Part I: Oceanographic Research Papers, 2004, 51(11): 1619- 1636.
[23]Rainer M W Amon, Ronald Benner. Bacterial utilization of different size classes of dissolved organic matter. Limnology and Oceanography, 1996, 41(1): 41- 51.
[24]Rainer M W Amon, Hans-Peter Fitznar, Ronald Benner. Linkages among the bioreactivity, chemical composition, and diagenetic state of marine dissolved organic matter. Limnology and Oceanography, 2001, 46(2): 287- 297.
[25]Christine Ferrier-Pagès, Markus Karner, Fereidoun Rassoulzadegan. Release of dissolved amino acids by flagellates and ciliates grazing on bacteria. Oceanologica Acta, 1998, 21(3): 485- 494.
[26]白洁, 张昊飞, 李岿然, 孙靖. 海洋异养浮游细菌生物量及生产力的制约因素. 中国海洋大学学报: 自然科学版, 2004, 34(4): 594- 602.
Mineralization of different dissolved organic matter containing various biogenic elements by natural bacteria in seawater
TAN Liju1, XIAO Hui2, Craig A. CARLSON3, WANG Jiangtao1,*
1CollegeofChemistryandChemicalEngineering,OceanUniversityofChina,Qingdao266100,China
2CollegeofMarineLifeSciences,OceanUniversityofChina,Qingdao266003,China
3Ecology,EvolutionandMarineBiology,UniversityofCalifornia,SantaBarbara,CaliforniaCA93106-6150,USA
Abstract:Heterotrophic bacteria in seawater play an important role in biogeochemical cycling of biogenic elements. The decomposition rate of different dissolved organic matter (DOM) is related to the amount of heterotrophic bacteria, and the biological utilization ratio of DOM influences the growth of bacteria. In this study, mineralization and the effect of four kinds of DOM with similar structure but different biogenic elements on bacterial growth were investigated. The results suggested that organic matter added to cultures promoted the growth of natural marine heterotrophic bacteria, and the order of specific growth rate (μ) was as follows: N > C > P > S > control. DOM with nitrogen and carbon was the most effective in accelerating the growth of bacteria. The order of bacterial growth efficiency was as follows: Control > C > P > N > S; these results indicated that bacterial secondary production has no direct correlation with the decomposition rate of organic matter. The consumption rate of organic matter per individual bacterium (I) was in the following order: N > C > P > S > control, which was the same for biological availability of different organic matter. These results suggested that the mineralization rate is different for various organic matters having similar structure but different biogenic elements. The organic matter with nitrogen was decomposed most easily, followed by carbonaceous organic matter and organic phosphorus, but organic sulfur remained somewhat refractory to decomposition.
Key Words:heterotrophic bacteria; dissolved organic matter; biogenic element; mineralization
DOI:10.5846/stxb201408291720
*通讯作者Corresponding author.E-mail: jtwang@ouc.edu.cn
收稿日期:2014- 08- 29;
修订日期:2015- 06- 01
基金项目:国家海洋局海洋生态环境科学与工程重点实验室开放基金(MESE- 2014-03)
谭丽菊,肖慧,Craig A. Carlson,王江涛.海水中天然细菌对不同生源要素有机物的矿化作用.生态学报,2016,36(1):77- 85.
Tan L J, Xiao H, Craig A. Carlson, Wang J T.Mineralization of different dissolved organic matter containing various biogenic elements by natural bacteria in seawater.Acta Ecologica Sinica,2016,36(1):77- 85.
