合并2型糖尿病的维持性血液透析患者左心室舒张功能特点分析
2016-03-10廖兵余湘宁石宏斌沈文翔钟焕
廖兵,余湘宁,石宏斌,沈文翔,钟焕
(南宁市第一人民医院肾内科,广西 南宁 530022)
合并2型糖尿病的维持性血液透析患者左心室舒张功能特点分析
廖兵,余湘宁,石宏斌,沈文翔,钟焕
(南宁市第一人民医院肾内科,广西 南宁 530022)
目的 探讨合并2型糖尿病的血液透析患者的左室舒张功能变化特点。方法选择接受规律透析的终末期肾病(ESRD)患者105例,根据有无2型糖尿病,将患者分为合并糖尿病组37例和非糖尿病组68例。对两组患者进行常规和组织多普勒显像(TDI)超声心动检查,观察两组左室舒张功能的区别。结果常规超声心动图结果显示,合并糖尿病组患者的左心房内径(LAD)为(42.1±6.0)mm,而非糖尿病组为(39.8±7.3)mm,P=0.022;合并糖尿病组的室间隔舒张末期厚度(IVSd)为(15.1±4.2)mm,而非糖尿病组为(13.5±4.8)mm,两组比较差异均具有统计学意义(P=0.017<0.05),提示合并2型糖尿病组患者左心房内径较大,舒张期室间隔变厚。TDI显示,合并2型糖尿病组的二尖瓣舒张早期与瓣环运动峰值速度比值(E/e′)为(13.2±4.3),非糖尿病组为(11.9±4.3),两组比较差异具有统计学意义(P<0.05);两组的二尖瓣环舒张早期峰值速度(e′)分别为(7.0±2.1)cm/s和(7.6±1.8)cm/s;两组的二尖瓣瓣环运动峰值早期和晚期速度比值(e′/a′)分别为(0.66±0.43)和(0.79±0.32),差异均具有统计学意义(P<0.05)。结论与非糖尿病组比较,合并2型糖尿病的维持性血液透析患者的左室舒张功能不全更为严重。
血液透析;糖尿病;舒张功能不全;超声心动图
糖尿病肾病是终末期肾病(End-stage renal disease,ESRD)进入维持性血液透析的常见病因[1],而且死亡率明显高于非糖尿病肾病,这可能是糖尿病患者更易发生左心室肥厚、冠心病等心血管疾病所致。临床中ESRD患者的心功能不全主要表现为舒张功能障碍,但是研究发现,常规心脏超声检查会低估维持性血液患者左心室舒张功能不全的发病率。组织多普勒显像(Tissue Doppler imaging,TDI)作为一种新的检测手段,可以敏感、全面地综合评价心室整体功能表现,为临床定量评价心功能提供一种新的手段[2],但是国内对合并糖尿病的维持性血透患者左心室舒张功能不全的研究报道较少。本研究旨在通过联合常规多普勒超声心动图和TDI检测维持性血液透析患者左心室结构与功能变化,观察合并2型糖尿病的维持性血液透析患者与非糖尿病的维持性血液透析患者左室舒张功能的异同,为临床诊断和决策提供依据。
1 资料与方法
1.1 一般资料 选取2011年1月至2014年12月间在本院血透室接受规律血液透析的患者共105例,排除透析时间小于1年以及患有房颤、充血性心力衰竭、心脏瓣膜疾病以及不规律透析的患者。根据有无2型糖尿病,将患者分为合并糖尿病组37例和非糖尿病组68例。所有入选患者均签署知情同意书,均接受常规透析每周2~3次,每次4 h,采用费森尤斯4008B透析机。
1.2 观察指标
1.2.1 生化指标 收集患者年龄、性别、原发疾病等临床信息。留取患者透析前静脉血标本,检测生化指标包括血肌酐、尿素氮、尿酸、钙、磷、糖化血红蛋白、总胆固醇、甘油三脂等。
1.2.2 心脏结构及功能检测 采用美国飞利浦iE33彩色多普勒超声诊断仪,测量两组患者左心房内径(LAd)、左心室舒张末期内径(LVDd)、左心室收缩末期内径(LVESd);左心室后壁厚度(LVPWd)、舒张末期室间隔厚度(IVSd)、左心室射血分数(LVEF)、等容舒张时间(IRT)、二尖瓣前向血流E峰与A峰比值(E/A)。组织多普勒显像(TDI)检测二尖瓣血流舒张早期与瓣环运动峰值速度比值(E/e′)、二尖瓣瓣环运动峰值早期和晚期速度比值(e′/a′)。
1.3 统计学方法 应用SPSS19.0软件包进行数据统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验,组间计数资料采用χ2检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患者的一般临床资料比较 合并2型糖尿病的ESRD患者与非糖尿病的ESRD患者的年龄、性别、血压、血肌酐及钙磷水平等指标比较,差异均无统计学意义(P>0.05);与非糖尿病组比较,合并2型糖尿病组患者的甘油三脂水平及糖化血红蛋白均较高,差异均有统计学意义(P<0.05),见表1。
表1 两组患者的一般临床资料(±s)
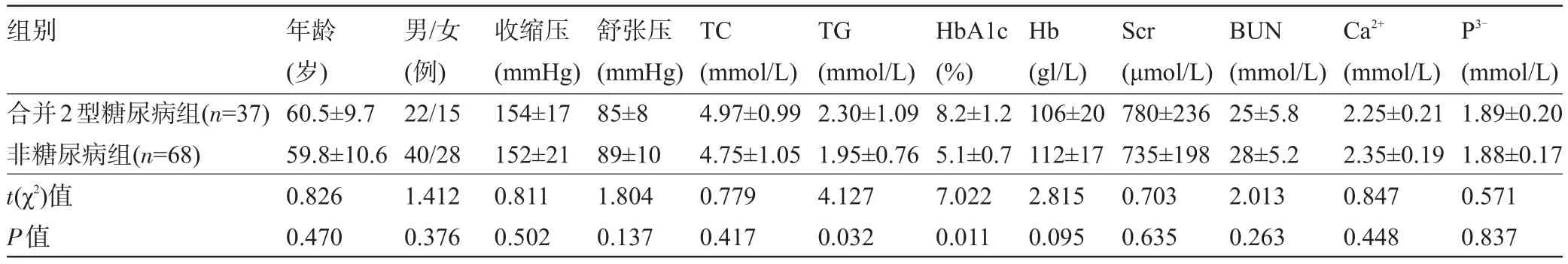
表1 两组患者的一般临床资料(±s)
注:1 mmHg=0.133 kPa。
组别P3-合并2型糖尿病组(n=37)非糖尿病组(n=68) t(χ2)值P值年龄(岁) 60.5±9.7 59.8±10.6 0.826 0.470男/女(例) 22/15 40/28 1.412 0.376收缩压(mmHg) 154±17 152±21 0.811 0.502舒张压(mmHg) 85±8 89±10 1.804 0.137 TC (mmol/L) 4.97±0.99 4.75±1.05 0.779 0.417 TG (mmol/L) 2.30±1.09 1.95±0.76 4.127 0.032 HbA1c (%) 8.2±1.2 5.1±0.7 7.022 0.011 Hb (gl/L) 106±20 112±17 2.815 0.095 Scr (μmol/L) 780±236 735±198 0.703 0.635 BUN (mmol/L) 25±5.8 28±5.2 2.013 0.263 Ca2+(mmol/L) 2.25±0.21 2.35±0.19 0.847 0.448 (mmol/L) 1.89±0.20 1.88±0.17 0.571 0.837
2.2 常规超声心动图结果比较 常规超声心动图结果显示,与非糖尿病组比较,合并2型糖尿病的维持性血液透析患者LAd变大,IVSd变厚,组间比较差异均具有统计学意义(P<0.05),而LVPWd、LVEDd、LVESd、IVSd、LVEF和IVRT、E/A在两组间比较差异均无统计学意义(P>0.05),见表2。
表2 两组患者常规超声心动图结果比较(±s)

表2 两组患者常规超声心动图结果比较(±s)
组别合并2型糖尿病组(n=37)非糖尿组(n=68) t值P值LAD(mm) 42.1±6.0 39.8±7.3 4.817 0.022 LVPWd(mm) 11.8±2.3 10.8±3.2 1.858 0.171 LVEDd(mm) 49.5±5.2 49.0±5.9 0.799 0.432 LVESd(mm) 29.6±7.0 29.6±5.0 0.451 0.864 IVSd(mm) 15.1±4.2 13.5±4.8 6.886 0.017 LVEF(%) 64±8 63±10 3.253 0.081 E/A 0.87±0.33 0.89±0.72 2.371 0.134 IVRT(ms) 110±19 104±25 2.210 0.099
2.3 TDI检测结果比较 TDI结果显示,与非糖尿病组比较,合并2型糖尿病的维持性血液透析患者e′和e′/a′降低,而E/e′升高,组间比较差异具有统计学意义(P<0.05),见表3。
表3 两组患者的TDI结果比较(±s)
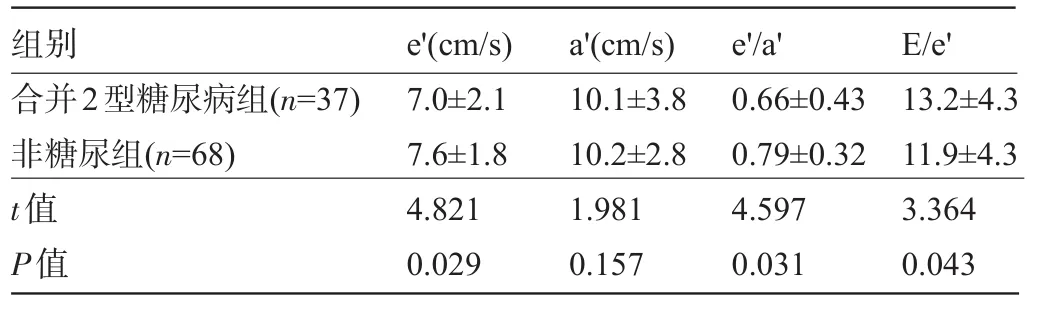
表3 两组患者的TDI结果比较(±s)
组别e′(cm/s)a′(cm/s)e′/a′E/e′合并2型糖尿病组(n=37)非糖尿组(n=68) t值P值7.0±2.1 7.6±1.8 4.821 0.029 10.1±3.8 10.2±2.8 1.981 0.157 0.66±0.43 0.79±0.32 4.597 0.031 13.2±4.3 11.9±4.3 3.364 0.043
3 讨 论
心血管疾病是造成维持性血液透析患者死亡的最主要原因[3]。在大多数ESRD患者中,心脏收缩功能常正常,而近75%的患者存在左心室肥厚。研究发现左室舒张功能不全是预测患者死亡风险的独立危险因素[4]。最近研究发现,即使在轻中度肾功能不全的患者中,也存在着不同程度的左心功能不全[5],而且随着病程的进展逐渐加重[6],合并2型糖尿病的维持性透析患者其心血管事件发生率和死亡率更高,因为糖尿病患者心肌病变早期主要是以舒张功能不全为主,并进而引起收缩功能障碍,但很多糖尿病患者左心室舒张功能障碍并不能在病变早期被诊断[7]。因此,对维持性血液透析患者心血管疾病的早期诊断及早期干预就显得至关重要,而且左心房容积指数是糖尿病患者左心室舒张功能不全的一个独立预测因素[7]。超声心动图作为一种临床常用的无创检测手段,是诊断CKD患者心血管疾病最主要的手段。本研究通过采用常规超声心动图和TDI检测,探讨合并2型糖尿病维持性血液透析患者的心脏结构和功能改变的特点。
本研究结果发现合并2型糖尿病维持性血透患者存在着明显的左室舒张功能不全。常规超声心动图发现与非糖尿病组相比,合并2型糖尿病的ESRD患者的LVPWd、LVEDd、E/A等均无显著差异,仅左心房内径增大和室间隔舒张末期厚度变厚,部分结果与国内相关报道相符[8]。而利用TDI,发现合并糖尿病的ESRD患者e′/a′明显降低,而E/e′明显升高,提示合并合并2型糖尿病的患者舒张末期心室充盈压明显升高,提示合并糖尿病的患者存在更为严重的左心室舒张功能不全。以往的研究也发现在无心脏病症状的糖尿病患者中,TDI能够较早的检测出左心室舒张功能不全[9]。Nardi等[10]发现,与血糖正常患者比较,肾功能不全合并2型糖尿病患者存在更严重的左室舒张功能不全,主要表现为二尖瓣外侧环舒张早期运动速度明显降低和左心房容积指数明显升高。本研究在维持性血液透析患者中也有类似的发现。研究也发现,合并糖尿病的维持性血液透析患者心室舒张早期峰速度、心肌收缩期峰速度均显著降低,而E/e′则显著升高,且E/e′与患者的左心房容量指数、年龄和血压呈正相关[11]。这种变化可能是糖尿病患者心肌纤维化引起的心肌顺应性降低所致,研究表明这种改变主要与心肌纤维化有关,而与心室肥厚无关。常规超声心动图显示,合并糖尿病患者左心房内径明显变大,这可能是因为心室顺应性下降导致心室充盈压升高,长时间左心房为了维持较高的压力造成心房变大[12]。Kim等[13]发现E/e′比值能够较好的预测伴舒张功能不全的CKD患者的心血管事件的发生率及死亡率,有较好的敏感性和特异性。
合并糖尿病的ESRD患者左室舒张功能不全更严重,可能是因为糖尿病患者更易发生心脏微血管病变以及心脏自主神经病变[14]。此外,糖尿病患者普遍存在氧化应激及脂质代谢紊乱,均会促进心肌纤维化,导致心肌肥厚和心肌顺应性的降低,从而导致左室舒张功能不全的发生。在CKD 3~4期的糖尿病肾病患者中还发现,血浆磷水平是患者心血管事件发生率及进入透析的独立危险因素[15],但本研究发现两组患者磷水平无明显差异。
综上所述,与血糖正常患者比较,合并2型糖尿病的维持性血透患者其左室舒张功能不全更严重,提示临床中对合并糖尿病的血透患者需关注其心脏功能变化;与常规的超声心动图比较,TDI在评价维持性血透患者左室舒张功能具有优势,更能敏感地发现左室舒张功能不全,具有较好的临床应用价值。由于很多糖尿病患者不能排除存在原发性肾脏疾病的可能,本研究只是研究合并糖尿病对血透患者心脏结构与功能的影响。此外,本研究所纳入的患者样本较小,需扩大样本进一步研究。
[1]中国医院协会血液净化中心管理分会血液透析登记组.我国面临快速增长的终末期肾病治疗负担[J].中国血液净化,2010,9(1): 47-49.
[2]杨晓丽,赵亚丽,郭娇贤.组织多普勒Tei指数评价肥胖性心肌病左、右心功能的价值[J].海南医学,2014,25(18):2695-2697.
[3] Chan KE,Maddux FW,Tolkoff-Rubin N,et al.Early outcomes among those initiating chronic dialysis in the United States[J].Clin J Am Soc Nephrol,2011,6(11):2642-2649.
[4]Farshid A,Pathak R,Shadbolt B,et al.Diastolic function is a strong predictor of mortality in patients with chronic kidney disease[J]. BMC Nephrol,2013,14:280.
[5]Asp AM,Wallquist C,Rickenlund A,et al.Cardiac remodelling and functional alterations in mild-to-moderate renal dysfunction:comparison with healthy subjects[J].Clin Physiol Funct Imaging,2015,35 (3):223-230
[6]Cai QZ,Lu XZ,Lu Y,et al.Longitudinal changes of cardiac structure and function in CKD(CASCADE study)[J].J Am Soc Nephrol, 2014,25(7):1599-1608.
[7]谈君,周达琼,陶含嫣,等.左心房容积指数评价2型糖尿病患者左心室舒张功能不全的研究[J].海南医学,2011,22(23):122-123.
[8]彭斌,许涛,盛晓华,等.糖尿病肾病致终末期维持性血液透析患者的心脏结构及功能特点分析[J].中国中西医结合肾病杂志,2014, 15(1):20-23.
[9]Hayashi SY,Brodin LA,Alvestrand A,et al.Improvement of cardiac function after haemodialysis.Quantitative evaluation by colour tissue velocity imaging[J].Nephrol Dial Transplant,2004,19(6): 1497-1506.
[10]Nardi E,Palermo A,Mule G,et al.Impact of type 2 diabetes on left ventricular geometry and diastolic function in hypertensive patients with chronic kidney disease[J].J Hum Hypertens,2011,25(3): 144-151.
[11]Hung KC,Lee CH,Chen CC,et al.Advanced left ventricular diastolic dysfunction in uremic patients with type 2 diabetes on maintenance hemodialysis[J].Circ J,2012,76(10):2380-2385.
[12]Shizuku J,Yamashita T,Ohba T,et al.Left atrial volume is an independent predictor of all-cause mortality in chronic hemodialysis patients[J].Intern Med,2012,51(12):1479-1485.
[13]Kim MK,Kim B,Lee JY,et al.Tissue Doppler-derived E/e′ratio as a parameter for assessing diastolic heart failure and as a predictor of mortality in patients with chronic kidney disease[J].Korean J Intern Med,2013,28(1):35-44.
[14]Pop-Busui R,Cleary PA,Braffett BH,et al.Association between cardiovascular autonomic neuropathy and left ventricular dysfunction: DCCT/EDIC study(Diabetes Control and Complications Trial/Epidemiology of Diabetes Interventions and Complications)[J].J Am Coll Cardiol,2013,61(4):447-454.
[15]Silva AP,Fragoso A,Pinho A,et al.Phosphorus as an early marker of morbidity and mortality in type 2 chronic kidney disease diabetic patients[J].J Diabetes Complications,2013,27(4):328-332.
Characteristics of left ventricular diastolic function in patients with type 2 diabetes mellitus on maintenance hemodialysis.
LIAO Bing,YU Xiang-ning,SHI Hong-bin,SHEN Wen-xiang,ZHONG Huan.Department of Nephrology, the First People's Hospital of Nanning,Nanning 530022,Guangxi,CHINA
ObjectiveTo explore the change of left ventricular diastolic function in patients with type 2 diabetes mellitus(T2DM)on maintenance hemodialysis.MethodsA total of 105 patients of end-stage renal disease(ESRD) on maintenance hemodialysis were divided into two groups based on the presence or absence of T2DM:T2DM group(n= 37)and non-T2DM group(n=68).The two groups of patients all received conventional and tissue Doppler imaging (TDI)echocardiography,and the left ventricular diastolic function was observed in the two groups.ResultsConventional echocardiography showed that the left atrial diameter(LAD)was(42.1±6)mm in T2DM group and(39.8±7.3)mm in non-T2DM group,with statistically significant difference between the two groups(P=0.022<0.05).The interventricular septal diastolic(IVSd)was(15.1±4.2)mm in T2DM group and(13.5±4.8)mm in non-T2DM group,with statistically significant difference between the two groups(P=0.017<0.05).The results suggest that LAD is larger in patients with T2DM than those without T2DM,and IVSd is thicker.TDI showed that early-diastolic mitral annulus motion and peak velocity ratio(E/e′)was(13.2±4.3)in T2DM group and(11.9±4.3)in non-T2DM group,and the difference was statistically significance(P<0.05).Early-diastolic peak velocity of mitral annulus(e′)of the two groups were(7.0±2.1)cm/s and(7.6±1.8)cm/s,and the ratio of early-diastolic and late-diastolic peak velocity of the mitral annulus(e′/a)of the two groups were(0.66±0.43)and(0.79±0.32),with statistically significant differences between the two groups(P<0.05)).ConclusionCompared with patients without diabetes mellitus,patients with diabetes mellitus on maintenance hemodialysis had worse left ventricular diastolic dysfunction.
Hemodialysis;Diabetes mellitus;Diastolic dysfuction;Echocardiography
R459.5
A
1003—6350(2016)04—0542—03
10.3969/j.issn.1003-6350.2016.04.009
2015-07-04)
廖兵。E-mail:lbing197@hotmail.com
