骨髓间充质干细胞对继发性骨质疏松大鼠骨缺损愈合的影响
2016-03-07高翔陈广谋黄成硕刘志军曾荣楚佳奇李鹏
高翔,陈广谋,黄成硕,刘志军,曾荣,楚佳奇,李鹏
(1.广东医科大学附属医院干细胞研发与细胞治疗中心,广东 湛江 524001;2.广东医科大学附属医院微创骨科研究室,广东 湛江 524001)
·论 著·
骨髓间充质干细胞对继发性骨质疏松大鼠骨缺损愈合的影响
高翔1,陈广谋2,黄成硕2,刘志军2,曾荣2,楚佳奇1,李鹏1
(1.广东医科大学附属医院干细胞研发与细胞治疗中心,广东 湛江 524001;2.广东医科大学附属医院微创骨科研究室,广东 湛江 524001)
目的探讨骨髓间充质干细胞(BMSCs)在继发性骨质疏松性的个体骨缺损愈合过程中的作用。方法采用全骨髓贴壁分离法培养原代BMSCs细胞,并使用流式细胞仪检测及使用成骨成脂特异性染色鉴定培养的BMSCs;选取60只雌性SD大鼠,通过肌注地塞米松(DEX,1 mg·kg-1·d-1)8周,建立大鼠骨质疏松模型。所有大鼠经手术于胫骨平台下钻孔造骨缺损模型,将大鼠随机分成三组:对照组(NS组,骨折不处理)、DEX骨折+生理盐水(NS)组、DEX+BMSCs组,将BMSCs注射到大鼠骨缺损部位治疗(采用生理盐水进行对照),于术后4周和8周,采用Micro-CT检测各组大鼠的骨缺损愈合情况。结果经流式细胞表型鉴定及成骨成脂特异性染色实验均证实分离得到的细胞是BMSCs。Micro-CT结果表明,与DEX+NS组比较,BMSCs细胞治疗能促进DEX诱导的骨质疏松性骨折的愈合。结论BMSCs对继发性骨质疏松性大鼠的骨缺损具有显著的促进愈合作用,这为临床治疗继发性骨质疏松个体的骨损伤提供了一种新的研究思路。
SD大鼠;骨质疏松;骨髓间充质干细胞;骨缺损
糖皮质激素(glucocorticoid,GC)是由肾上腺皮质束状带合成和分泌的一类甾体激素,由于其强大的抗炎和免疫抑制等作用,在临床治疗中应用十分广泛,但是长期使用却会引起骨量丢失,继而导致糖皮质激素性骨质疏松(glucocorticoid induced osteoporosis,GIOP)的发生[1]。有研究表明GIOP患者发生骨折的风险是正常人的两倍[2],并且骨折的风险与激素的使用呈剂量依赖性[3]。骨折是GIOP最严重的并发症之一,严重者还会导致残疾,给家庭和社会带来巨大的经济负担[4]。GIOP患者的骨损伤(骨缺损或骨折)后愈合困难,目前对于此类患者的有效药物治疗较少,也存在易诱发肿瘤、价格昂贵等问题[5]。近年来,越来越多的学者关注利用干细胞强大的组织修复能力对骨质疏松及骨损伤修复治疗[6]。骨髓基质干细胞(bone mesenchymalstem cells,BMSCs)是一种自我更新和多向分化能力的成体干细胞,是成骨细胞的源头细胞,特定条件下,BMSCs可以向成骨细胞分化,进而生成骨细胞发挥成骨作用[7]。此外,BMSCs具有易获得、低免疫原性、可移植性、组织修复能力等生物学特性[8]。随着科学技术的发展,这些生物学特性为BMSCs在再生医学中的应用奠定了基础,对治疗骨质疏松和修复骨缺损具有重要意义。因此,本实验拟采用全骨髓贴壁分离法体外分离大鼠BMSCs,通过利用BMSCs的干预治疗来观察BMSCs对治疗骨质疏松性大鼠骨缺损的影响,以期为BMSCs的临床应用提供理论依据。
1 材料与方法
1.1 实验试剂 SPF级SD大鼠购于广西医科大学实验动物中心;胰蛋白酶、低糖DMEM培养基、胎牛血清(Gibco,美国);茜素红染液、成脂诱导培养基,油红O染液(赛业生物,中国);地塞米松、β-甘油磷酸钠和抗坏血酸(Sigma,美国);PE标记的大鼠来源的抗CD29、CD44、CD31、CD45、CD34、CD90及IgG(BD,美国)。
1.2 仪器设备 MEDI LINK双能X线骨密度检测仪(Osteospace,法国);倒置显微镜(Leica,德国);Micro-CT 40(Scanco,瑞士);高速冷冻离心机(Thermo,美国);流式细胞仪(BD,美国)。
1.3 方法
1.3.1 继发性骨质疏松性骨缺损模型的建立方法 选取雌性12周SD大鼠60只,随机分为三组,每组20只,分别为对照组(NS组,骨缺损不处理)、DEX骨缺损+生理盐水组(DEX+NS组)、DEX骨缺损+ BMSCs治疗组(DEX+BMSCs组)。除对照组骨缺损不处理组外,其余两组大鼠使用肌内注射地塞米松1 mg·kg-1·d-1,3次/周,持续8周,建立GIOP模型,对照组骨折不处理组采用肌内注射生理盐水1 mL·kg-1·d-1作为对照,给药方案与地塞米松造模相同。8周后检测大鼠股骨骨密度,然后所有大鼠进行双侧胫骨骨缺损手术:用低速骨钻在大鼠胫骨平台下外侧钻约2.0 mm的圆孔缺损,缺损应达到骨髓腔,但不穿透对侧皮质,向骨髓腔中注射BMSCs(数量为1×106个/20µL)/生理盐水20µL。骨缺损手术后进行常规抗感染处理,肌内注射1 000 000 U青霉素/只大鼠。大鼠术后第2天开始正常喂养,大鼠于术后第3天、第4周和第8周使用活体显微CT成像系统观察分析骨缺损愈合情况。
1.3.2 BMSCs原代分离及培养 选取4~6周SPF级SD大鼠,颈椎脱臼处死后浸泡于75%乙醇消毒5~10 min后于超净台中取其两侧的股骨胫骨,并剪去上下两端,暴露骨髓腔,用L-DMEM完全培养基(含10%胎牛血清)反复冲洗骨髓腔,收集细胞悬液于15 mL离心管中,1 000 r/min离心5 min,弃上清,加入L-DMEM完全培养基轻轻吹打成单细胞悬液并接种
1.3.3 BMSC表面分子鉴定 选取P3代生长状态良好的细胞,0.25%胰酶消化,1 000 r/min离心5 min,磷酸盐缓冲液(PBS)清洗细胞2~3次,1 000 r/min离心5 min后用PBS重悬细胞制成单细胞悬液分装于离心管(EP管)中,每支EP管分别加入PE标记的大鼠来源的抗CD29、CD44、CD31、CD45、CD34和CD90,对照组加入同型对照,混匀。室温避光孵育30 min,离心弃上清,PBS洗去未标记抗体,每管加入400µL PBS重悬细胞,利用流式细胞术进行BMSC鉴定。
1.3.4 BMSCs成骨诱导实验 选取P3代BMSCs接种于十二孔板中,待细胞贴壁生长至细胞密度达到90%~100%时,分别加入成骨诱导培养基或完全培养基,每3 d换液一次,细胞诱导14 d后,70%乙醇固定15 min,使用茜素红进行染色,而后用倒置显微镜观察并拍照。
1.3.5 BMSCs成脂诱导实验 选取P3代BMSCs接种于十二孔板中,分别加入成脂诱导培养基或完全培养基,每3 d换液一次,细胞诱导14 d后,4%多聚甲醛固定15 min,使用油红O进行染色,而后用倒置显微镜观察并拍照。
1.3.6 骨密度检测 大鼠肌注地塞米松或生理盐水8周后,对大鼠股骨部位进行骨密度扫描分析,确认骨质疏松造模是否成功。
1.3.7 Micro-CT法对骨微结构的检测 术前、术后第3天、4周及8周分别对大鼠进行骨微结构扫描。大鼠经水合氯醛麻醉后固定于Micro-CT扫描管中,确定扫描范围,沿骨长轴方向利用Micro-CT进行扫描,扫描条件为:电压70 kVp,电流114 μA,扫描分辨率2048×2048。选取感兴趣区域和重建阈值:该实验选取大鼠胫骨手术部位为重建区域,重建阈值均为190,对所有扫描股骨的区域进行三维重建。分析数据和图片。
2 结 果
2.1 BMSCs表面标志物的表达 流式细胞仪检测结果显示,CD44、CD29和CD90在BMSCs中高表达,阳性率分别为95.7%、99.7%和99.8%,而CD31、CD45、CD34低表达,阳性率仅为1.2%、0.8%和0.4%,见图1。

图1 大鼠骨髓间充质干细胞表面标志物的表达情况
2.2 BMSCs成骨和成脂诱导分化鉴定 BMSCs成骨诱导培养14 d后,茜素红染色结果显示细胞间质内含大量矿盐沉积的钙化结节呈红色(图2A);成脂诱导培养14 d后,油红O染色可见胞浆内出现较多红色脂滴并合并成串珠状(图2B)。

图2 大鼠骨髓间充质干细胞成骨成脂诱导情况
2.3 大鼠肌注DEX和NS前后骨密度的测定 大鼠通过肌注DEX来建立GIOP模型。肌注后大鼠股骨的骨密度显著低于DEX肌注前和NS肌注后(图3A);Micro-CT分析结果也显示与NS肌注后比较,DEX肌注后大鼠骨微结构恶化,骨小梁厚量降低(图3B)。结果证明GIOP模型建模成功。
2.4 SD大鼠继发性骨质疏松性骨缺损愈合情况 Micro-CT成像可用于反映骨痂的连续性和测量骨痂容积,矿化比例。与DEX+NS组比较,DEX+ BMSCs组在术后4周时显示出更好的骨痂连续性;术后8周,DEX+BMSCs组骨缺损愈合处的骨小梁密度和粗细均一程度均高于DEX+NS组,骨缺损间隙的桥梁骨痂完全骨化,骨折端之间形成骨连接,与对照组恢复情况基本相同,提示重建修复情况良好(图4)。

图3 SD大鼠股骨骨密度(g/cm3)
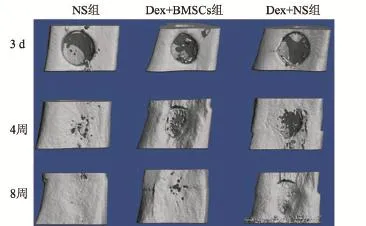
图4 Micro-CT检测不同时间段各组大鼠骨缺损手术后愈合情况
3 讨 论
本研究采用1 mg·kg-1·d-1地塞米松,3次/周,连续肌内注射8周后,模型组大鼠骨密度显著降低(P<0.01),骨微结构恶化,骨小梁厚量降低,成功建立大鼠骨质疏松模型。本研究在骨质疏松大鼠上进行胫骨骨缺损手术力求模拟临床上骨质疏松患者的骨损伤。从最终显微CT的分析结果可知,骨质疏松大鼠骨缺损后,其愈合过程较正常大鼠延迟大约4周。正常大鼠骨缺损仅需要4周时间,缺损部位基本修复完全,而骨质疏松大鼠则需要8周时间才能基本完成缺损部位修复。
骨质疏松性骨折(osteoporosis fracture,OPF)是骨质疏松症最严重的并发症[9],因此OPF在治疗及愈合过程除了单纯的外科治疗外更应该需要重视骨质疏松(OP)的治疗[10]。糖皮质激素(GC)长期使用引起骨质疏松的主要原因之一是GC对成骨细胞的抑制作用[11],GIOP患者由于成骨作用不足,在其发生骨损伤的情况下,成骨能力的不足造成骨骼愈合的缓慢。因此解决骨质疏松患者骨损伤愈合延迟的关键在于提高患者的成骨作用。成骨细胞和成骨作用直接相关,成骨细胞增多或成骨细胞活性增强均可提高成骨作用。
近年来,随着组织工程学和细胞治疗学的兴起,干细胞移植治疗OPF已成为研究热点。因为骨髓基质干细胞是成骨细胞的祖细胞,具有良好的成骨细胞分化潜能和成骨活性,可在细胞因子刺激下转化成为成骨细胞,所以BMSC作为骨组织修复手段的研究日益增多。大量研究表明通过移植BMSCs来治疗骨折后的骨不连症状,多数取得积极的效果[12]。Uejima等[13]将同种异体的BMSCs注射到去卵巢骨质疏松大鼠模型的股骨髓腔中,可以显著提高该区域的骨密度,增强生物力学强度。Takada等[14]在SAMP6模型鼠中注射同种异体骨髓至小鼠胫骨骨髓腔中,打破了破骨细胞与成骨细胞的平衡,提高了骨组织细胞的数量和质量,增加了该区域的骨密度。这些实验都证明可以用BMSCs移植手段来达到治疗骨质疏松的目的。
本实验通过采用全骨髓贴壁法分离、培养大鼠BMSCs后,通过流式细胞技术检测BMSCs表面标志物的表达,细胞表面抗原鉴定,以及使用茜素红和油红O染色鉴定的方法,确定本次研究所使用的细胞为BMSCs。采用制备的已鉴定的BMSCs对骨质疏松性大鼠骨缺损进行治疗干预后,Micro-CT结果显示,治疗4周后,骨质疏松性大鼠骨缺损部位已经大部分愈合,所形成的骨痂明显较生理盐水对照组大鼠多,治疗8周之后,DEX+BMSC组大鼠骨缺损愈合情况优于NS组,BMSCs组骨折线完全消失,骨折间隙的桥梁骨痂完全骨化,骨折端之间形成骨连接,已进入骨折端的塑形期,基本恢复正常骨骼形态,而DEX+NS组,骨痂尚未完全骨化,尚处于骨性愈合期。这些结果证明BMSCs可促进骨痂的形成,加快骨损伤的愈合过程。患者骨骼损伤时会触发一系列响应修复机制,调动沉睡的成骨前体细胞、骨衬细胞和骨髓基质干细胞等转化为成骨细胞启动骨骼修复,其中骨髓基质干细胞转化为成骨细胞途径是骨骼修复时成骨作用的重要来源。本实验通过治疗干预增加骨折修复所需的BMSC,s可极大地提供额外的成骨修复作用,对抗GC的成骨抑制作用,加快骨损伤的修复进程。
综上所述,BMSCs的干预治疗可显著改善GIOP骨折股骨骨密度,加速骨折愈合时间,为BMSCs的临床应用提供理论依据。随着研究的不断深入,基质干细胞未来将为临床骨损伤的治疗提供一种新的途径。
[1]Suzuki Y.Glucocorticoid-induced osteoporosis[J].Nihon Rinsho, 2015,73(10):1733-1739.
[2]Fujiwara S.Glucocorticoid and bone.Fracture risk of steroid-induced osteoporosis[J].Clin Calcium,2014,24(9):1295-1300.
[3]Vestergaard P,Rejnmark L,Mosekilde L.Fracture risk associated with different types of oral corticosteroids and effect of termination of corticosteroids on the risk of fractures[J].Calcif Tissue Int,2008, 82(4):249-257.
[4]Seibel MJ,Cooper MS,Zhou H.Glucocorticoid-induced osteoporosis:mechanisms,management,and future perspectives[J].Lancet Diabetes Endocrinol,2013,1(1):59-70.
[5]Lewiecki EM.Safety of long-term bisphosphonate therapy for the management of osteoporosis[J].Drugs,2011,71(6):791-814.
[6]Zou Q,Hong W,Zhou Y,et al.Bone marrow stem cell dysfunction in radiation-induced abscopal bone loss[J].J Orthop Surg Res,2016,11 (1):3.
[7]Saeed H,Iqtedar M.Bone marrow stromal cell(BMSC)and skeletal aging:role of telomerase enzyme[J].Pak J Pharm Sci,2014,27(2): 321-333.
[8]Bradamante S,Barenghi L,Maier JA.Stem cells toward the future: The space challenge[J].Life(Basel),2014,4(2):267-280.
[9]Cawthon PM,Shahnazari M,Orwoll ES,et al.Osteoporosis in men: findings from the osteoporotic fractures in men study(MrOS)[J]. TherAdv Musculoskelet Dis,2016,8(1):15-27.
[10]Feron JM,Mauprivez R.Fracture repair:general aspects and influence of osteoporosis and anti-osteoporosis treatment[J].Injury, 2016,47 Suppl 1:S10-14.
[11]刘衍志,陈艳,高翔,等.塞来昔布对大鼠骨组织的影响[J].药学研究,2014,33(7):373-375.
[12]李鹏,黄成硕,高翔,等.大鼠骨髓间充质干细胞体外分离及对原发性骨质疏松性骨折的实验研究[J].国际检验医学杂志,2015,36 (14):1984-1987.
[13]Uejima S,Okada K,Kagami H,et al.Bone marrow stromal cell therapy improves femoral bone mineral density and mechanical strength in ovariectomized rats[J].Cytotherapy,2008,10(5): 479-489.
[14]Takada K,Inaba M,Ichioka N,et al.Treatment of senile osteoporosis in SAMP6 mice by intra-bone marrow injection of allogeneic bone marrow cells[J].Stem Cells,2006,24(2):399-405.
Effect of bone marrow-derived mesenchymal stem cells on bone defect healing in rats with secondary osteoporosis.
GAO Xiang1,CHEN Guang-mou2,HUANG Cheng-shuo2,LIU Zhi-jun2,ZENG Rong2,CHU Jia-qi1,LI Peng1.1.Stem Cell Research and Cellular Therapy Center,Affiliated Hospital of Guangdong Medical University,Zhanjiang 524001,Guangdong,CHINA;2.Department of Orthopedic Surgery,Affiliated Hospital of Guangdong Medical University, Zhanjiang 524001,Guangdong,CHINA
ObjectiveTo assess the therapeutic effect of bone marrow-derived mesenchymal stem cells(BMSCs)in bone defect healing in rats with secondary osteoporosis.MethodsPrimary BMSCs were cultured by whole bone marrow adherence method,and the BMSC was detected and identified by flow cytometry and osteogenic specific staining.Sixty female SD rats were selected and injected intramuscularly of dexamethasone(DEX,1 mg·kg-1·d-1)for 8 weeks to establish rat models of osteoporosis.Then the rats were drilled under the tibial plateau to establish bone defect models.The rat models were randomly divided into three groups,control group NS group(fracture was not treated), DEX fracture combined with saline(DEX+NS group),DEX fracture combined with BMSCs treatment group(DEX+ BMSCs group).BMSCs were injected into the bone defect site for treatment(saline was used as control).Micro-CT was used to detect bone defect healing of the rats in each group 4 and 8 weeks after surgery.ResultsFlow cytometry and osteogenic specific staining both confirmed that the isolated cells were BMSCs.Micro-CT results showed that BMSCs treatment can promote the healing of osteoporotic fracture induced by DEX,compared with DEX fracture combined with NS.ConclusionBMSCs has a significant role in promoting the healing of bone defect in secondary osteoporotic rats,which provides a new approach for clinical treatment of individual bone defect in the patients with secondary osteoporosis.
Sprague-Dawley rat;Osteoporosis;Bone mesenchymal stem cells(BMSCs);Bone defect
R-332
A
1003—6350(2016)20—3269—04
2016-05-10)
广东省自然科学基金(编号:S2013020012866);广东省湛江市科技计划项目(编号:2014A06005);广东医学院科研基金面上培育项目(编号:M2014048、M2015013)
李鹏。E-mail:lipeng5155703@163.com
