右美托咪定对剖宫产术后舒芬太尼静脉自控镇痛效果的影响
2016-03-06李淑邹振宇宋仕钦
李淑,邹振宇,宋仕钦
(攀枝花市第二人民医院妇产科1、麻醉科2,四川 攀枝花 617023)
右美托咪定对剖宫产术后舒芬太尼静脉自控镇痛效果的影响
李淑1,邹振宇2,宋仕钦2
(攀枝花市第二人民医院妇产科1、麻醉科2,四川 攀枝花 617023)
目的 观察剖宫产术后右美托咪定复合舒芬太尼静脉自控镇痛的效果。方法2015年1~6月60例剖宫产手术产妇采用随机数字表法分为S组和D组,每组30例。S组术毕应用舒芬太尼2.5µg/kg、托烷司琼10 mg静脉镇痛;D组术毕应用右美托咪定4µg/kg、舒芬太尼2.5µg/kg、托烷司琼10 mg静脉镇痛。采用视觉模拟评分(VAS)和Ramsay镇静评分(RSS),观察两组产妇术后镇痛、镇静效果。记录术后4 h、8 h、12 h、24 h新生儿神经适应能力(NACS)评分,并观察术后产妇的血浆催乳素浓度、肠蠕动恢复时间和镇痛期间可能出现的不良反应。结果在术后4 h、8 h、12 h、24 h,D组产妇镇痛评分[(2.6±0.8)分、(3.4±0.8)分、(3.4±0.7)分、(3.1±0.6)分]和镇静评分[(2.4±0.7)分、(2.5±0.6)分、(2.5±0.5)分、(2.6±0.5)分]明显优于S组镇痛评分[(3.6±1.0)分、(4.4±1.0)分、(4.4±1.0)分、(3.9±0.7)]分和镇静评分[(1.6±0.6)分、(1.5±0.4)分、(1.5±0.5)分、(2.1±0.5)分],两组比较差异有统计学意义(Р<0.05)。两组新生儿术后4 h[(36.6±1.0)分vs(37.3±1.9)分]、8 h[(37.1±1.3)分vs(37.6±1.7)分]、12 h[(37.5±1.3)分vs(36.8±1.7)分]、24 h[(38.2±0.9)分vs(37.9±1.5)分]的NACS评分、血浆催乳素浓度[(353.7±82.7)μIU/mL vs(361.1±97.6)μIU/mL]、肠蠕动恢复时间[(17.5±7.6)h vs(15.7±8.1)h]的比较差异也无统计学意义(P>0.05)。S组呕吐发生率[26.7%(8/30)]高于D组[3.3%(1/30)],但恶心[26.7%(8/30)vs 10.0%(3/30)]、头晕[26.7%(8/30)vs 33.3%(10/30)]、寒颤[16.7%(5/30)vs 3.3%(1/30)]、口干[10.0%(3/30)vs 20.0%(6/30)]等不良反应比较差异无统计学意义(Р>0.05)。两组均无低血压、心动过缓及呼吸抑制发生。结论右美托咪定复合舒芬太尼可有效用于剖宫产术后静脉自控镇痛,对新生儿及母乳喂养无不良影响,且右美托咪定能有效降低阿片类药物的静脉镇痛副作用。
右美托咪定;舒芬太尼;镇痛,静脉;剖宫产术
阿片类药物是术后镇痛的常用药物,其镇痛效果确切,但在静脉镇痛时,若单用阿片类药经常会因为剂量较大而导致副作用的出现概率增加,因此临床上常常联合作用机制不同的镇痛药或镇痛方法(多模式镇痛),减少每种药物的剂量,使副作用相应降低,以达到最大的疼痛缓解和最小的副作用。
右美托咪定是一种新型α2肾上腺素能受体激动剂,有镇痛、镇静、抗交感活性的作用,其与阿片类药物有镇痛协同作用。本研究主要观察右美托咪定对剖宫产术后舒芬太尼静脉镇痛效果的影响。
1 资料与方法
1.1 一般资料 选择2015年1月至2015年6月攀枝花市第二人民医院拟行剖宫产术的产妇60例,年龄20~40岁,ASAⅠ~Ⅱ级。所有产妇无妊娠高血压综合征及胎儿宫内窘迫,无椎管内麻醉禁忌证,无滥用药物史,无药物成瘾和过敏史。随机分为S组:舒芬太尼2.5 μg/kg(批号:1150312,宜昌人福药业有限责任公司)、托烷司琼10 mg(批号:15012807,瑞阳制药有限公司),加生理盐水至100 mL;D组:右美托咪定4 μg/kg (批号:15030932,江苏恒瑞医药股份有限公司)、舒芬太尼2.5 μg/kg、托烷司琼10 mg,加生理盐水至100 mL。
1.2 麻醉及镇痛方法 所有产妇术前常规禁食禁饮,入手术室后采用多功能监护仪监测ECG、SpO2、HR、BP。手术采用腰-硬联合麻醉。使用一次性腰-硬联合麻醉穿刺包(批号:20141103,江苏瑞京科技发展有限公司),于L2~3间隙硬膜外穿刺成功后置入25G腰穿针,见脑脊液回流通畅后注入0.5%盐酸布比卡因1.3 mL(含枸橼酸芬太尼20 μg:批号1141204,宜昌人福药业有限责任公司),退出腰穿针经硬膜外腔置入硬膜外导管4 cm。若术中腰麻效果欠佳,经硬膜外注入0.75%盐酸罗哌卡因5~10 mL。手术结束缝合皮下组织时给予镇痛负荷剂量并接一次性持续自控镇痛泵(型号:BCJB-B,上海博创医疗设备有限公司)。静脉镇痛负荷剂量2 mL,持续注入速度2 mL/h,自控给药量0.5 mL/次,间隔15 min。
1.3 退出实验标准 术中出血量>400 mL者;因腰-硬联合麻醉效果欠佳改全身麻醉或静脉应用辅助镇痛、镇静药者;新生儿Apgar评分≤7分者。
1.4 观察指标与评价方法 记录产妇体重、年龄、术前血压、心率、手术持续时间、术中失血量。记录术后4 h、8 h、12 h、24 h以下各项观察指标。(1)产妇疼痛视觉模拟评分(Visual analogue scale,VAS[1]):0分,无痛;10分,最剧烈疼痛。(2)产妇镇静评分(Ramsay sedation scale,RSS[2]):1分,完全清醒、焦虑;2分,完全清醒、安静合作;3分,清醒但嗜睡;4分,睡眠状态但对口头指令反应良好;5分,睡眠状态但对触觉反应良好;6分,深度睡眠对刺激无反应。(3)新生儿神经适应能力评分(Neurologic and adaptive capacity score,NACS[3]):正常值为35~40分,由儿科医师从5个方面评估(适应能力、被动能力、主动能力、原始反射、警觉哭叫及运动等)。另记录:(1)术后产妇肠蠕动恢复时间(以肛门排气时间为准)。(2)术后24 h血浆催乳素水平:试剂盒批号:174963-04,罗氏诊断有限公司,德国。(3)术后48 h内产妇的头晕、恶心、呕吐、瘙痒、寒颤、口干等不良反应。(4)术后镇痛期间血压、心率、呼吸频率。若镇痛期间出现低血压[收缩压<90 mmHg (1 mmHg=0.133 kPa)]则停镇痛泵,静脉补液;若出现心动过缓(心率<60次/min)则停镇痛泵,阿托品0.5 mg肌肉注射;若出现呼吸抑制(持续SpO2<90%)则停镇痛泵,鼻导管吸氧。
1.5 统计学方法 应用SPSS21统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组间计量资料比较采用成组t检验,计数资料比较采用检验,以Р<0.05为差异有统计学意义。
2 结 果
2.1 两组产妇的一般资料与术中情况比较 两组产妇的一般资料、手术持续时间及术中失血量比较差异均无统计学意义(P>0.05),见表1。
2.2 两组产妇的镇痛和镇静效果比较 术后4 h、8 h、12 h、24 h,D组产妇的镇痛效果和镇静效果均明显优于S组,差异均有显著统计学意义(P<0.05),见表2。
表1 两组产妇的一般资料与术中情况比较(±s)
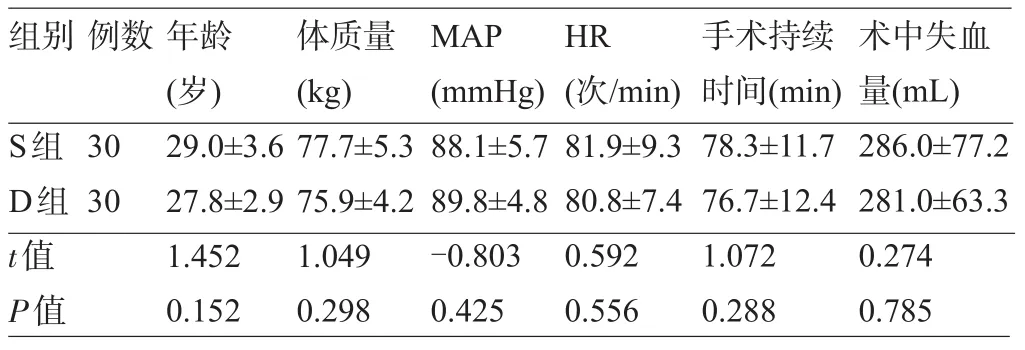
表1 两组产妇的一般资料与术中情况比较(±s)
组别例数年龄(岁)体质量(kg) MAP (mmHg) HR (次/min)手术持续时间(min)术中失血量(mL) S组D组t值P值30 30 29.0±3.6 27.8±2.9 1.452 0.152 77.7±5.3 75.9±4.2 1.049 0.298 88.1±5.7 89.8±4.8 -0.803 0.425 81.9±9.3 80.8±7.4 0.592 0.556 78.3±11.7 76.7±12.4 1.072 0.288 286.0±77.2 281.0±63.3 0.274 0.785
表2 两组产妇术后VAS及RSS评分比较(±s)
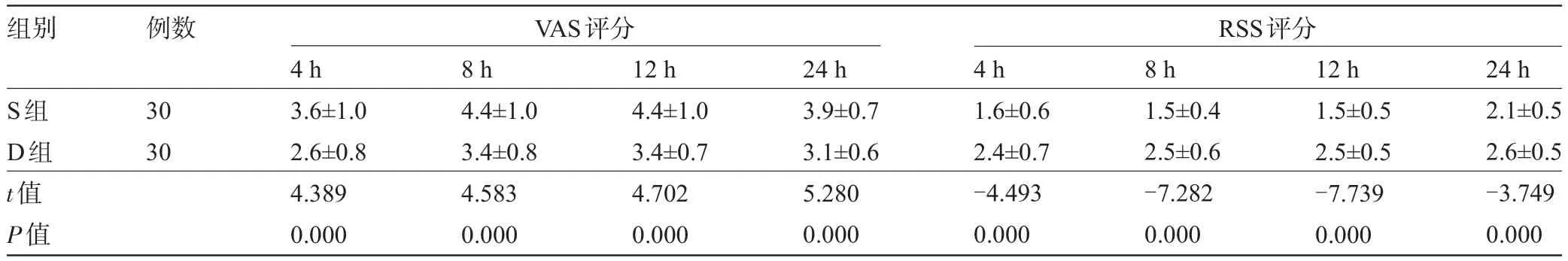
表2 两组产妇术后VAS及RSS评分比较(±s)
组别 例数VAS评分RSS评分S组D组t值P值30 30 4 h 3.6±1.0 2.6±0.8 4.389 0.000 8 h 4.4±1.0 3.4±0.8 4.583 0.000 12 h 4.4±1.0 3.4±0.7 4.702 0.000 24 h 3.9±0.7 3.1±0.6 5.280 0.000 4 h 1.6±0.6 2.4±0.7 -4.493 0.000 8 h 1.5±0.4 2.5±0.6 -7.282 0.000 12 h 1.5±0.5 2.5±0.5 -7.739 0.000 24 h 2.1±0.5 2.6±0.5 -3.749 0.000
2.3 两组新生儿的NACS评分比较 两组新生儿术后4 h、8 h、12 h、24 h的NACS评分均在35分以上,差异均无统计学意义(P>0.05),见表3。
表3 两组新生儿术后NACS评分比较(±s)
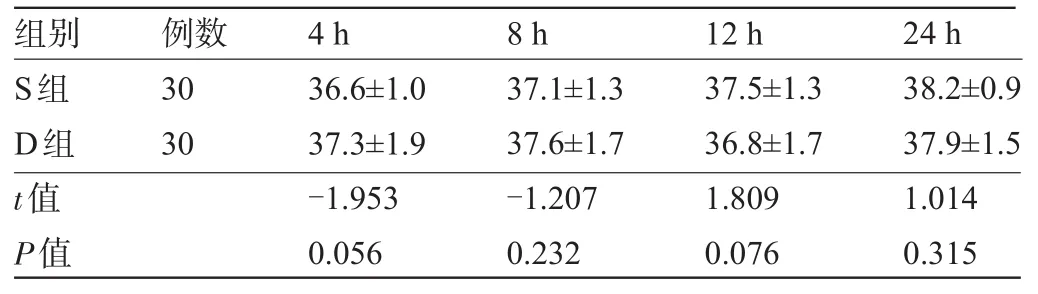
表3 两组新生儿术后NACS评分比较(±s)
组别 例数4 h 8 h 12 h 24 h S组D组t值P值30 30 36.6±1.0 37.3±1.9 -1.953 0.056 37.1±1.3 37.6±1.7 -1.207 0.232 37.5±1.3 36.8±1.7 1.809 0.076 38.2±0.9 37.9±1.5 1.014 0.315
2.4 两组产妇术后肠蠕动恢复时间、术后24 h血浆催乳素浓度比较 两组产妇术后肠蠕动恢复时间及术后24 h血浆催乳素浓度比较差异均无统计学意义(P>0.05),见表4。
2.5 两组产妇术后镇痛期间不良反应比较 两组产妇在术后镇痛期间均无瘙痒、低血压、心动过缓及呼吸抑制发生,但D组产妇术后镇痛期间其他不良反应发生率低于S组,差异有统计学意义(χ2=9.743,P<0.05),见表5。
表4 术后肠蠕动恢复时间、术后24 h血浆催乳素浓度比较(±s)

表4 术后肠蠕动恢复时间、术后24 h血浆催乳素浓度比较(±s)
组别S组D组t值P值例数30 30肠蠕动恢复时间(h) 17.5±7.6 15.7±8.1 0.865 0.391血浆催乳素(μIU/mL) 353.7±82.7 361.1±97.6 -0.430 0.669

表5 两组产妇术后镇痛期间不良反应比较[例(%)]
3 讨 论
术后静脉自控镇痛是临床常用的镇痛方式,单独使用阿片类药物虽镇痛效果较好,但若剂量较低达不到镇痛效果,剂量过大则副作用增加,如呼吸抑制、瘙痒、恶心、呕吐等,因此镇痛药物联合应用的多模式镇痛使镇痛作用相加或协同,同时每种药物剂量减少,不良反应相应降低,从而达到最大的效应/副作用比。多模式镇痛是术后镇痛的首选方法。剖宫产术后芬太尼静脉镇痛效果确切,并不影响产妇催乳素的分泌,且新生儿神经学评分、睡眠时间及哺乳时间与未采用术后镇痛的组相比并无明显影响[4]。因此本研究采用右美托咪定复合舒芬太尼剖宫产术后静脉多模式镇痛来观察其镇痛效果及对新生儿哺乳的影响。
可乐定和右美托咪定是临床上使用最多的α2肾上腺素能受体激动剂,与阿片类药物有镇痛协同作用,尤其是后者,很少引起体位性低血压,是术后镇痛镇静的重要辅助药物。右美托咪定镇静催眠作用的关键部位在蓝斑核,而其镇痛作用与其激动脊髓后角α2受体,抑制感觉神经递质(如P物质)的释放有关。α2受体激动剂是通过内源性的促睡眠通路发挥其催眠作用,因此其镇静催眠能模拟人类正常生理睡眠,提供一种独特的可唤醒镇静状态[5]。
文献报道右美托咪定静脉输注,能够显著减少阿片类药物的用量[6],且可有效减轻患者术后躁动及疼痛程度[7]。国外将吗啡与右美托咪定复合用于术后静脉镇痛,发现右美托咪定能显著减少吗啡用量,且镇痛效果较好[8]。国内把右美托咪定复合舒芬太尼用于剖宫产术后静脉镇痛发现右美托咪定能显著减少舒芬太尼用量并增加产妇舒适度,但该研究无测定右美托咪定对产妇血浆催乳素水平及哺乳后新生儿神经学行为(NACS评分)的影响[9]。本研究发现,右美托咪定复合舒芬太尼静脉镇痛较单独使用舒芬太尼,镇痛效果及镇静评分更好,D组大部分产妇在镇痛期间处于完全清醒、安静、合作的状态,有较少产妇处于轻度睡眠状态,但均易唤醒。而S组的部分产妇处于轻度烦躁状态,推测可能由于疼痛及镇静不足导致。研究中无产妇出现过度镇静(深度睡眠对任何刺激无反应)。两组新生儿在各时点NACS评分均在35分以上,且两组间比较无显著差异,提示右美托咪定4 μg/kg复合舒芬太尼2.5 μg/kg术后静脉镇痛对新生儿没有明显影响。
妊娠期,随着催乳素、雌激素和孕激素分泌增多,使乳腺组织进一步发育,分娩后血中雌激素、孕激素水平降低,催乳素开始激发并维持分泌乳汁。剖宫产术后良好的镇痛可增加催乳素的分泌,促进哺乳[4]。本实验测定了术后24 h血浆中催乳素的浓度,发现两组血浆催乳素浓度差异无统计学意义,提示本研究所使用的右美托咪定剂量及输注速率对剖宫产产妇术后哺乳没有影响。
α2受体激动剂的不良反应主要是减慢心率、降低全身血管阻力,导致心动过缓和低血压,但右美托咪定对α2受体的高选择性,可降低其心血管副作用,从而最大限度地增强其催眠-镇痛作用。Lin等[8]研究表明右美托咪定复合吗啡用于患者术后自控镇痛,镇痛效果确切,能够明显减少吗啡用量,研究中未出现低血压、心动过缓、过度镇静及呼吸抑制,且右美托咪定明显降低吗啡呕吐发生率。另有文献报道右美托咪定复合瑞芬太尼在区域麻醉静脉输注时比丙泊酚联合瑞芬太尼时安全性高,呼吸抑制程度较轻,且恶心、呕吐发生率较低[10]。本研究亦发现,右美托咪定复合舒芬太尼可增强镇痛效果,且两组均无呼吸抑制、低血压及心动过缓等不良反应发生,可能是右美托咪定单位时间内的输注剂量较小的缘故。D组呕吐发生率明显低于S组,提示右美托咪定对阿片类药物导致的恶心、呕吐有一定预防作用。寒颤和口干发生率两组比较差异无统计学意义,但D组寒颤发生率较S组低,口干发生率较S组高,而唾液分泌减少导致口干是右美托咪定的常见不良反应。
综上所述,右美托咪定在增强舒芬太尼静脉镇痛效果的同时能有效降低阿片类药物的不良反应发生率,且对术后产妇哺乳无明显影响。
[1]Komatsu H,Matsumoto S,Mitsuhata H,et al.Comparison of patient-controlled epidural analgesia with and without background infusion after gastrectomy[J].AnesthAnalg,1998,87(4):907-910.
[2]Mizrak A,Erbagci L,Arici T,et al.Ketamine versus propofol for strabismus surgery in children[J].Clin Ophthalmol,2010,19(4):673-679.
[3]Amiel-Tison C,Barrier G,Shnider SM,et al.A new neurologic and adaptive capacity scoring system for evaluating obstetric medications in full-term newborns[J].Anesthesiology,1982,56(5):340-350.
[4]李李,刘建华,范红,等.剖宫产术后经静脉芬太尼自控镇痛对催乳素的影响[J].中华麻醉学杂志,2000,20(2):95-97.
[5]李志鹏,柳垂亮.右美托咪定的临床应用进展[J].实用医学杂志, 2013,29(19):3254-3256.
[6]汪涛.右美托咪定在气管内全身麻醉苏醒期拔管中的应用[J].海南医学,2011,22(6):47-48.
[7]赵继波,李媛莉,汪业铭,等.右美托咪定对体外循环下心脏手术患儿的脑保护价值[J].海南医学,2015,26(1):37-39.
[8]Lin TF,Yeh YC,Lin FS,et al.Effect of combining dexmedetomidine and morphine for intravenous patient-controlled analgesia[J].Br J Anaesth,2009,102(1):117-122.
[9]Nie Y,Liu Y,Luo Q,et al.Effect of dexmedetomidine combined with sufentanil for post-caesarean section intravenous analgesia:a randomized, placebo-controlled study[J].Eur JAnaesthesiol,2014,31(4):197-203.
[10]张华,刘海生,旷艳春,等.盐酸右美托咪定联合瑞芬太尼在骨科手术中的麻醉效果观察[J].海南医学,2015,26(1):34-36.
Effect of dexmedetomidine combined with sufentanil for intravenous patient-controlled analgesia after caesarean section.
LI Shu1,ZOU Zhen-yu2,SONG Shi-qin2.Department of Obstetrics and Gynecology1,Department of Anesthesiology2,the Second People's Hospital of Panzhihua City,Panzhihua 617023,Guizhou,CHINA
ObjectiveTo evaluate the effect of dexmedetomidine combined with sufentanil for intravenous patient-controlled analgesia after caesarean section.MethodsFrom January 2015 to June 2015,sixty parturients scheduled for elective caesarean delivery were randomly assigned into group S and group D according to the random number table method(sealed concealed envelope)(n=30 each).The analgesic solution for group S was sufentanil(2.5µg/kg) plus tropisetron(10 mg),and that for group D was dexmedetomidine(4µg/kg),sufentanil(2.5µg/kg)plus tropisetron (10 mg).The analgesia and sedation efficacy was evaluated by visual analogue scale(VAS)and Ramsay sedation score (RSS).Neonatal neurological and adaptive capacity scores(NACS)were recorded at the 4 h,8 h,12 h,24 h after operation, and the prolactin concentrations,recovery of bowel movement,and adverse effects during analgesia period were observed.ResultsThe VAS[(2.6±0.8),(3.4±0.8),(3.4±0.7),(3.1±0.6)]and the Ramsay sedation score[(2.4±0.7),(2.5±0.6), (2.5±0.5),(2.6±0.5)]of group D at 4 h,8 h,12 h,24 h after operation were better than those of group S[(3.6±1.0), (4.4±1.0),(4.4±1.0),(3.9±0.7),(1.6±0.6),(1.5±0.4),(1.5±0.5),(2.1±0.5),respectively](Р<0.05).There were no significant differences between two groups in the recovery of bowel movement[(17.5±7.6)h vs(15.7±8.1)h],plasma prolactin level[(353.7±82.7)μIU/mL vs(361.1±97.6)μIU/mL]and neonatal NACS[4 h:(36.6±1.0)vs(37.3±1.9),8 h:(37.1± 1.3)vs(37.6±1.7),12 h:(37.5±1.3)vs(36.8±1.7),24 h:(38.2±0.9)vs(37.9±1.5)].The incidence of vomiting in group S [26.7%(8/30)]was significantly higher than that in group D[3.3%(1/30)](Р<0.05),but there were no significant differences between two groups in nausea[26.7%(8/30)vs 10.0%(3/30)],dizziness[26.7%(8/30)vs 33.3%(10/30)],pruritus[16.7%(5/30)vs 3.3%(1/30)],dry mouth[10.0%(3/30)vs 20.0%(6/30)],shivering and respiration frequency(Р>0.05).There was no bradycardia,hypotension and respiratory depression in two groups.ConclusionThe combination of sufentanil and dexmedetomidine for intravenous patient-controlled analgesia after caesarean section can provide an effective analgesia without adverse effects on breast-feeding and NACS,and dexmedetomidine can effectively decrease the adverse effects of opioids drugs for intravenous analgesia.
Dexmedetomidine;Sufentanil;Analgesia,Intravenous;Caesarean section
R719.8
A
1003—6350(2016)10—1631—03
10.3969/j.issn.1003-6350.2016.10.028
2015-10-26)
四川省攀枝花市应用技术研究与开发项目[编号:2012CY-S-22(10)]
邹振宇。E-mail:zzylsu@sina.com
