不同临床类型肝病患者血清中自身抗体的检测及临床应用
2016-03-06周晓冬钱宏波刘会利白妙赵汉东刘红莉
周晓冬,钱宏波,刘会利,白妙,赵汉东,刘红莉
(西安市第八医院检验科,陕西 西安 710061)
不同临床类型肝病患者血清中自身抗体的检测及临床应用
周晓冬,钱宏波,刘会利,白妙,赵汉东,刘红莉
(西安市第八医院检验科,陕西 西安 710061)
目的 分析不同临床类型肝病患者血清中各种自身抗体的存在状况,探讨其临床应用价值。方法采用间接免疫荧光法和免疫印迹法,对我院2010年6月至2014年2月3 124例不同类型肝病患者和200例正常健康体检者血清中的抗核抗体(ANA)、抗线粒体抗体(AMA)、抗平滑肌抗体(ASMA)、抗肝肾微粒体抗体(LKM)和自身免疫肝病谱等9项指标进行检测。结果病毒性肝炎ANA、AMA阳性率分别为11.11%、0.39%,抗肝抗原自身抗体检测阳性率分别为AMA M22.22%,M2-3E 1.86%、Sp100 0.59%、PML 0.42%、gp210 3.81%、LKM-1 0.62%、LC-1 2.28%、SLA-LP 0.26%、Ro52 10.6%。自身免疫性肝病ANA、AMA阳性率分别为90.63%、78.13%,抗肝抗原自身抗体检测阳性率分别依次为71.87%,71.87%、6.25%、6.25%、65.63%、3.13%、0、21.88%、93.75%。与病毒性肝炎比较,自身免疫肝病的9项指标以及ANA、AMA的差异有统计学意义(P<0.01)。与正常对照组比较,丙肝、自身免疫肝病、药物性肝炎的ANA阳性率的差异有显著统计学意义(P<0.01)。甲肝、戊肝、脂肪肝血清中未检测出自身抗体。与病毒性肝炎比较,药物性肝炎的ANA检出率差异有显著统计学意义(P<0.01)。各型肝炎患者ANA的荧光模型存在差异。结论检测自身抗体的类型、滴度以及荧光模型对于不同类型肝病的诊断和治疗具有临床参考价值。
病毒性肝炎;抗核抗体;自身免疫肝病;自身抗体;临床应用
自身抗体是指针对自身组织、器官、细胞及细胞成分的抗体。正常人体血液中存在低滴度的生理性自身抗体,不引发疾病,当其滴度升高到一定水平,机体的免疫耐受平衡被破坏,引起组织脏器受损,导致自身免疫疾病发生。我国是慢性肝炎的高发区,自1970年首次报道某些结接性多动脉炎患者与乙肝病毒感染相关后肝炎病毒与自身免疫的相关性得到关注,病毒性肝炎的发生和发展可能涉及对自身抗原的免疫应答,包括自身抗体应答和自身反应性T细胞应答。因此了解不同类型肝炎患者自身抗体的状况,有利于临床合理用药,也利于和自身免疫性肝病的鉴别。为探讨各类肝病患者血清中自身抗体的存在状况和临床应用价值,我们检测并统计了3 124例不同肝病患者的多项自身抗体,现将检测分析结果报道如下:
1 资料与方法
1.1 一般资料 3 124例患者均来自2010年6月至2014年2月西安市第八医院的住院患者,男性2 035例,年龄11~74岁;女性1 089例,年龄17~77岁;其中病毒性肝炎3067例(包括乙肝2 120例,丙肝928例,乙丙肝11例,戊肝5例,甲肝3例)、自身免疫性肝病32例、药物性肝炎17例以及脂肪肝8例。所有入选的确诊病例中病毒性肝炎的诊断,符合2000年《病毒性肝炎防治方案》,排除其他自身免疫性疾病;自身免疫肝病的诊断,参照国际自身免疫肝病小组修订的评分标准。以200例各型肝炎血清标志物阴性,并且肝功能正常的健康体检者作为正常对照组,其中男性107例,女性93例,年龄16~46岁。
1.2 研究方法
1.2.1 间接免疫荧光法(Indirect immunofluo rescence,IIF):采集患者静脉血液,分离血清。用德国欧蒙医学实验诊断股份有限公司生产的肝脏马赛克4进行检测。该试剂盒包被有4种抗原基质:Hep-2、猴肝、大鼠胃、大鼠肾脏。可检测抗核抗体(Anti-nuclear antibody,ANA)、抗平滑肌抗体(Anti-smooth muscle antibody,ASMA)、抗线粒体抗体(Anti-mitochondrial antibody,AMA)、抗肝肾微粒体抗体(Liver kidney microsomal antibody,LKM)。按试剂盒要求操作,用荧光显微镜观察细胞或组织内出现特异性绿色荧光,血清稀释度大于等于1:100判为阳性。
1.2.2 免疫印迹法 采用欧蒙肝抗原谱9项试剂条检测血清中自身抗体,包括丙酮酸脱氢酶复合物(AMA M2)、BPO线粒体内膜α-2酮酸脱氢酶E-2亚基的融合蛋白(M2-3E)、核颗粒蛋白(Sp100)、早幼粒细胞白血病蛋白(PML)、核膜整合蛋白(gp210)、肝肾微粒抗体Ⅰ型(LKM-1)、肝细胞溶质抗原Ⅰ型(LC-1)、可溶性肝抗原(SLA/LP)、Ro52等自身抗体。血清按照1:100稀释,全部操作按照试剂盒步骤,用欧蒙公司的计算机程序(EURO Line Scan)自动判读条带的阴阳性和着色强度。
1.2.3 ANA和AMA的结果判定 在荧光显微镜下ANA阳性时Hep-2细胞的细胞核、细胞浆、细胞膜上出现各种不同的荧光,并结合猴肝上相应的荧光判定;AMA阳性时Hep-2细胞胞浆呈现颗粒状荧光、大鼠肾近曲小管和远曲小管均有明显的荧光、大鼠胃壁细胞呈明显荧光、猴肝细胞质上呈细沙状荧光。
1.3 统计学方法 应用SPSS19.0软件进行数据分析,各项检测结果阳性率以百分率表示,单项阳性率间比较采用χ2检验,以P<0.05表示差异有统计学意义。
2 结 果
2.1 各类肝病患者的ANA、AMA、ASMA、LKM检测结果 乙肝、丙肝、乙丙肝、自免肝病、药物性肝炎的ANA阳性率分别为9.39%、15.08%、18.18%、90.63%、29.41%,乙肝比对照组高5.39%,差异无统计学意义(P>0.05);丙肝、乙丙肝、自免肝病、药物性肝炎与对照组比较差异有统计学意义(P<0.01);自免肝病、药物性肝炎与病毒肝炎组比较差异有显著统计学意义(P<0.01);乙、丙肝ANA以低滴度(1:100)为主,自免肝病、药物性肝炎、乙丙肝ANA以高滴度(≥1:320)为主。自身免疫性肝病AMA阳性率为78.13%(≥1:320),与乙肝、丙肝的AMA阳性率0.09%、1.08%比较差异有显著统计学意义(P<0.01)。乙肝、丙肝、自免肝病ASMA阳性率分别为0.05%、0.43%、3.12%。乙肝、自免肝病LKM阳性率分别为0.05%、3.12%。甲肝、戊肝及脂肪肝中未检测出自身抗体,见表1。

表1 3 124例肝病患者自身抗体荧光检测结果[例(%)]
2.2 不同临床类型肝病患者肝抗原谱9项的检测结果 乙肝、丙肝的患者血清中9种肝抗原谱抗体呈现不同的阳性率;甲肝、戊肝、脂肪肝患者均未检测到任何自身抗体;自身免疫性肝病患者的AMAM2(78.13%)、M2-3E(78.13%)、gp210(65.63%)、SLA/LP (21.88%)、Ro52(93.75%)显著高于对照组和病毒性肝炎组(P<0.01);药物性肝炎患者AMAM2(23.53%)、gp210(11.76%)、Ro52(17.65%)明显高于对照组;乙丙肝患者AMAM2(18.18%)、M2-3E(18.18%)、gp210 (18.18%),见表2。
2.3 各类肝炎ANA和AMA荧光模型分析 乙肝的ANA荧光模型以均质型、核颗粒型、核仁型为主。丙肝的ANA荧光模型以均质型、核颗粒型、胞浆颗粒型为主。药物性肝炎的核型为胞浆颗粒型、核仁型和核颗粒型。乙丙肝有核颗粒型和核仁型两种。乙肝、丙肝、自身免疫肝病中可见混合核型。自身免疫性肝病的ANA荧光模型有胞浆颗粒型、核点型、着丝点型、核颗粒型、核仁型、均质型和胞浆纤维型,AMA阳性时的ANA的荧光模型有胞浆颗粒性、核点型和着丝点型,见表3。
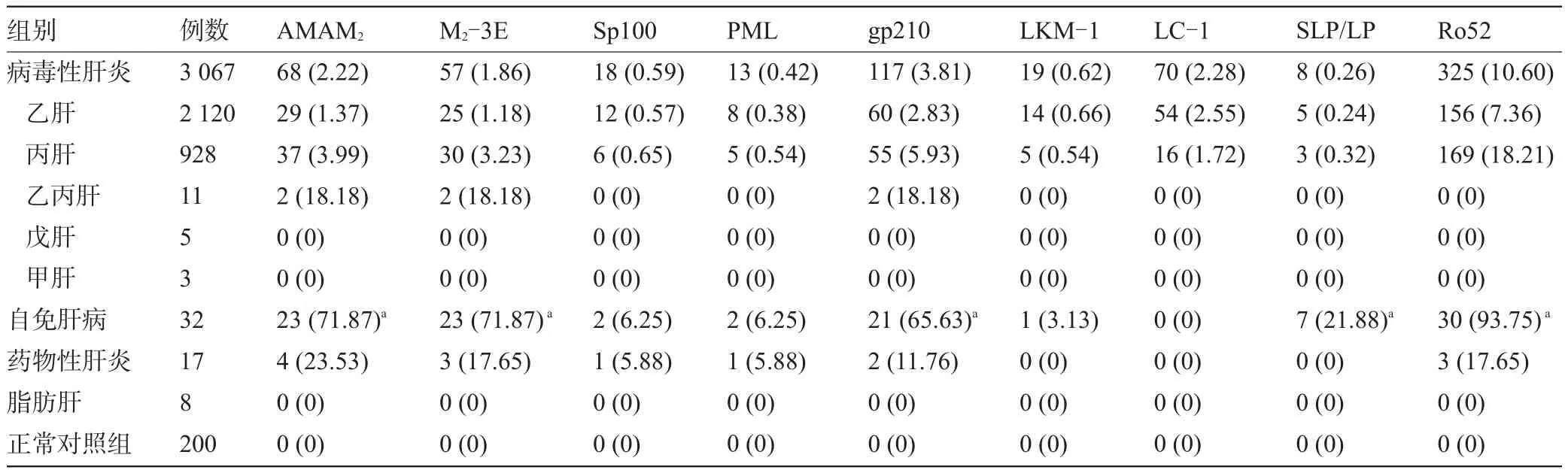
表2 3 124例肝病患者肝抗原抗体检测结果[例(%)]
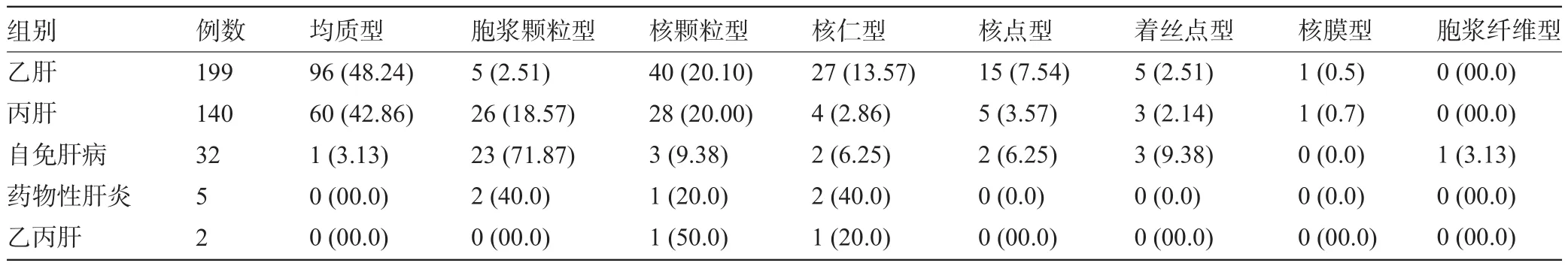
表3 378例ANA阳性的荧光模型分析[例(%)]
2.4 32例自身免疫性肝病分型 25例原发性胆汁性肝硬化(PBC)表现为ANA阳性(胞浆颗粒型、着丝点型、核点型)、AMA阳性(基质大鼠肾和大鼠胃细胞线粒体呈颗粒状荧光)、AMAM2、M2-3E 2、gp210、Ro52均强阳性;5例自身免疫性肝炎(AIH)Ⅲ型有2例表现为ANA阳性(核颗粒型、核仁型)、SLA/LP强阳性;1例AIHⅡ型ANA阳性(胞浆颗粒型)、LKM阳性(基质大鼠肾细胞线粒体或阴或阳)、LKM-1强阳性;1例AIHⅠ型ANA阳性(胞浆纤维型)、ASMA阳性(基质大鼠胃腺体间收缩纤维呈条索状荧光)。
3 讨 论
自身抗体是指各种原因造成的机体B细胞产生针对自身组织的抗体,也是一类受自身和外界影响不断变化的抗体,高滴度的自身抗体可导致机体一系列生理和病理改变。本研究通过对不同类型肝炎的自身抗体分析表明病毒、药物对自身抗体的影响与正常对照有显著差异,自身免疫性肝病中特异性的自身抗体与病毒性肝炎之间有明显差异。
3 124例肝病中约98%属于病毒性肝炎,肝炎病毒感染主要通过机体对病毒的免疫应答而导致肝细胞的损害[1],其可以直接破坏肝细胞,也能引起靶细胞中的抗原成分改变或者由于病毒蛋白与正常组织成分间有同源性可诱发自身免疫,HCV感染通过分子模拟现象激活自身反应性CD8阳性T细胞,从而诱导产生自身免疫现象[2]。Michalska等[3]研究认为,HBV和HCV感染者体内可产生自身免疫应答并出现多种自身抗体,自身抗体的出现不仅与病毒感染有关,而且与病毒感染的严重程度、病程长短密切相关[4]。有文献报道HBV患者ANA阳性率为13.7%,HCV患者ANA阳性率为15.7%[5],HAV感染后也可诱发自身免疫性肝脏疾病[6]。本研究证明:HBV、HCV组ANA检出率分别为9.4%、15.1%,乙肝与上述报道稍有差异,丙肝感染相对乙肝容易诱发自身抗体。乙丙肝混合感染11例并不多见,但ANA中有2例(18.18%)阳性并呈高滴度(≥1:320),说明肝炎病毒混合感染更容易破坏自身免疫系统,治疗上应引起重视。药物性肝炎17例5例(29.41%)ANA呈高滴度阳性,而且血清中存在的肝抗原抗体AMAM2、3E、Ro52,说明药物或/及其代谢产物不光引起的肝脏炎症性损害,也会引起自身免疫系统的改变,提示临床在用药过程中及时检测肝功能和自身抗体的变化。HAV和HEV患者中未检出自身抗体,可能与我们收集的甲肝、戊肝病例少或地域有关。脂肪肝是因肝细胞内脂肪堆积引起的肝脏病变,故未影响自身免疫系统。
自身免疫性肝病组的ANA检出率为90.63%,明显高于病毒性肝炎组11.11%,差异有统计学意义(P<0.01)。自身免疫性肝病29例ANA滴度全部(100%)为高滴度(≥1:320),而HBV和HCV中ANA高滴度(≥1:320)仅有22例(1.04%)和19例(2.05%),说明HBV和HCV感染者ANA滴度以低滴度(1:100)为主。一般认为自身免疫疾病的启动因子是病毒感染,而乙、丙肝中高滴度的自身抗体与自身免疫性疾病密切相关,病毒性肝炎患者在发病和治疗中是否伴有自身免疫现象或诱导产生自身免疫性疾病,这是一个长期动态的变化过程。病毒性肝炎患者在用干扰素抗病毒治疗过程中,药物可诱导或增强自身免疫,若对存在高滴度自身抗体的乙、丙型肝炎患者继续干扰素治疗,可能会诱导或增强自身免疫活性细胞,加重自身免疫性反应[7],故慢性病毒性肝炎在使用干扰素抗病毒治疗前必须排除自身免疫性疾病,对伴有高滴度的自身抗体存在时,选择治疗方案要十分慎重,应在保肝的基础上进行抗病毒和免疫调节剂的治疗。相反,自身免疫性肝病临床常用激素等免疫抑制剂治疗,但免疫抑制剂可抑制机体正常有益的免疫反应,长期使用可导致机体抵抗力下降,诱发严重的感染、恶性肿瘤等疾病。所以,若两类肝病诊断失误,给予相反的治疗将会加重病情[8]。因此,对各类肝病患者进行自身抗体及滴度的监测,对于病毒性肝炎和自身免疫性肝病的认识和鉴别有一定的意义,并可进一步指导临床合理用药。
自身免疫性肝病是一种特殊类型的慢性肝病,肝组织的改变与慢性病毒性肝炎相一致,但伴有皮肤瘙痒、关节酸痛、内分泌失调、低热、干燥综合征等肝外表现,发展为肝硬化的时间比病毒性肝炎短,不易治愈,血清中可发现与肝脏相关的循环自身抗体[8],并呈强阳性。自身免疫性肝病患者的肝抗原相关抗体AMAM2、3E、gp210、SLA/LP、Ro52均呈强阳性,明显高于病毒性肝炎组。线粒体抗体(AMA)阳性是诊断PBC的重要免疫学指标,95%~98%的PBC患者AMA阳性,AMAM2抗体阳性见于90%的PBC[9]。本研究表明25例PBC患者AMA均阳性,其中23例(92%) AMAM2抗体阳性,与上述基本相符。据国内报道,只要AMA抗体和AMAM2抗体阳性的患者,即使没有临床症M2抗体阳性的患者应引起重视,建议定期复查。
ANA荧光模型包括均质型、胞浆颗粒型、核颗粒型、核点型、核膜型、着丝点型等。在本研究中,乙肝和丙肝ANA的荧光模型大多数呈低滴度,没有明显的鉴别意义,但自身免疫性肝病的ANA、AMA等荧光模型均为高滴度,可根据荧光模型和特异性肝抗原抗体来分型。国内报道PBC患者AMA抗体阳性的核型分别为颗粒型59.3%,着丝点型22.2%,胞质型18.5%[11]。也有国外报道PBC患者AMA抗体阳性的常见荧光模式为着丝点型、核膜型和核点型,其中核膜型AMA是PBC的一个特异性血清学指标,它们的出现有助于PBC的诊断。本研究25例PBC中AMA的荧光模型为胞浆颗粒型88.0%、着丝点型8.0%、核点型4.0%,与上述报道均不相符,分析原因可能与患者的地域、种族和试剂不同、操作人员的差异有关。
综上说述,不同类型的肝病患者血清中自身抗体呈不同程度的变化,动态的影响机体自身免疫调节系统,定期检测自身抗体能为临床提供重要的诊断和鉴别诊断依据,使患者能够得到及时合理化的治疗。
[1]阎惠平,Stöecker W,贺立香,等.肝病患者自身抗体特征性的研究[J].中国免疫学杂志,2003,19(4):278-281.
[2]彭道荣,余妍,王宇,等.丙型肝炎病毒感染患者血清肝特异性自身抗体的检测及临床研究[J].实用预防医学,2007,14(6):1699-1701.
[3]Kalapotharakos G,Asciutto C,Henic E,et al.High preoperative blood levels of HE4 predicts poor prognosis in patients with ovarian cancer[J].J Ovarian Res,2012,5(1):20-23.
[4]Sener AG.Autoantibodies in autoimmune liver diseases[J].Apmis, 2015,123(11):915-917.
[5]曾东良,莫宝妹,姜焕好,等.自身抗体检测在慢性肝病诊断中的意义[J].海南医学,2011,22(20):117-119.
[6]Singh G,Palaniappan S,Rotimi O,et al.Autoimmune hepatitis triggered by hepatitisA[J].Gut,2007,56(2):304-305.
[7]陈东,奚颍霞,陈海哨,等.自身抗体在乙型和丙型肝炎及自身免疫性肝炎中的特点分析[J].中国卫生检验杂志,2013,23(3):715-716, 719.
[8]张利方,郑山根,阎有功.自身免疫性肝病自身抗体检测与病毒性肝病的相关性[J].中国实验诊断学,2008,12(6):745-748.
[9]Heathcote EJ.Management of primary biliary cirrhosis.The American Association for the Study of Liver Diseases practice guidelines [J].Hepatology,2000,31(4):1005-1013.
[10]王晓娣.自身免疫性肝炎的研究进展[J].中华肝脏病杂志,2004,12 (1):58-60.
[11]秦雯,余俊.原发性胆汁性肝硬化自身抗体检测结果分析及临床应用[J].检验医学与临床,2015,12(4):484-485,488.
Detection and clinical application of autoantibodies in serum of patients with different type of hepatopathy.
ZHOU Xiao-dong,QIAN Hong-bo,LIU Hui-li,BAI Miao ZHAO Han-dong,LIU Hong-li.Department of Clinical Laboratory, Xi'an No.8 Hospital,Xi'an 710061,Shaanxi,CHINA
ObjectiveTo investigate a series of autoantibodies expression in the serum of patients with different clinical types of hepatopathy,and their role in diagnosis and clinical application.MethodsRetrospective analysis was performed in 3 124 patients with different clinical types of hepatopathy and 200 healthy people undergoing health check,who admitted to our hospital from June 2010 to February 2014,to detect antinuclear antibody(ANA),antimitochondrial antibody(AMA),antismooth muscle antibody(ASMA),antiliver-kidney microsomes antibody(LKM),antiliver specific lipoprotein antibody(ALSP)and 9 indexes of antibody in autoimmune liver disease through indirect immunofluorescence and immunoblotting test.ResultsThe positive rates of ANA and AMA of viral hepatitis were respectively 11.11%and 0.39%.Meanwhile,the positive rates of AMA M2,M2-3E,SP100,PML,gp210,LKM-1,LC-1,SLA-LP and Ro50 were respectively 2.22%,1.86%,0.59%,0.42%,3.81%,0.62%,2.28%,0.26%and 10.6%.The positive rates of ANA and AMA of autoimmune liver disease were 90.63%and 78.13%,respectively.And then,the positive rates of AMA M2,M2-3E,SP100,PML,gp210,LKM-1,LC-1,SLA-LP and Ro50 were 71.87%,71.87%,6.25%,6.25%, 65.63%,3.13%,0,21.88%and 93.75%.The positive rates of ANA,AMA,and 9 indexes of antibody in autoimmune liver disease were significantly higher than that of viral hepatitis(P<0.01).There were significant differences between patients with different clinical type of hepatopathy and healthy people in the positive rate of ANA in Hepatitis C,autoimmune liver disease,and drug-induced hepatitis(P<0.01).All the autoantibodies were not detected in Hepatitis A,Hepatitis E,and Fatty liver.The positive rate of ANA in drug-induced hepatitis was significantly higher than that of viral hepatitis(P<0.01).The fluorescence model of ANA was different among all types of hepatopathy.ConclusionThe detection of type,titer,and fluorescence model of autoantibodies in different type of hepatopathy is valuable for improving the diagnosis and therapy.
Viral hepatitis;Antinuclear antibody(ANA);Autoimmune liver disease;Autoantibody;Clinical application
R575
A
1003—6350(2016)10—1602—04
10.3969/j.issn.1003-6350.2016.10.018
2015-09-15)
刘红莉。E-mail:liuhongli@sina.com
