动静脉血气分析在重症胰腺炎患者早期预后判断中的临床价值
2016-03-06李晓高伟芳桑荣霞张纪元胡静刘润韩占波
李晓,高伟芳,桑荣霞,张纪元,胡静,刘润,韩占波
(石家庄市第一医院消化二科,河北 石家庄 050011)
动静脉血气分析在重症胰腺炎患者早期预后判断中的临床价值
李晓,高伟芳,桑荣霞,张纪元,胡静,刘润,韩占波
(石家庄市第一医院消化二科,河北 石家庄 050011)
目的 研究动静脉血气分析在重症胰腺炎(SAP)患者早期预后判断中的临床价值。方法选取2012年9月至2014年9月收入我院ICU的SAP患者64例,以患者ICU住院10 d为终点事件,根据预后情况将所有患者分为存活组(好转或病情未恶化)及死亡组(患者死亡),其中,存活组36例,死亡组28例。所有患者进行常规ICU治疗,发病48 h内进行血气分析和电解质检查,并与APACHEⅡ评分结果比较。结果发病48 h内血气测定结果表明,存活组和死亡组的动脉血pH-静脉血pH(A-VpH)[(0.022±0.09)vs(0.031±0.015)]、动脉血CO2分压-静脉血CO2分压(A-VPCO2)[(8.68±1.35)vs(11.48±4.56)]比较差异有统计学意义(P<0.05),动静脉血pH[(7.35±0.06)vs (7.36±0.05)]及血PO2水平[(95.3±8.9)mmHg vs(95.9±9.1)mmHg]比较差异无统计学意义(P>0.05);与存活组比较,死亡组血动静脉PCO2[动脉:(35.3±3.0)mmHg vs(29.9±3.0)mmHg、静脉:(35.3±3.0)mmHg vs(29.9±3.0)mmHg]、血HCO3-[动脉:(23.8±1.2)mmol/L vs(20.2±1.9)mmol/L、静脉:(17.5±1.0)mmol/L vs(19.3±1.2)mmol/L]、血Lac水平[动脉:(2.7±0.9)mmol/Lvs(4.1±1.7)mmol/L、静脉:(1.7±0.6)mmol/Lvs(1.8±0.4)mmol/L]、血BE水平[动脉:(-1.7±1.2)mmol/Lvs (-4.3±1.6)mmol/L、静脉:(1.9±1.2)mmol/L vs(2.1±0.9)mmol/L]比较差异具有统计学意义(P<0.05)。发病48 h内电解质测定结果表明,存活组和死亡组的K+[(3.71±0.69)mmol/L vs(3.79±0.70)mmol/L]、Na+[(135.60±7.88)mmol/L vs (134.32±7.94)mmol/L]、Cl-[(100.85±20.73)mmol/L vs(98.49±24.3)mmol/L]水平比较差异均无统计学意义(P>0.05);两组Ca2+水平均减少,与死亡组比较,存活组Ca2+显著降低[(1.47±0.50)mmol/L vs(1.22±0.38)mmol/L],差异具有统计学意义(P<0.05)。为进一步明确PCO2、血HCO3-、血BE对SAP患者预后的判断价值,ROC曲线统计PCO2、血HCO3-、血BE对SAP的预后的诊断正确率,得血BE及APACHEⅡ评分的ROC曲线面积最大,表明其诊断正确率最高。结论早期进行SAP患者的血气分析检测有利于及早判断预后,进行合理治疗。年龄越大,血BE结果负值越大的患者,其预后可能也差。
血气分析;重症胰腺炎;早期预后;判断
急性胰腺炎(Acute pancreatitis,AP)为多种致病因素引起的疾病,其重要特征为胰酶激活、胰腺局部炎症,常伴发其他器官功能异常[1]。重症胰腺炎(Severe acute pancreatitis,SAP)为具备急性胰腺炎的临床及生化变化,且存在以下条件之一者:(1)存在胰腺脓肿、胰腺坏死、假性囊肿等局部并发症[2];(2)器官衰竭:Ranson评分不低于3;APACHEⅡ评分不低于8;CT分级为D、E级[3]。虽然SAP发病率较低,但其具有起病急、病情凶、并发症严重、治疗难度大等特点,可迅速引起免疫功能障碍,酸碱平衡紊乱,多脏器功能障碍,尽管现阶段器官功能支持治疗取得了显著发展,但SAP的死亡率仍为20%~30%[4]。因此尽早预测SAP预后有利于医疗工作者快速判断病情,并使用正确合理的治疗手段,改善病情,降低死亡率。但是SAP的临床特征具有个体差异,临床变化快,因此难于正确及时的评估患者预后,因此如何确定快速、准确、重复性强的评估方式评估SAP患者的预后是研究者关注的重点。本文旨在探讨重症胰腺炎患者的各种血气分析指标水平及其对SAP患者预后的影响,以提高患者治愈率及生存率。
1 资料与方法
1.1 一般资料 选取2012年9月至2014年9月收入我院ICU的重症胰腺炎患者64例,所有患者均满足重症胰腺炎的临床诊断标准[5]。其中男性29例,女性35例,年龄21~82岁,平均年龄(55.32±8.54)岁。发病时间3 h~5 d,平均发病时间(2.11±1.32)d。发病原因:14例胆道疾病,19例暴饮暴食,7例高脂血症,24例原因不明。研究符合中国临床试验研究法规及赫尔辛基宣言,且经过伦理委员会批准。组内所有患者于入选前签署知情同意书,知情同意书的获取的过程符合相关要求。按ICU住院10 d为终点事件,根据预后情况将所有患者分为存活组及死亡组。
1.2 纳入、排除标准
1.2.1 纳入标准 (1)符合SAP诊断标准;(2)存在上腹痛病史;(3)血、尿常规表明淀粉酶升高;(4)超声、CT检查表明患者胰腺异常;(5)签署知情同意书,自愿参与本次研究。
1.2.2 排除标准 (1)存在原发型慢性脏器功能不全;(2)存在糖尿病、冠心病、肺功能不全等;(3)不符合重症胰腺炎诊断标准;(4)资料不全,非病情原因出院者;(5)未签署知情同意书,不同意参与本次研究。
1.3 治疗方法 患者进行常规ICU治疗,主要方法为:(1)禁食,控制胰腺分泌;(2)肠道营养支持;(3)胃管注入质子泵抑制剂、生长抑素、抗生素促进胃肠道功能恢复;(4)改善微循环;(5)控制感染;(6)机械通气;(7)局部外敷芒硝减轻组织水肿。若患者经治疗后,病情仍继续恶化,超声、CT结果表明胰外浸润范围增大,或存在胰周残余感染或脓肿,行手术治疗。若患者肾脏功能不全,行持续性床旁血液滤过净化治疗。
1.4 检查方法 患者取右股动脉、股静脉血,使用IRMB血气生化检测仪及CC测试盒于床边测定患者的血气分析和电解质结果并记录。血气分析包括:血pH值、氧分压(PO2)、二氧化碳分压(PCO2)、碳酸盐(HCO3-)、乳酸(Lac)、碱剩余(BE)、动脉血pH-静脉血pH(A-VpH)、动脉血CO2分压-静脉血CO2分压(A-VPCO2)。
1.5 APACHEⅡ评分 即急性生理和慢性健康状况评分[6],主要分为急性生理学评分、年龄评分和慢性健康评分。急性生理学评分主要记录患者急性生理指标,年龄评分和慢性健康评分主要记录抵御疾病的能力。三者评分之和为最终结果。本研究中,患者入院时APACHEⅡ评分均不低于8分。
1.6 统计学方法 采用EpiData软件进行双人输入及核实,并采用SPSS19.0软件进行统计学分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验,使用ROC曲线评估各指标对SAP预后的诊断效果,以P<0.05为差异具有统计学意义。
2 结 果
2.1 分组情况 以患者ICU住院10 d为终点事件,根据预后情况将所有患者分为存活组(好转或病情未恶化)及死亡组(患者死亡)。其中,存活组36例(56.25%),男性19例,女性17例,年龄23~83岁,平均(53.15±7.27)岁。发病时间5 h~5 d,平均发病时间(2.43±1.62)d。发病原因:9例胆道疾病,8例暴饮暴食,5例高脂血症,14例原因不明。死亡组共28例(43.75%),男性15例,女性13例,年龄19~81岁,平均(55.76±8.98)岁。发病时间2 h~4 d,平均发病时间(2.03±1.10)d。发病原因:7例胆道疾病,11例暴饮暴食,4例高脂血症,6例原因不明。两组在治疗前的一般资料比较差异无统计学意义(P>0.05),具有可比性。
2.2 两组血气测定结果比较 两组组的A-VpH,A-VPCO2差异有统计学意义(P<0.05),动静脉血pH及血PO2水平差异无统计学意义(P>0.05);两组血动静脉PCO2、血HCO3-、血BE水平均显著减少,血Lac水平显著增加,差异具有统计学意义(P<0.05),见表1、表2。
表1 两组患者A-VpH,A-VPCO2测定结果比较(±s)
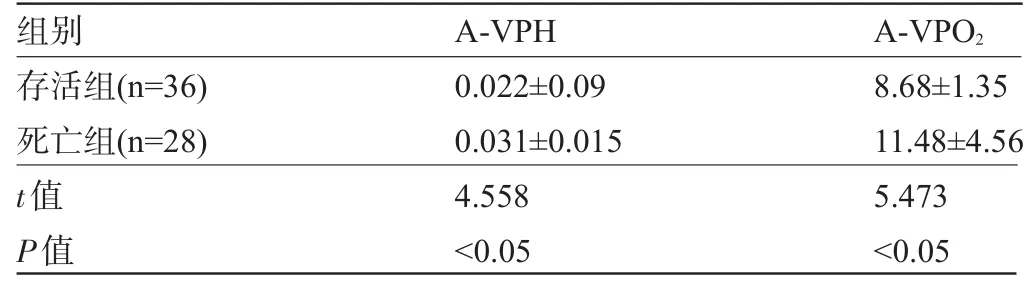
表1 两组患者A-VpH,A-VPCO2测定结果比较(±s)
组别存活组(n=36)死亡组(n=28) t值P值A-VPH 0.022±0.09 0.031±0.015 4.558<0.05 A-VPO28.68±1.35 11.48±4.56 5.473<0.05
2.3 两组动脉电解质测定结果比较 电解质测定结果表明,存活组和死亡组的K+、Na+、Cl-水平均差异有统计学意义(P>0.05);两组Ca2+水平均有所减少,与死亡组比较,存活组Ca2+显著降低,两组比较差异具有统计学意义(t=3.297,P<0.05),见表3。
表2 两组患者血动静脉血气测定结果比较(±s)
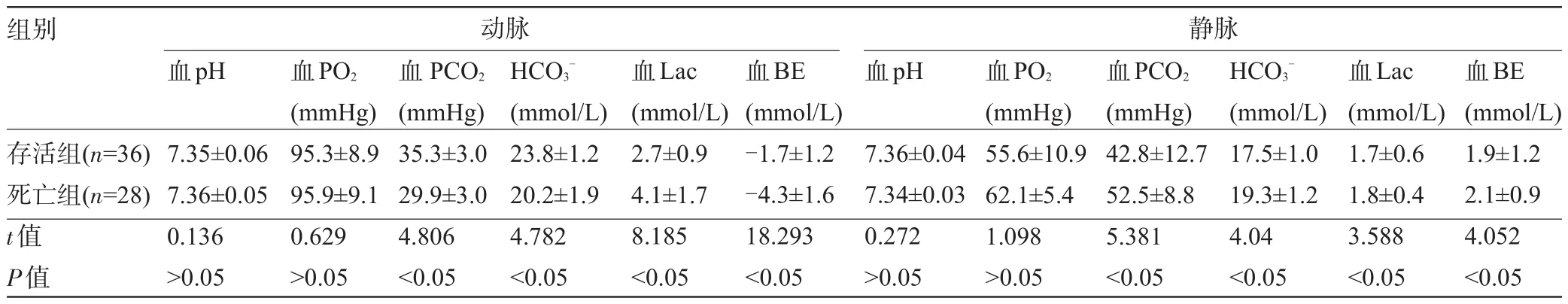
表2 两组患者血动静脉血气测定结果比较(±s)
组别 动脉静脉血pH 血pH存活组(n=36)死亡组(n=28) t值P值7.35±0.06 7.36±0.05 0.136>0.05血PO2(mmHg) 95.3±8.9 95.9±9.1 0.629>0.05血PCO2(mmHg) 35.3±3.0 29.9±3.0 4.806<0.05 HCO3-(mmol/L) 23.8±1.2 20.2±1.9 4.782<0.05血Lac (mmol/L) 2.7±0.9 4.1±1.7 8.185<0.05血BE (mmol/L) -1.7±1.2 -4.3±1.6 18.293<0.05 7.36±0.04 7.34±0.03 0.272>0.05血PO2(mmHg) 55.6±10.9 62.1±5.4 1.098>0.05血PCO2(mmHg) 42.8±12.7 52.5±8.8 5.381<0.05 HCO3-(mmol/L) 17.5±1.0 19.3±1.2 4.04<0.05血Lac (mmol/L) 1.7±0.6 1.8±0.4 3.588<0.05血BE (mmol/L) 1.9±1.2 2.1±0.9 4.052<0.05
表3 两组患者电解质测定结果比较(±s)
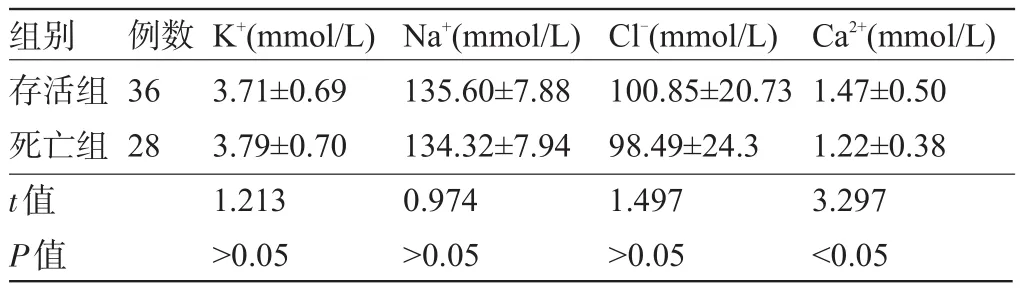
表3 两组患者电解质测定结果比较(±s)
组别存活组死亡组t值P值例数36 28 K+(mmol/L) 3.71±0.69 3.79±0.70 1.213>0.05 Na+(mmol/L) 135.60±7.88 134.32±7.94 0.974>0.05 Cl-(mmol/L) 100.85±20.73 98.49±24.3 1.497>0.05 Ca2+(mmol/L) 1.47±0.50 1.22±0.38 3.297<0.05
2.4 血气分析结果与APACHEⅡ评分比较 为进一步明确PCO2、血HCO3-、血BE对SAP患者预后的判断价值,使用ROC曲线计算三者在SAP的预后诊断正确率,得血BE及APACHEⅡ评分的ROC曲线面积最大,表明其诊断正确率最高,见图1。

图1 ROC曲线
3 讨论
重症胰腺炎为常见的临床急腹症,通常会引起多器官病变,患者预后差,死亡率高。重症胰腺炎患者存在两个高危死亡期:(1)发病后7~14 d,主要死因为全身性炎症反应引起的多脏器障碍综合征(MODS);(2)发病14~21 d,主要死因为继发性胰腺感染(SPI)。重症胰腺炎并发MODS患者肺部受影响最大。SAP的肺损伤机制可能为[7]:(1)肺组织大量集聚中性粒细胞,产生促炎因子。浸润的中性粒细胞可释放出氧化剂和各种蛋白酶,破坏肺组织,产生肺部损害;(2)细胞因子参与了患者肺损伤的整个过程。患者胰腺消化酶激活,引起自身消化,实质性损害胰腺,释放氧化剂、蛋白酶等,损伤肺等器官;(3)腹水及其内的激素等引起循环衰竭,出现肺灌注不足等。低氧血症会引起钙离子大量内流,激活磷脂细胞系统,破坏溶酶体膜,释放酶,进一步破坏重要组织器官,加重脏器损害。研究表明,重症胰腺炎患者经常伴有异常的呼吸血气结果,血气分析各指标改变可能成为反映SAP患者预后的因素。
本研究结果表明,BE为SAP患者死亡的最主要危险因素,PCO2和血HCO3-也为影响重症胰腺炎预后主要指标,与文献报道相同[8]。Dellinger等[9]发现重症胰腺炎常伴发急性肺损伤,从而引起血气改变,血气改变程度可能与预后有关。Yi等[10]发现AP变化会影响全身组织器官功能,而不仅仅影响消化系统。Banks等[11]研究结果也表明SAP引发的炎症反应可影响几乎所有系统。目前,血气分析可反应呼吸、循环、泌尿以及内分泌系统在内的组织器官的重要指标。因此,血气分析可反应SAP患者的综合情况,有利于寻找有效的反应SAP患者预后指标[12]。本研究分析了BE、PCO2和HCO3-对SAP患者的预后价值,并与APACHEⅡ评分比较,结果表明,表明BE及APACHEⅡ评分的ROC曲线面积最大,证明两者在判断SAP预后正确率最高。目前,APACHEⅡ评分在反应SAP的预测指标中敏感性最强,虽然BE在判断SAP预后上不及APACH EⅡ评分,但APACHEⅡ评分较为复杂,因此BE可作为临床上判断SAP预后的更为简单、准确的指标。
综上所述,SAP患者应及早进行血气分析检测,帮助及早判断预后,进行合理治疗。
[1]王春亭,曲鑫.重症急性胰腺炎的诊治进展[J].中华急诊医学杂志, 2012,21(10):1080-1083.
[2]党胜春,冯舒,王平江,等.巨噬细胞表型在重症胰腺炎肾损伤中的表达[J].中华急诊医学杂志,2014,23(7):765-769.
[3]李进展,张会迎,吴俊伟,等.早期应用肠内营养对急性重症胰腺炎预后的影响[J].广东医学,2012,33(11):1597-1598.
[4]陈素娟,梁志民.重症胰腺炎非手术治疗的护理进展[J].中国实用护理杂志,2012,28(1):188-188.
[5]管向东,孙冠青.重症胰腺炎的多脏器功能支持与替代治疗[J].中华急诊医学杂志,2011,20(2):120-123.
[6]杨梅,李丹卉,宋意,等.三导丝盲视法置入鼻空肠管在重症胰腺炎患者中的应用[J].中华护理杂志,2012,47(12):1074-1076.
[7]刘晓玲,徐灵莉.重症胰腺炎患者应用肠内外营养治疗的临床护理[J].重庆医学,2012,41(35):3791-3792.
[8]Maraví-Poma E,Patchen DE,Forsmark C E,et al.International multidisciplinary classification of acute pancreatitis severity:the 2013 Spanish edition[J].Med Intensiva,2014,38(4):211-217.
[9]Dellinger EP,Forsmark CE,Layer P,et al.Determinant-based classification of acute pancreatitis severity:an international multidisciplinary consultation[J].Ann Surg,2012,256(6):875-880.
[10]Yi F,Ge L,Zhao J,et al.Meta-analysis:total parenteral nutrition versus total enteral nutrition in predicted severe acute pancreatitis[J].Intern Med,2012,51(6):523-530.
[11]Banks PA,Bollen T L,Dervenis C,et al.Classification of acute pancreatitis-2012:revision of the Atlanta classification and definitions by international consensus[J].Gut,2013,62(1):102-111.
[12]陈英全,谭双,陈国伟,等.血液灌流联合血液透析对急性重症胰腺炎患者抑制性T细胞的影响[J].中国全科医学,2012,15(18):2098-2100.
Clinical value of blood gas analysis in the early prognosis of severe acute pancreatitis.
LI Xiao,GAO Wei-fang, SANG Rong-xia,ZHANG Ji-yuan,HU jing,LIU Run,HAN Zhan-bo.The Second Department of Gastroenterology,the First Hospital of Shijiazhuang City,Shijiazhuang 050011,Hebei,CHINA
Objective To investigate the clinical value of blood gas analysis in the early stage of severe acute pancreatitis(SAP).MethodsAtotal of 64 patients with SAP,who admitted to ICU of our hospital from September 2012 to September 2014,were enrolled in the study.With ICU stay of 10 d as the primary endpoint,the patients were divided into survival group(36 cases,with remission or with no deterioration)and death group(28 cases,death).All patients were treated by routine treatment in ICU.Blood gas analysis and electrolyte examination were carried out within 48 h,which were compared with the results of APACHEⅡ.ResultsBlood gas test results within 48 h showed that there were significant differences in arterial-venous blood pH(A-VpH)[(0.022±0.09)vs(0.031±0.015)]and arterial-venous blood CO2levels(A-VPCO2)[(8.68±1.35)vs(11.48±4.56)]between survival group and death group(P<0.05),with no significant differences in blood pH[(7.35±0.06)vs(7.36±0.05)]and blood PO2levels[(95.3±8.9)mmHg vs(95.9±9.1)mmHg],P>0.05. The two groups showed statistically significant differences in PCO2[arterial:(35.3±3.0)mmHg vs(29.9±3.0)mmHg; venous:(35.3±3.0)mmHg vs(29.9±3.0)mmHg],blood HCO3-[arterial:(23.8±1.2)mmol/L vs(20.2±1.9)mmol/L; venous:(17.5±1.0)mmol/L vs(19.3±1.2)mmol/L],blood Lac[arterial:(2.7±0.9)mmol/L vs(4.1±1.7)mmol/L; venous:(1.7±0.6)mmol/L vs(1.8±0.4)mmol/L mmol/L],blood BE[arterial:(-1.7±1.2)mmol/L vs(-4.3±1.6)mmol/L; arterial:(1.9±1.2)mmol/L vs(2.1±0.9)mmol/L mmol/L](P<0.05).There were no significantdifferencesbetweenthesurvival group and the death group in the levels of K+[(3.71±0.69)mmol/L vs(3.79±0.70)mmol/L],Na+[(135.60±7.88)mmol/L vs (134.32±7.94)mmol/L],Cl-[(100.85±20.73)mmol/L vs(98.49±24.3)mmol/L]within 48 h(P>0.05).The Ca2+levels in the two groups were both decreased,and the level in the survival group was significantly lower than that in death group [(1.47±0.50)mmol/L vs(1.22±0.38)mmol/L,P<0.05].In order to determine the value of PCO2,HCO3-and BE in the prognosis of patients with SAP,the ROC curves were used to calculate the accuracy rate of prognosis of patients with SAP.The area under the ROC curve of BE and APACHEⅡscore was the largest,which indicated the highest diagnostic accuracy.ConclusionThe early detection of blood gas analysis in patients with SAP is more conducive to the judgment of prognosis.The prognosis of patients with bigger negative BE score and older age may be poor.
Blood gas analysis;Severe acute pancreatitis(SAP);Early prognosis;Judgment
R657.5+1
A
1003—6350(2016)10—1582—03
10.3969/j.issn.1003-6350.2016.10.011
2015-11-07)
2015年河北省医学重点科技研究计划(编号:20150907)
李晓。E-mail:lisenyang0904@sina.com
