DDR1促进胰腺癌细胞AsPC-1的迁移及侵袭能力
2016-03-06杨佳纯张毅曹佳徐雷鸣
杨佳纯,张毅,曹佳,徐雷鸣
(上海交通大学医学院附属新华医院消化内科,上海200092)
DDR1促进胰腺癌细胞AsPC-1的迁移及侵袭能力
杨佳纯,张毅,曹佳,徐雷鸣
(上海交通大学医学院附属新华医院消化内科,上海200092)
目的探讨盘状结构域受体1(DDR1)对胰腺癌细胞迁移及侵袭能力的影响。方法利用qRT-PCR检测DDR1在胰腺癌旁组织及癌组织中的表达水平。通过脂质体转染DDR1表达质粒至胰腺癌细胞AsPC-1中,应用Western blot验证其转染效果。通过划痕实验及Transwell法检测转染DDR1表达质粒后细胞迁移及侵袭能力的变化情况。Western blot检测转染后基质金属蛋白酶2(MMP2)和基质金属蛋白酶9(MMP9)的表达水平。结果与癌旁组织比较,胰腺癌组织的DDR1 mRNA表达水平显著升高(P<0.05)。转染质粒后,AsPC-1细胞DDR1蛋白表达量显著升高(P<0.05)。应用划痕试验及Transwell试验结果显示,与对照组比较,AsPC-1/DDR1迁移力上调(51.11±11.51)%,侵袭力上调(77.25±10.64)%,差异均具有统计学意义(P<0.05)。过表达DDR1后,AsPC-1细胞中MMP2和MMP9表达水平显著升高(P<0.05)。结论DDR1通过改变MMP2和MMP9的表达水平,促进胰腺癌细胞的迁移及侵袭,有望成为靶向治疗的新方向。
盘状结构域受体1;胰腺癌;迁移;侵袭;基质金属蛋白酶2;基质金属蛋白酶9
胰腺癌是消化系统恶性程度极高的肿瘤之一,其发病率和病死率逐年升高,五年生存率通常不超过5%。并且,多数患者确诊时已处于中晚期,常伴有淋巴结或远处转移,手术切除率低,复发率高。因此,深入研究胰腺癌发生发展机制,在分子靶向治疗方面取得新的成果,对提高患者的生存时间具有重要的意义[1-3]。
盘状结构域受体1(Discoidin domain receptor 1,DDR1)作为一种受体型酪氨酸激酶,在许多恶性肿瘤中异常表达。其主要通过调控胶原蛋白的合成和降解,参与癌细胞的增殖、迁移、侵袭和基质重塑[4]。因此,本研究通过DDR1过表达质粒转染至AsPC-1中,观察其对胰腺癌细胞的迁移及侵袭能力的影响以及对基质金属蛋白酶2(MMP2)和基质金属蛋白酶9 (MMP9)表达情况的影响,探讨DDR1是否通过调节基质金属蛋白酶的表达,参与胰腺癌细胞的迁移及侵袭。
1 材料与方法
1.1 细胞株及实验材料人胰腺癌细胞AsPC-1购于上海中国医学科学院细胞库。RPMI-1640培养基,0.25%胰蛋白酶,胎牛血清均购于美国Gibco公司。LipofectamineTM2000购于美国Invitrogen公司。pcDNA3.1/DDR1质粒购于上海吉凯基因化学技术有限公司。Matrigel基质胶购于美国BD公司。Transwell购于美国Corning公司。兔抗人单克隆抗体DDR1购于美国CST公司。兔抗人多克隆抗体MMP2、兔抗人多克隆抗体MMP9均购于美国Santa Cruz公司。逆转录及real-time PCR试剂盒购于日本Takara公司。
1.2 细胞培养人胰腺癌细胞AsPC-1在含10%胎牛血清的RPMI-1640培养基中培养、传代。放置于37℃,5%CO2恒湿培养箱中常规培养。
1.3 DDR1质粒转染当细胞培养至密度为70%~80%时进行转染。采用脂质体转染法,具体操作流程参照Lipofectamine2000说明书。转染72 h后提取蛋白,进行Western blot检测。
1.4 Real-time PCR法按照试剂盒说明书抽提细胞总RNA并逆转录合成cDNA。基因表达通过2′-△△CT方法进行计算。实验重复3次。引物:DDR1上游:5′-GGTGCTGATGCTCTGTAGGG-3′;DDR1下游:5′-CGTGTTGAGTGCATCCTCTG-3′。
1.5 Western blot法将细胞加至含有PMSF的蛋白裂解液,冰上放置45 min,低温离心,提取上清。并根据BCA法进行蛋白浓度测定。取60~80 μg总蛋白,配制10%聚丙烯酰胺凝胶,80 V 120 min进行电泳。转膜条件为300 mA 100 min。含5%脱脂奶粉的TBST室温封闭2.5 h,TBST洗3遍,加入DDR1抗体(1:1 000),MMP2抗体(1:500),MMP9抗体(1:200)及tubulin抗体(1:1 000),4℃冰箱过夜,TBST洗3遍,分别加入相应二抗(1:1 000)室温孵育2 h,TBST洗膜3遍,ECL发光液发光。
1.6 细胞划痕实验将AsPC-1细胞接种于12孔板,转染后用100µl的枪头做十字划痕,磷酸盐缓冲液(PBS)洗2遍,加入正常培养基常规培养,分别于0 h、24 h、48 h、72 h拍照。
1.7 细胞迁移及侵袭力检测转染24 h的AsPC-1细胞消化离心,无血清培养基洗涤细胞1次后用无血清培养基重悬细胞,调整细胞数为2×105/ml。每孔上室加入100µl,下室加入500µl含2%胎牛血清的RPMI-1640培养基,37℃培养箱内孵育24~36 h后取出小室,弃去培养基,用棉签蘸清水擦拭小室内的残余细胞。甲醇固定30 min,结晶紫染色10 min,显微镜下拍照并随机计算8个视野穿膜细胞数。Transwell小室包被Matrigel基质胶80µl(1:4稀释),37℃孵育6 h。在上室及下室均加入500µl无血清培养基置4℃过夜。余步骤同细胞迁移实验。
1.8 统计学方法应用SPSS19.0统计软件进行数据分析,计量资料均以均数±标准差(±s)表示,实验重复3次。两组实验均数比较采用t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 胰腺癌及癌旁组织DDR1的表达水平qRT-PCR结果示,胰腺癌组织中DDR1的表示水平显著高于癌旁组织(P<0.05),见图1。

图1 qRT-PCR检测DDR1 mRNA在胰腺癌癌旁组织及癌组织中表达情况
2.2 DDR1转染AsPC-1后蛋白表达水平DDR1表达质粒转染AsPC-1,AsPC-1/DDR1的相对蛋白表达量为(2.55±0.55),显著高于对照组(P<0.05),见图2。
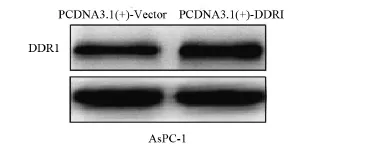
图2 Western blot检测DDR1质粒转染后的表达情况
2.3 DDR1过表达后AsPC-1细胞迁移能力变化与对照组比较,DDR1质粒组在0 h、24 h、48 h、72 h的胰腺癌细胞AsPC-1迁移能力显著提高,见图3。Transwell实验结果示,与对照组比较,AsPC-1细胞迁移力上升(51.11±11.51)%,差异具有统计学意义(P<0.05),见图4。

图3 划痕实验检测DDR1质粒转染后对细胞体外迁移能力的影响
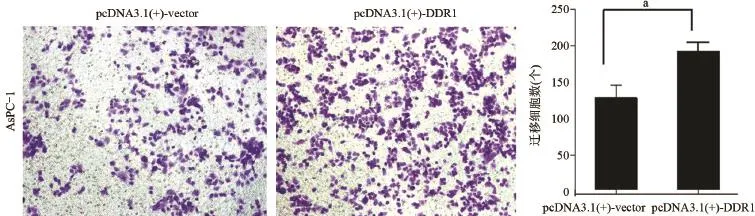
图4 Transwell检测DDR1质粒转染后对细胞体外迁移能力影响
2.4 DDR1过表达后AsPC-1细胞侵袭能力变化采用侵袭实验表明,与对照组比较,DDR1表达上调后穿膜细胞数显著增加,AsPC-1细胞侵袭力增加(77.25±10.64)%,差异具有统计学意义(P<0.05),见图5。

图5 DDR1质粒转染后对细胞体外侵袭能力的影响
2.5 DDR1过表达后AsPC-1细胞MMP2、MMP9表达情况Western blot实验检测转染后MMP2和MMP9的表达情况,结果表明,与对照组相比,AsPC-1/ DDR1组的MMP2和MMP9蛋白水平显著升高,见图6。

图6 Western blot检测DDR1质粒转染后对MMP2和MMP9表达的影响
3 讨论
肿瘤的侵袭转移是一个复杂的级联过程。胰腺癌作为一种消化系统的恶性肿瘤,具有发病隐匿、转移早、进展快、预后非常差的特点。因此,进一步研究与胰腺癌侵袭转移密切相关的基因,探讨其发生发展机制,为今后靶向治疗提供理论依据[5]。
DDR1作为一种酪氨酸激酶,对肿瘤的发生发展起着至关重要的作用,其可以通过与肿瘤细胞周围胶原蛋白相互作用,降解细胞外基质,促进侵袭和转移[6-7]。在胰腺癌方面,研究发现,DDR1异常表达于胰腺癌患者中,且与其预后有着密切的关系[8]。在机制方面,I型蛋白胶原可以与DDR1或整合素相互作用,通过p130CAS-Rap1-MLK3-MKK7-JNK1-cJun信号通路,上调N-cadherin的表达,促进胰腺癌细胞扩散[9]。COLXV通过与DDR1相互结合,直接作用于E-cadherin,抑制COLI介导的细胞散射,从而调节胰腺癌细胞的侵袭能力[10]。在DDR1治疗方面,研究人员发现了一种选择性DDR1抑制剂——DDR1-IN-1,其可抑制DDR1发生自身磷酸化,促进肿瘤细胞的凋亡,有望成为DDR1过表达或突变的肿瘤治疗探针[11]。可见,DDR1在胰腺癌发展过程中起着十分重要的作用。
本研究将DDR1表达质粒转染入AsPC-1细胞中,旨在研究外源性过表达DDR1对胰腺癌细胞迁移及侵袭的影响。研究发现,与癌旁组织比较,DDR1过表达于胰腺癌组织中。胰腺癌细胞过表达DDR1后,MMP2和MMP9的表达亦显著升高,促进AsPC-1的迁移及侵袭能力。
综上所述,在胰腺癌细胞中,DDR1通过调节MMP2和MMP9的表达增强其迁移及侵袭能力。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2015[J].CA Cancer J Clin,2015,65(1):5-29.
[2]Brenner H,Gondos A,Arndt V.Recent major progress in long-term cancer patient survival disclosed by modeled period analysis[J].J Clin Oncol,2007,25(22):3274-3280.
[3]Cid-Arregui A,Juarez V.Perspectives in the treatment of pancreatic adenocarcinoma[J].World J Gastroenterol,2015,21(31):9297-9316.
[4]Valiathan RR,Marco M,Leitinger B,et al.Discoidin domain receptor tyrosine kinases:new players in cancer progression[J].Cancer Metastasis Rev,2012,31(1-2):295-321.
[5]Richter A,Niedergethmann M,Sturm JW,et al.Long-term results of partial pancreaticoduodenectomy for ductal adenocarcinoma of the pancreatic head:25-year experience[J].World J Surg,2003,27(3): 324-329.
[6]Alves F,Saupe S,Ledwon M,et al.Identification of two novel kinase-deficient variants of discoidin domain receptor 1:differential expression in human colon cancer cell lines[J].FASEB J,2001,15 (7):1321-1323.
[7]Miao L,Zhu S,Wang Y,et al.Discoidin domain receptor 1 is associated with poor prognosis of non-small cell lung cancer and promotes cell invasion via epithelial-to-mesenchymal transition[J].Med Oncol,2013,30(3):626.
[8]Huo Y,Yang M,Liu W,et al.High expression of DDR1 is associated with the poor prognosis in Chinese patients with pancreatic ductal adenocarcinoma[J].J Exp Clin Cancer Res,2015,34(1):88.
[9]Shintani Y,Fukumoto Y,Chaika N,et al.Collagen I-mediated up-regulation of N-cadherin requires cooperative signals from integrins and discoidin domain receptor 1[J].J Cell Biol,2008,180(6):1277-1289.
[10]Clementz AG,Mutolo MJ,Leir SH,et al.Collagen XV inhibits epithelial to mesenchymal transition in pancreatic adenocarcinoma cells [J].PLoS One,2013,8(8):e72250.
[11]Canning P,Tan L,Chu K,et al.Structural mechanisms determining inhibition of the collagen receptor DDR1 by selective and multi-targeted typeⅡkinase inhibitors[J].J Mol Biol,2014,426(13):2457-2470.
Up-regulating effect of DDR1 on migration and invasion of human pancreatic cancer cell line AsPC-1.
YANG Jia-chun,ZHANG Yi,CAO Jia,XU Lei-ming.Department of Gastroenterology,Xin Hua Hospital Affiliated to Shanghai Jiao Tong University School of Medicine,Shanghai 200092,CHINA
ObjectiveTo investigate the effect of discoidin domain receptor 1(DDR1)on the migration and invasion of human pancreatic cancer cell line AsPC-1.MethodsThe expressions of DDR1 mRNA in pancreatic cancer tissues and adjacent tissues were determined by real-time PCR.The expressions of DDR1,matrix metalloproteinase 2 (MMP2)and matrix metalloproteinase 2(MMP9)were detected by Western blot after the DDR1 expression plasmid was transfected into AsPC-1 cell line.The ability of migration and invasion was determined by Wound Healing and Transwell.ResultsThe expression of DDR1 mRNA in pancreatic cancer tissues was significantly higher than that in adjacent tissues(P<0.05).After the DDR1 plasmid was transfected into AsPC-1,the protein expression of DDR1 was significantly up-regulated(P<0.05).Compared with cells transfected with empty vector(control),the ability of migration and invasion for cells transfected with DDR1 plasmid were increased by(51.11±11.51)%and(77.25±10.64)%,and the expression levels of MMP2 and MMP9 after overexpression of DDR1 were also significantly up-regulated.The differences were all statistically significant(P<0.05).ConclusionDDR1 can promote the migration and invasion of human pancreatic caner cell line AsPC-1 via up-regulating the expressions of MMP2 and MMP9.It could be considered as a potential target for gene therapy for pancreatic cancer.
Discoidin domain receptor 1(DDR1);Pancreatic cancer;Migration;Invasion;Matrix metalloproteinase 2(MMP2);Matrix metalloproteinase 2(MMP9)
R735.9
A
1003—6350(2016)02—0173—04
10.3969/j.issn.1003-6350.2016.02.001
2015-09-21)
国家自然科学基金青年科学基金(编号:81301826)
徐雷鸣。E-mail:leiming.xu@aliyun.com;曹佳。E-mail:76333336@qq.com。
