改良FOLFOX方案联合奥曲肽治疗晚期肝癌的疗效及安全性
2016-03-04张海鸽
张海鸽
改良FOLFOX方案联合奥曲肽治疗晚期肝癌的疗效及安全性
张海鸽
目的探讨改良FOLFOX方案联合奥曲肽治疗晚期肝癌的临床疗效及安全性。方法72例晚期肝癌患者, 随机分为观察组和对照组, 每组36例。对照组采用单纯的改良FOLFOX方案, 观察组在对照组基础上加奥曲肽静脉滴注。比较两组的临床疗效、不良反应及1年生存情况。结果观察组患者的临床疗效明显优于对照组, 1年生存率高于对照组, 差异有统计学意义(P<0.05);观察组不良反应发生率低于对照组, 差异有统计学意义(P<0.05)。结论化疗联合奥曲肽能有效提高化疗的疗效及降低化疗药物的毒性作用, 值得临床推广应用。
FOLFOX方案;奥曲肽;肝癌
肝癌起病较隐匿, 易漏诊和误诊, 确诊时多属晚期。大多数肝癌患者在确诊时已无手术机会而仅能接受辅助化疗[1]。临床研究表明, 奥曲肽能有效延长肝癌患者的生存期,改善其生活质量[2]。本研究对72例晚期肝癌患者采用改良FOLFOX化疗方案合用奥曲肽治疗, 观察期疗效及安全性。现将研究结果报告如下。
1 资料与方法
1.1一般资料 选取2010年10月~2014年1月在本院住院治疗的72例晚期肝癌患者。均接受组织病理学、影像学检查确诊。纳入标准:年龄>18岁, 体力评分0~2分, 预计生存期>3个月, 影像学检查>1个病灶。排除标准:对本研究所有药物过敏者、肝转移者、不接受本研究的治疗方案者。将患者随机分为观察组和对照组, 每组36例。对照组男25例,女11例;年龄35~71岁, 平均年龄(65.8±6.2)岁;体质量指数(BMI)17~27 kg/m2, 平均BMI (21.1±1.8) kg/m2;肿瘤类型:大细胞癌10例, 弥漫性肝细胞癌26例。观察组男27例, 女9例;年龄33~72岁, 平均年龄(66.0±6.7)岁;BMI 18~28 kg/m2,平均BMI (21.3±1.7) kg/m2;肿瘤类型:大细胞癌8例, 弥漫性肝细胞癌28例。两组患者性别、年龄等一般资料比较差异无统计学意义(P>0.05), 具有可比性。
1.2治疗方法 对照组单纯采用改良FOLFOX方案进行化疗, 即奥沙利铂(南京制药厂有限公司, 50 mg/支, 批号:20100919A20) 85 mg/m2, 静脉注射, 第1, 8天; 5-氟尿嘧啶 (上海上海旭东海普药业有限公司, 250 mg/支, 批号:FA1012245B)400 mg/m2, 静脉注射, 第1~5天;亚叶酸钙(扬州奥赛康药业有限公司, 100 mg/支, 批号:110105A3)200 mg/m2,静脉注射, 第1~5天。21 d为1个周期, 共治疗6个周期。观察组在对照组基础上加用奥曲肽(国药一心制药有限公司, 0.1 mg/支, 批号:101215B)0.2 mg, 溶入100 ml 5%葡萄糖溶液,静脉注射, 2次/d, 连续治疗6个周期。
1.3观察指标和疗效判定标准 观察比较两组的临床疗效、1年生存率及不良反应发生情况。临床疗效参照RECIST1.0评价标准[3]评定:完全缓解(CR):所有可测病灶完全消失;部分缓解(PR):所有可测病灶体积缩小程度≥30%;稳定(SD):所有可测病灶体积缩小程度<30%, 但增长幅度<20%;进展(PD):所有可测病灶体积增加≥20%或出现新病灶。有效率=(CR+PR)/总例数×100%。不良反应参照WHO制定的0~Ⅳ级抗癌药物不良反应标准评定。
1.4统计学方法 采用SPSS19.0统计学软件对数据进行统计分析。计量资料以均数±标准差(±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验;等级资料采用秩和检验。P<0.05表示差异具有统计学意义。
2 结果
2.1两组临床疗效比较 两组均无一例达CR标准, 但观察组PR比例及有效率明显高于对照组, 差异有统计学意义(P<0.05)。见表1。
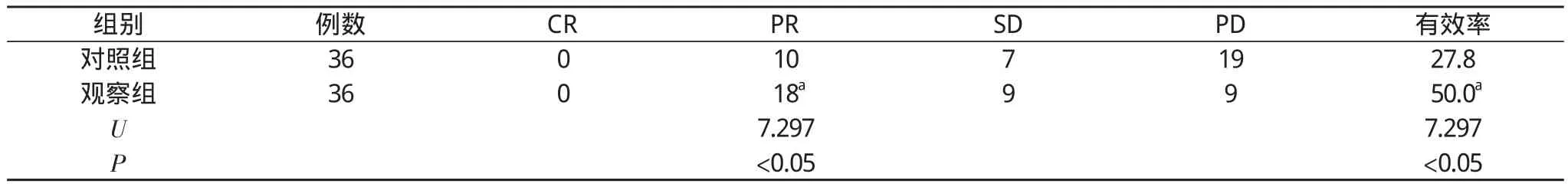
表1 两组患者临床疗效比较(n, %)
2.2两组不良反应发生率比较 对照组和观察组白细胞减少达Ⅲ~Ⅳ级的不良反应发生率分别为27.8%(10/36)、8.3%(3/36);观察组不良反应发生率明显低于对照组, 差异有统计学意义(χ2=4.600, P=0.03<0.05)。
2.3两组1年生存率比较 观察组18例存活超过1年, 1年生存率为50.0%(18/36);对照组11例存活超过1年, 1年生存率为25.0%(9/36), 两组比较差异有统计学意义(P<0.05)。
3 讨论
肝癌是临床常见的一种消化系统恶性肿瘤。据调查报道,全世界每年新增肝癌患者约20~30万, 目前已成为患者死亡的重要原因之一[4]。乙肝和丙肝感染是导致肝癌发生最常见原因。我国乙肝病毒感染人数已接近1亿人。截止目前,我国肝癌发生率明显高于欧美国家。全身化疗或肝动脉介入化疗是晚期肝癌的常用疗法, 化疗药物一般选用顺铂、阿霉素、丝裂霉素和5-氟尿嘧啶等。近期, 许多研究表明, 改良FOLFOX方案已被广泛应用于晚期肝癌的治疗, 其临床缓解率得到了有效提高, 生存期也明显延长[5]。
奥曲肽是一种人工合成生长抑素, 在胰腺炎、上消化道出血等的治疗领域中得到了广泛应用, 疗效显著。据报道[6], 奥曲肽可抑制肿瘤细胞增殖, 诱导其凋亡, 故近年来被逐渐应用于肿瘤的治疗中。有研究对105例肝硬化肝癌患者采用奥曲肽辅助动脉插管化疗法治疗, 发现应用奥曲肽的患者临床缓解率明显提高, 生存时间也明显延长[7]。 另有研究表明, 对晚期肝癌患者给予以5-氟尿嘧啶为主的化疗方案, 同时静脉滴注奥曲肽, 结果显示, 联用奥曲肽的患者生活质量得分明显高于单纯5-氟尿嘧啶为主的化疗者, 不良反应发生率极低[8]。本研究结果亦显示, 在改良FOLFOX方案实施的同时, 给予奥曲肽静脉滴注, 临床疗效明显优于对照组(P<0.05), 1年生存率优于对照组(P<0.05), 不良反应发生率低于对照组(P<0.05)。
综上所述, 化疗联合奥曲肽能有效提高化疗的疗效及降低化疗药物的毒性作用, 值得临床推广应用。
[1]林萍萍, 吕喜英, 刘兰芳.索拉非尼口服联合放疗治疗肝癌效果观察.山东医药, 2011, 51(50):44-45.
[2]胡安斌, 何晓顺, 邰强, 等.索拉非尼在预防和治疗肝癌肝移植术后肿瘤复发中的疗效评价.中华医学杂志, 2012, 92(18): 1264-1267.
[3]皋文君, 刘砚燕, 袁长蓉.国际肿瘤化疗药物不良反应评价系统-通用不良反应术语标准4.0版.肿瘤, 2012, 32(2):142-144.
[4]翟仁友, 王剑锋, 戴定可.肝癌合并梗阻性黄疸的介入治疗.中国介入影像与治疗学, 2006(2):81-83.
[5]刘波, 韩淑梅, 张国栋, 等.西妥昔单抗联合改良FOLFOX方案治疗转移性结直肠癌疗效观察.山东医药, 2011, 51(19):83-84.
[6]王书敏, 赵和平.消癌平联合奥曲肽对小鼠肝癌移植癌生长抑制作用的研究.中国肿瘤临床, 2011, 31(18):20-22.
[7]王思颖, 赵和平, 王书敏 , 等.消癌平注射液联合奥曲肽对H22荷瘤小鼠细胞凋亡的影响 .中国药物与临床, 2013, 33(2): 61-62.
[8]汪明云, 魏荣富, 顾胤.奥曲肽联合化疗治疗中晚期肝癌疗效观察.现代肿瘤医学, 2014, 32(3):65-66.
10.14164/j.cnki.cn11-5581/r.2016.03.141
2015-10-08]
471000 郑州大学附属洛阳中心医院放疗科
