新生儿败血症四年临床诊治分析
2016-03-03王丽芳
王丽芳
新生儿败血症四年临床诊治分析
王丽芳
目的 探讨近四年本院新生儿败血症血培养主要病原菌及药敏特点、危重病例诊治特点。方法 95例儿科收治、血培养阳性的新生儿败血症患儿,对致病菌及药物敏感试验、危重病例临床表现进行回顾性分析。结果 本组新生儿败血症95例,占同期住院新生儿的2.05%(95/4640)。血培养检出病原菌18种,共96株,其中表皮葡萄球菌60株(62.5%) ,居首位,其他依次为人葡萄球菌亚种6株(6.25%),大肠埃希氏菌和溶血葡萄球菌各5株(5.2%),金黄色葡萄球菌、头状葡萄球菌和华纳氏葡萄球菌各3株(3.1%)。G+菌87株,对青霉素、苯唑青霉素、氨苄青霉、阿莫西林/棒酸、头孢唑林、红霉素、亚胺培南耐药性高,对克林霉素、万古霉素敏感性高,对万古霉素全部敏感;G-菌9株,对亚胺培南全部敏感。结论 革兰阳性菌中葡萄球菌居首位,革兰阴性菌中大肠埃希菌居首位,是新生儿败血症的主要病原菌。近4年本院新生儿败血症危重病例数多,并发症多。
败血症;病原菌;耐药;新生儿
新生儿败血症指新生儿期细菌或真菌侵入血液循环并在其中生长繁殖,产生毒素所造成的全身性感染。治疗成功的关键在于尽早明确病原菌,选择敏感抗生素[1]。本文分析本院新生儿科2011~2014年收治的95例新生儿血培养阳性的败血症致病菌及耐药情况,以期为临床诊治、合理应用抗菌药物提供参考。现报告如下。
1 资料与方法
1.1 一般资料 2011~2014年太仓市第一人民医院新生儿科收治新生儿4640例,选择其中95例新生儿血培养呈阳性结果、且符合2003年昆明会议制订的新生儿败血症诊疗方案确诊标准[1]的新生儿为研究对象,对致病菌及其耐药情况、临床诊治特点进行回顾性分析。
1.2 方法
1.2.1 数据收集 收集患儿住院时的一般资料、临床表现、并发症、实验室检查结果。
1.2.2 血培养、鉴定及药敏 入选患儿均于入院当日,尽量争取在使用抗生素前以无菌法取患儿股静脉血2ml,注入小儿血培养专用瓶中,60min 内送检; 应用西门子微生物鉴定仪全自动细菌培养仪(2011~2013年)及法国生物梅里埃公司生产的全自动细菌培养仪(2014年)进行细菌培养,在24~48 h内一旦有细菌生长报警,继续用法国生物梅里埃公司VITEK2 微生物鉴定系统做菌株鉴定。抗生素药敏纸片为英国OXOID 公司产品,药物敏感试验采用Mueller-Hintou(MH)培养基,药敏方法采用Kirby-Bauer 纸片扩散法,根据美国国家临床实验室标准委员会2002年版抗生素药敏试验操作标准[2]判断结果。
1.2.3 质量控制 采用金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922 和铜绿假单胞菌ATCC27853 进行药敏质控。质控菌株购自江苏省临床检验中心。
2 结果
2.1 血培养阳性率及菌株 研究期间血培养阳性率为2.05%,95例中94例为单一菌株感染,1例为双重菌株感染(检出鲍曼不动杆菌和缓症链球菌 ),共检出18种菌株,96株。
2.2 一般资料 血培养阳性95例中,男51例(53.7%),女44例(46.3%) ; 日龄≤7 d 62例(65.3%) ,>7 d 33例(34.7%);足月儿84例(88.4%) ,早产儿10例(10.5%) ,过期产儿1例(1.1%);顺产58例(61.1%),剖宫产37例(38.9%) ; 低出生体重儿7例(7.4%),正常体重儿80例(84.2%),巨大儿8例(8.4%),羊水清亮74例(77.9%),羊水污染21例(22.1%);有窒息16例(16.8%),无窒息79例(83.2%) ;自动出院4例(4.2 %),转上级医院5例(5.3%),好转86例(90.5%)。
2.3 临床资料 有发热9例(9.5%),体温不升3例(3.2%),皮肤感染2例(2.1%),脐炎5例(5.3%) ,肺炎 42例 (44.2%),尿路感染2例(2.1%),心肌损害3例(3.2%),病理性黄疸66例(69.5%) ,化脓性脑膜炎1例(1.1%),双侧室管膜出血1例(1.1%),中毒性脑病1例(1.1%),中毒性肠麻痹1例(1.1%),结膜炎1例(1.1%),蛛网膜下腔出血1例(1.1%),肝损害1例(1.1%),感染性休克1例(1.1%),呼吸衰竭2例(2.1%),低血糖2例(2.1%),高血糖1例(1.1%),室上性心动过速1例(1.1%),鹅口疮1例(1.1%),梅毒1例(1.1%),唇裂1例(1.1%),并指畸形1例(1.1%),低钠血症1例(1.1%),气促11例(11.6%),呻吟6例(6.3%),呼吸暂停2例(2.1%),青紫5例(5.3%),鼻塞3例(3.2%),哭声不畅7例(73.4%),C反应蛋白≥10mg/L 13例(13.7%),呛奶1例(1.1%),拒奶1例(1.1%),反应欠佳1例(1.1%),少尿1例(1.1%),皮肤花纹3例(3.2%),腹泻6例(6.3%),呕吐2例(2.1%),腹胀3例(3.2%) ,便血1例(1.1%),抽搐 1例(1.1%)。白细胞<5×109/L 7例(7.4%),白细胞>20×109/L 3例(3.2%),血小板<100×109/L 3例(3.2%),酸中毒24例(25.3%)。
2.4 危重病例诊治情况 本组血培养阳性95例中,有13例病情危重(占13.7%),其中转院5例,放弃自动出院4例,好转4例。
本组血培养病原微生物为大肠埃希氏菌的患儿,5例均病情危重(1例出生25 d,诊断肺炎、感染性休克、中毒性肠麻痹、中毒性脑病、酸中毒、低钠血症、应激性高血糖,经吸氧、“罗氏芬”抗感染,“丙球”支持、“甲强龙”抗炎,及“生理盐水”扩容、“碳酸氢钠”纠酸、胃肠减压、纠正低钠对症、次日改“美平”加强抗感染、“多巴胺、酚妥拉明”改善循环、“苯巴比妥”止惊厥、“甘露醇”降颅内压对症治疗后呻吟及皮肤花纹、腹胀减轻,但仍发热,予转院。其中2例为双胎,出生15min,胎龄31+2周,且均诊断新生儿肺炎、窒息、低出生体重儿、呼吸骤停、酸中毒、高胆红素血症、消化道畸形、并指畸形,其中“双胎之大”予“头孢他啶”抗感染,吸氧、纠酸、“多巴胺”改善循环、蓝光退黄、“氨茶碱”兴奋呼吸,病情进展致呼吸衰竭,予气管插管呼吸机机械呼吸,呼吸困难无好转,脉氧不稳定,于入院治疗20 h后家属放弃治疗,其中“双胎之小”予持续正压通气(CPAP)辅助通气,“头孢他啶”1 d后改“头孢哌酮舒巴坦”加强抗感染,气促好转,但入院5 d大便未解,入院治疗7 d后出现皮肤出血点,查血小板明显减少18×109/L、C反应蛋白(CRP)明显升高98mg/L,家属放弃治疗。1例出生8 d,诊断新生儿高胆红素血症(重度)、尿路感染、肝损害,予“头孢他啶”抗感染,“阿拓莫兰”保肝,蓝光退黄,在血培养报告后,于入院第4天根据药敏改予“阿莫西林克拉维酸钾”抗感染治疗,于入院治疗10 d后病情好转出院。1例出生1 d,胎龄31+6周,诊断肺炎、早产儿、低出生体重儿、呼吸暂停,高胆红素血症、结膜炎、新生儿感染,予吸氧,“头孢地嗪”一天后改“头孢哌酮舒巴坦”加强抗感染,“氨茶碱”兴奋呼吸,蓝光退黄,入院时血培养阴性,治疗后体重增长良好,病情好转,但治疗25 d时出现院内感染(发热、吃奶减少,脉氧波动),予复查血培养,复查CRP明显上升至19mg/L,改“美平”抗感染2 d,“丙种球蛋白”支持,“大扶康”预防真菌感染,次日再复查CRP进一步上升至69mg/L,且体温反复,予转院,转院后血培养报告大肠埃希菌。
本组血培养病原微生物为表皮葡萄球菌的患儿中5例病情危重。(1例出生8 d,诊断肺炎、中枢感染经“头孢他啶、氧哌嗪青霉素”抗感染,解包散热,体温下降正常,于入院治疗19 h后家属要求自动出院。1例出生27 d,诊断肺炎、高胆红素血症、化脓性脑膜炎,予“头孢哌酮舒巴坦”4 d后仍体温反复,予腰穿诊断“化脓性脑膜炎”,并改“美平”抗感染,入院治疗7天复查脑脊液白细胞下降,体温正常3 d,病情好转,家属要求转院。1例出生5 d,诊断高胆红素血症、肝损害、心肌损害,予“美平”抗感染、“美能”保肝对症,后出现皮肤花纹、面色苍白、腹胀明显,警惕感染性休克,于入院治疗21 h后予转院。1例出生3 d,诊断肺炎、感染性休克、低血糖、脑损害、蛛网膜下腔出血、肠道感染,经吸氧、“生理盐水”扩容,“碳酸氢钠”纠酸,调高补液滴速,“丙球”支持,“苯巴比妥”止惊厥,“甘露醇”降低颅内压,“美平”抗感染4 d后改“头孢地嗪”抗感染,治疗11 d病情好转出院。1例出生25 d,诊断肺炎、鹅口疮、心肌损害、尿路感染,经“制霉菌素”涂口腔,“头孢地嗪”5 d后改“头孢哌酮舒巴坦”抗感染5 d,治疗10 d后病情好转出院。1例出生3 d,诊断高胆红素血症,结膜炎,予“左氧氟沙星滴眼液”滴眼,蓝光退黄后好转,入院3 d血培养报告后加“头孢哌酮舒巴坦”抗感染6 d,病程第8天出现院内感染,高热,复查血象及CRP正常,病程第10天仍发热,改予“美平”抗感染,家属拒绝腰穿要求转院,在上级医院确诊“化脓性脑膜炎”。
本组血培养病原微生物为铜绿假单胞菌的患儿1例,出生26 d,诊断弥散性血管内凝血(DIC)、肾功能衰竭、颅内出血,消化道出血,肺出血,维生素K1缺乏可能,肺炎、早产儿、低出生体重儿,患儿白细胞1.1×109/L,血小板5×109/L,经吸氧,“头孢哌酮舒巴坦”抗感染、“丙球”支持,“纳洛酮”改善呼吸,“氨茶碱”兴奋呼吸,“血浆”补充凝血因子支持,“速尿”利尿,气管插管呼吸机机械呼吸等治疗后脉氧心率下降,入院第2天家属放弃治疗自动出院。
本组血培养病原微生物为粪肠球菌的患儿1例,出生30min,诊断感染性肺炎、呼吸窘迫综合征、呼吸衰竭、坏死性肠炎、酸中毒,经气管插管呼吸机机械呼吸,胃肠减压,纠酸对症,“头孢他啶”抗感染3 d后复查白细胞3.6×109/L,改“美平”抗感染,治疗5 d后脱管,气促好转,脉氧稳定,改头罩吸氧,仍稍气促,予转院。
本组有1例血培养病原微生物为双重菌株感染(检出鲍曼不动杆菌和缓症链球菌 )的患儿1例,出生30min,诊断新生儿窒息、肺炎、低血糖、早产儿、心肌损害、高胆红素血症,予吸氧,蓝光退黄,“头孢地嗪”抗感染7 d后根据血培养报告,予改“头孢哌酮舒巴坦”5 d好转出院。
2.5 血培养病原微生物构成情况 95例血培养标本共培养出96株细菌(其中1例为双重菌株生长) ,革兰阳性菌 87株,占检出病原菌的90.6%,其中凝固酶阴性葡萄球菌(CoNS)79株(82.3%)(表皮葡萄球菌60株,人葡萄球菌亚种6株,溶血葡萄球菌5株,华纳氏葡萄球菌3株,头状葡萄球菌3株,松鼠葡萄球菌1株,孔氏葡萄球菌孔氏亚种1株),共检出耐甲氧西林凝固酶阴性葡萄球菌(MRCN)52株(54.2%);凝固酶阳性葡萄球菌3株(3.1%),共检出耐甲氧西林金黄色葡萄球菌(MRSA)1 株(1.0%)。革兰阴性菌9株,占检出病原菌的9.4%,其中大肠埃希菌居首位共5株,占检出病原菌的5.2%。见表1。
2.6 药敏结果 革兰阳性菌87株,对红霉素耐药70株(80.5%),青霉素耐药的69株(79.3%),对苯唑青霉素耐药52株(59.8%)、对氨苄青霉素耐药68株(78.2%)、对阿莫西林/棒酸耐药47株(54%) ,对头孢唑林耐药35株(40%)、对亚胺培南耐药34株(39.1%),对克林霉素耐药25株(28.7%),对头孢曲松耐药16株(18.4%),对万古霉素耐药0株(0)。见表2,表3。
革兰阴性菌9株,对氨苄青霉素耐药5株(55.6%)、对氧哌嗪青霉素耐药5株(55.6%),对阿莫西林/棒酸耐药2株(22.2%) 、对头孢唑林耐药4株(44.4%),对头孢西丁耐药2株(22.2%),对头孢曲松耐药4株(44.4%),对头孢他啶耐药3株(33.3%) ,对头孢噻肟耐药4株(44.4%),对亚胺培南耐药的0株(0)。见表4。
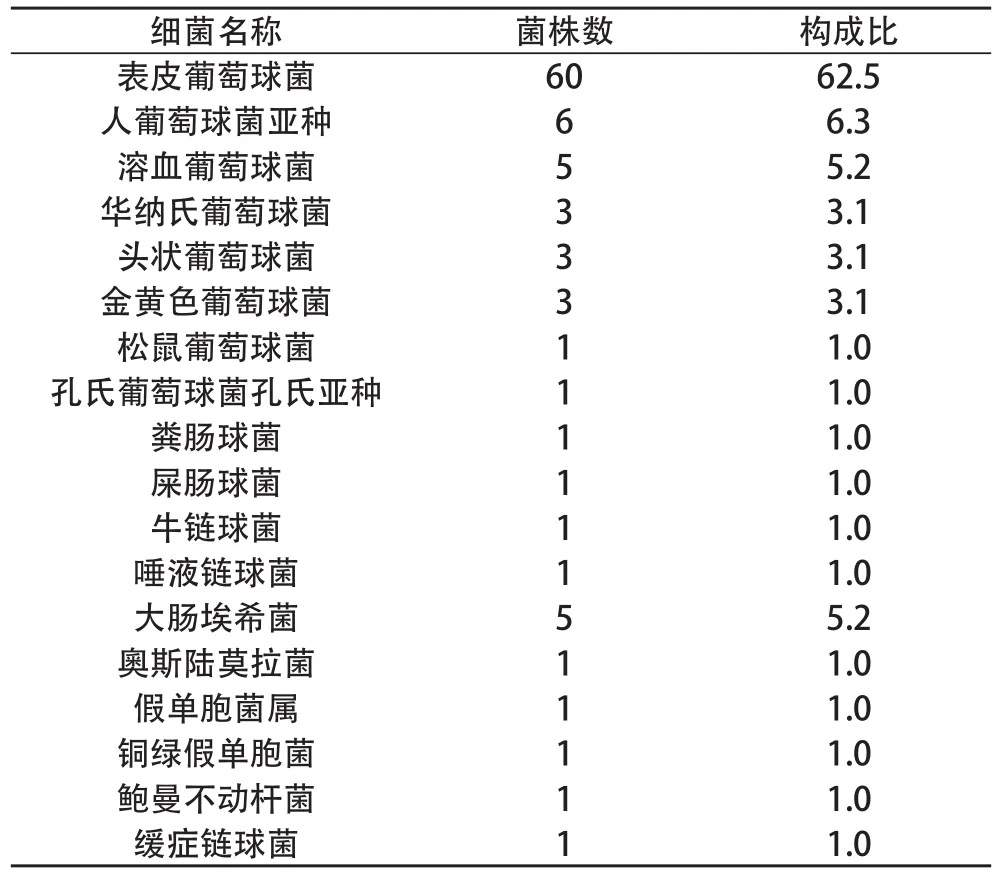
表1 95例新生儿败血症血培养病原菌菌种18种96株分布及构成比(n,%)
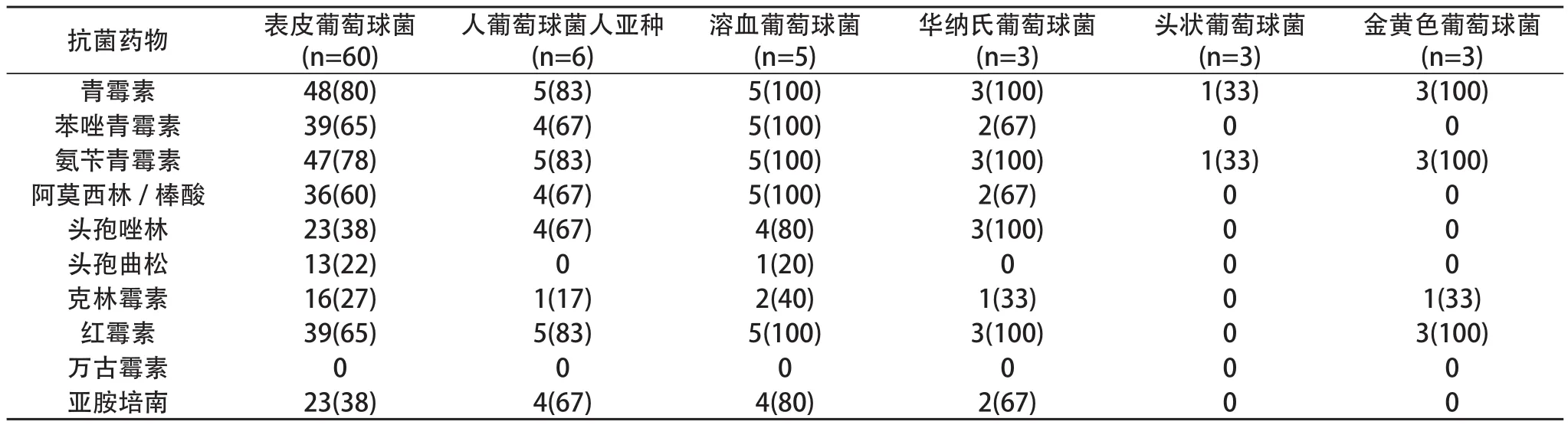
表2 数量多的G+致病菌耐药情况及构成 [n(%)]
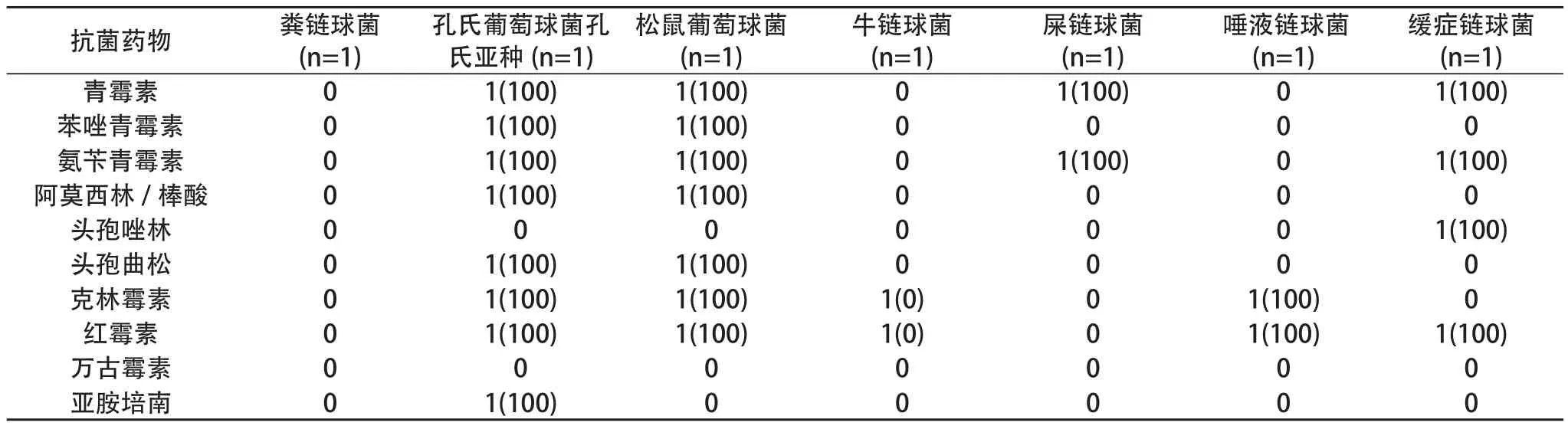
表3 数量少的G+致病菌耐药情况及构成[n(%)]
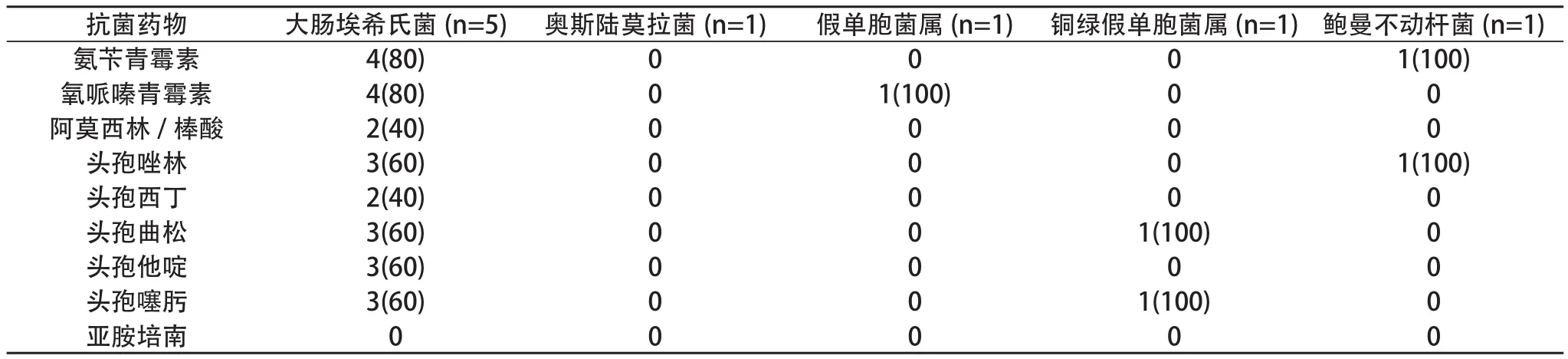
表4 G-致病菌耐药情况及构成比 [n(%)]
3 讨论
国外有研究报道,发展中国家住院新生儿败血症的发生率为2.1%~17.0%[3]本组新生儿败血症发生率为2.05%。近年来,国内外资料显示,CoNS已成为新生儿血培养的首位菌[4]。本组资料显示本院近4 年新生儿败血症主要病原菌是CoNS,占82.3%,与本科前期报道的一致[5]。其他依次为人葡萄球菌亚种、溶血葡萄球菌,革兰阴性菌败血症为9.4%,其中大肠埃希菌仍占重要地位。
本组新生儿败血症根据药敏结果,革兰阳性菌87株中,对红霉素、青霉素、苯唑青霉素、氨苄青霉素、阿莫西林/棒酸耐药性高,耐药率均>50%,革兰阴性菌9株中,对氨苄青霉素、氧哌嗪青霉素耐药性高,耐药率均>50%,故红霉素及青霉素类已不宜作为新生儿败血症的首选药物;革兰阳性菌87株中,对头孢唑林、亚胺培南、头孢曲松、克林霉素敏感性高,耐药率较低(18.4%~40.0%),革兰阴性菌9株中,对阿莫西林/棒酸、头孢菌素敏感性高,耐药率较低(22.2%~44.4%),提示头孢菌素仍是新生儿败血症重要的选择药物。本组资料革兰阳性菌对万古霉素全部敏感,但国内已报道新生儿败血症耐万古霉素病原菌株[6]。本组资料革兰阴性菌对亚胺培南全部敏感。
本组检出耐药菌株MRCN、MRSA菌共53 例,占55.8%,MRSA感染的治疗是临床十分棘手的难题之一,关键是其对许多抗生素有多重耐药。因其耐药机制是青霉素结合蛋白(PBPs)性质的改变,因此,MRSA几乎对所有的β-内酰胺类抗生素耐药,本组资料显示MRCN、MRSA菌对万古霉素敏感。
本组资料中,王丽芳等报道[5]总结的本地区菌种流行病学特点和耐药菌情况,及早、足疗程、静脉使用抗生素,新生儿败血症经积极治疗,好转率高达90.5%(86例)。但本组资料显示近4年本院新生儿败血症危重病例数多(13.7%),并发症多(呼吸系统、消化系统、神经系统为常见并发症),起病隐匿,部分患儿有呼吸增快或暂停、反应差、发热、呕吐、吃奶少,哭声低、黄疸等非特异性表现,病情进展迅速,故分析其临床特点有重要意义,应引起高度重视,需重点观察心率、呼吸、神志反应、末梢循环、血压、尿量等,正确认识和积极干预治疗并发症,降低死亡率[6]。本组资料显示,新生儿败血症的临床症状因病原菌不同而有较大差异,所有大肠埃希菌感染、少部分表皮葡萄糖球菌感染、1例铜绿假单胞感染、1例粪肠球菌感染、1例血培养病原微生物为双重菌株感染(检出鲍曼不动杆菌和缓症链球菌 )所致败血症的患儿的全身症状较为严重,提醒临床医师对新生儿出现全身中毒症状者要考虑大肠埃希菌致病菌所致败血症的可能性。
白细胞和CRP是反应感染状况的传统指标,败血症时其升高越明显,往往提示感染程度越重,对败血症的诊断有一定的价值。近年来研究发现,败血症是导致血小板减少的明确危险因素,发生率为49.1%,且新生儿败血症的严重性与血小板之间存在负相关[7,8]。本资料中的13例严重病例中,有1例是血小板明显减少同时CRP明显升高,1例为CRP明显升高,1例为白细胞及血小板明显减少,故提示在病程中需及时复查血常规及CRP了解病情变化。
综上所述,新生儿败血症为新生儿时期较常见的感染性疾病,病死率高,积极抗感染治疗同时应加强支持和对症治疗,积极治疗原发病和合并症,从而提高治愈率,降低病死率。
[1]中华医学会儿科学分会新生儿学组.新生儿败血症诊疗方案.中华儿科杂志,2003,41(12):897-899.
[2]胡继红,高振翔,尹铭芳.美国NCCLS 2002年版抗生素药敏试验操作标准更新内容.中华检验医学杂志,2002,25(6):367-369.
[3]Satar M,Oz lü F.Neonatal sepsis: a continuing disease burden.Turk J Pediatr,2012,54(5):449-457.
[4]胡红兵,杨劳荣,夏维,等.凝固酶阴性葡萄球菌致新生儿败血症的病原学及体外耐药监测.中华医院感染学杂志,2006,16(2):227-228.
[5]王丽芳,杨剑虹.新生儿败血症的病原菌分布及耐药性分析.中国实用医药,2010,5(1):127-129.
[6]刘玲,王春香.新生儿败血症的细菌分布和耐药率分析.中华医院感染学杂志,2006,16(5): 582.
[7]姚明珠,郭佳林,胡勇.血小板动态监测在新生儿败血症中的临床价值.中国新生儿科杂志,2009,24(5):305-306.
[8]焦建成,余加林.血小板计数与新生儿败血症预后关系分析.重庆医学,2010,39(15):1970-1972.
10.14164/j.cnki.cn11-5581/r.2016.11.115
2016-03-07]
215400 江苏省苏州大学附属太仓市第一人民医院儿科
