超氧化物歧化酶的研究进展
2016-03-02袁牧王昌留王一斐徐贵华韩潇
袁牧,王昌留,王一斐,徐贵华,韩潇
(鲁东大学生命科学学院,烟台 264025)
超氧化物歧化酶的研究进展
袁牧,王昌留*,王一斐,徐贵华,韩潇
(鲁东大学生命科学学院,烟台 264025)
超氧化物歧化酶(superoxide dismutase,SOD)是抗氧化酶类的重要成员,是生物体有效清除活性氧的主要酶类之一,是抗氧化系统的第一道防线,在需氧生物普遍存在,多位于生物体细胞的细胞质、线粒体以及叶绿体中。本文从SOD的发现、分类与分布、作用机理、分子结构与功能、起源与进化及应用等方面综述SOD的研究进展,并对SOD的进一步研究进行展望。
超氧化物歧化酶;活性氧;抗氧化剂
有氧代谢是需氧生物体正常生命活动不可或缺的,它经常会伴有活性氧(reactive oxygen species,ROS)的产生。活性氧在机体中有双重作用,生物体内活性氧的含量通常处于平衡状态。但当生物机体处于逆境条件时,生物体内的活性氧如不能及时清除将会大量累积而对机体产生一定的伤害,如水生生物在受到环境胁迫时会产生过量的活性氧导致氧化应激加剧[1]。需氧生物有着发达的氧化防御系统以抵御氧化应激[2],超氧化物歧化酶(superoxide dismutase,SOD)便是该系统中的抗氧化物酶之一,它能够清除生物氧化过程中的超氧阴离子自由基(superoxide anion,O-2),被认为是抗氧化系统的第一道防线,在需氧生物普遍存在。
1 SOD的起源、分类与分布
当生命第一次在地球上出现时,氧化还原矿物金属几乎完全以还原态存在,大气层主要由CO2和水蒸气及少量的N2、H2、CH4,O2含量极少,大约是现在的10-5[3]。20~24亿年前,与蓝藻光合作用密切相关的大氧化事件改变了大气和地球的表面成分,O2的急剧增加使得大量的早期生命 (生物)灭绝,少量的靠隐藏在低氧环境或能产生抵御O2侵袭的生物得以幸存,从而产生了SOD。该酶广泛存在于各种生物体内,根据其结合的金属离子的种类不同,SOD可分为3种主要类型[4],现多认为至少分为4类,即含Cu、Zn的Cu/Zn-SOD,仅含Mn的Mn-SOD和仅含Fe的Fe-SOD以及仅含Ni的Ni-SOD[5-7],它们的分布与胞质定位 (表1),下面对这4类不同的SOD进行逐一介绍。
1.1 Cu/Zn-SOD
Cu/Zn-SOD因其重要的生理功能和巨大的治疗潜能,被认为是超氧化物歧化酶家族最重要的一类酶[8,9],也是清除自由基最重要的成员之一[10]。它有两种基本类型,分别由两个不同的基因编码[11]成一个在N端含有外导向区域的胞外型Cu/Zn-SOD(ecCu/Zn-SOD,sod3基因编码)和不含外导向的胞质型Cu/Zn-SOD(icCu/Zn-SOD,sod1基因编码)[12]。Cu/Zn-SOD产生的初始阶段进化异常缓慢,最近一亿年进化较快[13]。基于Cu/Zn-SOD基因序列比对和蛋白晶体结构解析,Bordo等[14]认为在真菌、植物和后生动物分化之前,ecCu/Zn-SOD就偏离了icCu/Zn-SOD进化方向。而哺乳动物ec-Cu/Zn-SOD的基因与真菌的Cu/Zn-SOD基因序列更接近,这表明ecCu/Zn-SOD可能比icCu/Zn-SOD更为古老[15]。

表1 SOD的分布及胞质定位Tab.1 Distribution and cytop lasm ic localization of SOD
icCu/Zn-SOD是发现最早、也是存在最广泛的真核生物SOD,主要分布于真核生物的细胞质、植物的叶绿体基质和过氧化物酶体以及线粒体的膜间隙[16];而ecCu/Zn-SOD则主要定位在细胞表面和细胞质基质及人的细胞核内,它是在动物血浆中被发现的,目前仅在部分哺乳动物体内确认有其存在[17]。
1.2 Mn-SOD
Mn-SOD是需氧生物生存必不可缺的一种SOD[18,19]。现在很多物种的Mn-SOD氨基酸序列已被破译,对Mn-SOD氨基酸序列进行聚类分析发现放线菌的Mn-SOD与真核生物线粒体及古细菌Mn-SOD亲缘关系较近,而与其他细菌较远[13]。编码线粒体Mn-SOD的基因虽然位于核内,但可以通过其翻译的N端转运肽输入到线粒体内,因此多数学者现在认为线粒体Mn-SOD的基因源于宿主细胞的古细菌,而不是演变为线粒体的细菌[6,20]。
1969年McCord和Fridovich发现红细胞铜蛋白具有超氧化物歧化酶活性不久,Keele等在E.Coli中就获得了Mn-SOD[21],后来许多学者相继在不同生物类群得到了Mn-SOD的二聚体和四聚体。原核生物的Mn-SOD位于细胞质,真核生物的Mn-SOD多位于线粒体,但在植物的过氧化物酶体及某些单细胞藻类的叶绿体也发现含有Mn-SOD[15,22]。现在习惯上将Mn-SOD分为两类:一类是胞质Mn-SOD(cytMn-SOD),另一类是线粒体Mn-SOD(mtMn-SOD,sod2基因编码)位于线粒体内[23]。mtMn-SOD的存在比较广泛[24],但cytMn-SOD迄今为止只在甲壳类动物和真菌中发现[25,26]。
1.3 Fe-SOD
Fe-SOD由Yost等[27]1973年在大肠杆菌首次发现,后来证实该酶存在于多种不同生物类群。植物和蓝藻有相似的Fe-SOD基因保守区,但非光合细菌缺乏这些基因保守区[28],这表明Fe-SOD基因来自于蓝藻经内共生演化转移到核基因组,蓝藻则成为叶绿体[29]。
Fe-SOD的分布非常广泛,在古细菌、专性厌氧菌、兼性需氧菌、有氧固氮菌、蓝藻、原生动物及藻类和高等植物的叶绿体内甚或部分生物的细胞核都发现了该酶[30,31]。
1.4 Ni-SOD
Ni-SOD的发现较晚,1996年Youn等[5,32]在灰色链霉菌中首次获得该酶。Priya等[33]分析了60多种蓝藻的SOD,发现Ni-SOD仅在低等种类出现,可见Ni-SOD的基因进化较为缓慢。现认为该酶主要存在于蓝藻、绿藻、链霉菌等的细胞质中[6],是海洋生物较常见的一种SOD。
2 SOD的功能与作用机理
SOD是自然界最有效的防御氧化侵袭的抗氧化剂之一。对于植物,低温环境是影响其生长的重要因素,有的学者认为,低温会使植物体内的活性氧过度积累,甚至最后会导致细胞的衰老和死亡。而SOD就是植物为了减轻体内活性氧过度积累的第一道防线[34],并且在干旱胁迫中扮演者重要的角色:已有研究表明,耐旱的植物拥有更高的SOD活性,因此,较高的SOD活性可以被视为一个抗旱的指标。不同物种对干旱胁迫的响应是不同,主要表现为SOD的活性变化趋势,但SOD的表达很大程度上依赖于物种的基因型[35]。对于动物,SOD在消除活性氧的毒性中发挥了重要作用,并参与由病毒感染[36]和细菌引起的免疫反应[37]。对于人类,适当增加SOD可有助于防止疾病产生和延长寿命[38],而SOD水平的降低会在人类身上出现大量的退化性疾病,其中包括纤维组织肌痛、糖尿病、癌症、多发性硬化症、阿尔茨海默氏症和帕金森氏症等[39,40]。
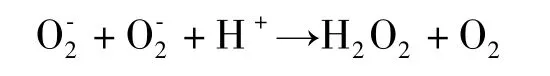
对于SOD而言,其催化反应的速度与底物的乘积成正比,是一种典型的二级反应,它通过降低氧化活性部位金属离子的活性,以两步快速的反应使O转变为H2O2和O

这里的M表示SOD的金属离子,M3+是金属离子被氧化以后的最高价位,这种逐步反应机制从反应动力学来说,有3个优点[42]:首先,一个分子反应能避免两个分子同时反应时金属离子相互之间产生的静电排斥作用;其次,位于活性位点上的金属离子所携带的电荷可以被一个质子吸收保存,这样就能使该歧化反应的产物为中性不带电的,不会产生相互约束的静电作用;第三,第一步反应所释放的能量能被第二步反应利用使超氧阴离子 (O)还原,然后H2O2再被过氧化氢酶还原形成H2O。从反应式上来看,H2O2量太多的话,便能够抑制超氧化物歧化酶的活性,而且H2O2能够改变酶的构象,影响酶活力。另外,H2O2还能够反应转化为OH-,使酶蛋白变性以及其核酸发生突变,从而降低酶的活性。
2.1 Cu/Zn-SOD
Cu/Zn-SOD在生物体内含量最多,因此较其他3种SOD来说是生物体抗氧化作用的主要执行者。自1995年Orrell等[43]发现Cu/ZnSOD(严格说现应称之为icCu/Zn-SOD)的突变可导致肌萎缩性侧索硬化症(ALS)的产生以来,许多学者开始致力于Cu/Zn-SOD的基因编码区突变及功能影响研究,现在超过70个突变位点的150多种sod1已被报道,且多数突变发生于sod1的第5外显子区段。无论是野生型还是ALS突变的Cu/ZnSOD,如果缺锌都会导致一氧化氮依赖的神经细胞凋亡,但通过补锌可阻止该过程的发生[44]。有学者证实敲除sod1的小鼠患有生理障碍如雌性生育能力降低、黄斑变性甚或死于肝脏肿瘤[16,45]。1998年Ookawara等[46]发现ecCu/Zn-SOD在正常的肺组织、血管、呼吸道、肾脏、子宫、心脏的表达明显高于其他SOD,因而提出ecCu/Zn-SOD不仅可作为一种抗氧化剂,而且还能作为信号传播的一个控制器。另外,Mruk等[47]观察到大鼠睾丸中ecCu/Zn-SOD的mRNA水平在不同发育时期呈现明显不同,在20至60天时会大幅增加。后来Zelko在研究小鼠胎儿的ecCu/Zn-SOD时也发现直到妊娠后期,才能检测到小鼠胎儿ecCu/Zn-SOD的mRNA表达[48],Adachi等[49]发现在人类中,儿童的ecCu/Zn-SOD表达明显高于成人并以每年2%递减,到20岁时达到平台期。这说明ecCu/Zn-SOD限于特定组织和器官的阶段性特异性表达可能与启动子甲基化和组蛋白乙酰化的表观遗传因子相关[50]。新近Kim[51]等发现ecCu/Zn-SOD的抗血管生成和抗炎作用是其通过抑制缺氧诱导因子1α(HIF-1α)和蛋白激酶C(PKC)活性及下调NF-κB的表达;另外,Kwon等[52]也证明ecCu/Zn-SOD可通过阻止免疫细胞浸润和抑制白细胞与血管内皮细胞粘着参与免疫应答,从而证实了Ookawara等提出的ecCu/Zn-SOD参与信号传导的作用。现认为ecCu/Zn-SOD是一氧化氮(NO)在血管壁、心脏、肺、肾和胎盘等行使生理功能的主要调控者,且它的表达及其催化活性的改变还会涉及多种相关疾病如心血管、神经系统和肺部疾病等[53],并且通过基因敲除和转基因越来越多的研究结果还揭示ecCu/Zn-SOD与衰老、高血压、糖尿病、细胞凋亡、细胞增生及抑癌等相关[54-57]。
2.2 Mn-SOD
尽管Mn-SOD在组织中的含量仅为Cu/Zn-SOD的一半,但它对需氧生物的生存和抵御活性氧产生的毒性却至关重要,它是有氧环境下生物体生命活动SOD家族成员中唯一不可缺少的酶[58],现在许多研究结果证实Mn-SOD在促进细胞分化和肿瘤发生及防止高氧诱导的肺损伤有重要的作用,Mn-SOD的生物学功能涉及能量代谢、细胞周期调控以及正常和增生组织细胞的增殖与凋亡。早在1931年Hopkins就发现锰是一种生物体正常生长所需的重要微量元素[59],是一种许多酶(如Mn-SOD)必需的辅助因子。1989年Galeotti等[60]用荷瘤近交系大鼠的正常组织为材料进行肝癌细胞的分化研究发现肝癌的产生与Mn-SOD的表达有关,是由转录活性下降引起的。后来更多的学者用基因敲除和修饰的方法对Mn-SOD的生理功能进行了广泛研究,如Mn-SOD基因缺失的小鼠因扩张型心肌病和神经退化出生后不久就很快死亡[61],即使杂合的敲除Mn-SOD基因后的小鼠也能观察到其严重缺陷和对有氧环境的敏感[62]。Sutton等[63]发现人类Mn-SOD基因线粒体靶向序列(MTS)中的缬氨酸(GTT)替换为丙氨酸(GCT)时,后者Mn-SOD酶的活性较前者高30%~40%,可有助于降低某些癌症的发生和缓解神经退行性疾病和严重的酒精性肝病,这与Zhang等[64]观察到的Mn-SOD的第58氨基酸突变为Ile酶活升高从而抑制人的乳腺癌细胞株MCF-7生长的结果相一致。上述结果表明,Mn-SOD能够抑制肿瘤的产生并具有提高癌症治疗成功率的作用[35]。
2.3 Fe-SOD
由于在原核生物尤其是低等的原核生物少有Mn-SOD和Cu/Zn-SOD,因此Fe-SOD在原核生物的抗氧化系统中占有重要的地位,它是某些细菌生存所必需的,且还能通过减少O-2与NO的相互作用保护细菌免受过氧亚硝基阴离子(ONOO-)的毒性[65];Priya等[66]发现蓝藻(Synechococcu elongates PCC 7942)只含有Fe-SOD,由2个基因编码,对蓝藻的正常光合作用及干燥、冷却、氮饥饿等环境胁迫都有一定的保护作用,敲除其中之一并不影响蓝藻光合自养的增长,但如果这2个基因双突变则是致死性的,后来Ke等[67]用蓝藻(Synechocystissp.PCC 6803和Synechococcus sp.CC9311)也证实了该结果。对高等植物叶绿体内Fe-SOD的功能研究的报道较多:Zhang等[68]以烟草为材料借助RNA干扰技术降低叶绿素Fe-SOD的表达发现Fe-SOD在维持PSII复合体的稳定性及O-2引起的PSII光损伤和D1降解有重要作用;Myouga等[69]则发现叶绿体Fe-SOD基因的突变或缺失会使拟南芥生长不佳,表型矮小苍白,叶绿体发育异常;而增加Fe-SOD的表达可以保护甲基紫罗碱处理的拟南芥原生质膜和PSII对超氧化物自由基的抗性[70],这一现象已在烟草、玉米等被证实。另外,许多学者还发现转基因烟草、转基因玉米叶绿体内Fe-SOD的过表达还能提升光照或黑暗状态下对冷袭的耐受[71,72]。
2.4 Ni-SOD
含有Ni-SOD的生物种类不多,它们多生活在海洋里,有关Ni-SOD的报道大多是以研究基因序列、酶的催化活性为主[6],除能够专一清除O-2外,其他功能方面的研究远较另外几种SOD为少。Kim等[73]发现天蓝色链霉菌的Ni-SOD表达与其生活环境如生长介质、金属或螯合剂的浓度等相关,当环境没有镍时天蓝色链霉菌不能表达Ni-SOD,但其Fe/Zn-SOD的表达增加可以弥补Ni-SOD的损失,这表明Fe/Zn-SOD能替代NiSOD的作用。后来Kim等[74]发现Ni能抑制汉城链霉菌Fe-SOD的表达,促进Ni-SOD的表达。近来Schmidt等[75]研究酸疮痂链霉菌时发现Ni和其他一些重金属都可促进Ni-SOD的表达,用以提高生物体对重金属的耐受能力。这些报道说明对于链霉菌Ni-SOD和Fe-SOD的功能是一致的,其表达受环境影响较大。
3 SOD的应用
机体在正常情况下产生的超氧阴离子自由基是维持生命活动所必需的,正常健康机体内自由基的形成和清除处于一种动态平衡中,所以保持体内适量的SOD是维护健康和延缓衰老及缓解呼吸、代谢、心血管疾病的有效途径[76]。在20世纪90年代,SOD制剂被引入市场,作为生物体内重要的抗氧化酶,在医药、食品、化妆品等领域应用也较为广泛[77]。
3.1 在医药中的应用
SOD能很好地清除O-2自由基,在抗衰老和疾病治疗中具有十分重要的作用,据报道口服SOD后,SOD能够在肠道中降解为一些可以有助于治疗疾病的小分子,并通过荧光标记试验在血液中检测出来[78]。另外,有学者认为,SOD被降解后形成的一些小的肽段能够穿过细胞膜,并且这些小的肽段具有部分SOD的功能,并证实:胃酸的pH在~2.5左右,SOD经过胃部酸解和酶解的作用之后,大约会用50%的SOD以活性的形式保存下来[79],这就为SOD的吸收利用提供了前提条件。Pastorini等[80]用SOD治疗帕荣雷氏病 (阴茎海绵体硬结),发现服用了SOD的90名患者大部分性功能都有所恢复且疼痛感消失。Bernier等[81]在研究大鼠的心室纤维性颤动时发现口服SOD后颤动的发生率由对照组的87%下降到27%。Okada等[82]证实给荷瘤小鼠口服SOD能阻止肿瘤发展,Fe-SOD与Nut-lin-3(P53激动剂)联合应用,可靶向治疗癌细胞,并能减少对正常细胞的损伤[83]。另外SOD也是一种新型的抗炎症药物,SOD对骨关节炎、退行性关节炎、类风湿关节炎以及颞颌关节机能障碍等均有良好的疗效,用SOD漱口剂可以治疗牙龈炎、牙周炎、口腔溃疡等[84-86]。
3.2 在食品中的应用
SOD在食品工业的应用也十分普遍,目前已经开发出了很多富含SOD的食品,如绿茶饮料,具有预防龋齿、敏感症、痛风、降压等功效;番木瓜酒作为一种天然绿色的低度果露酒,可以促进消化,治疗慢性胃炎,舒展血管等[87]。Carillon等[88]研究发现,添加SOD的浓缩甜瓜汁不仅具有良好的抗氧化活性,还表现出血管紧张素Ⅰ转化酶抑制剂活性,对高血压具有潜在的预防作用。它们营养丰富,可以增强人们抗衰老,抗疲劳等能力,具有保健的作用,市场效益不错,发展前景良好。另外,SOD还可以作为水果、蔬菜等的保鲜剂,应用于罐头食品、果汁、啤酒等的保藏。
3.3 在化妆品中的应用
SOD被国际生化委员会、美国联邦食品管理局誉为 “抗衰因子”和 “美容娇子”,是化妆品的重要添加剂,具有明显的防晒、抗炎效果并能防止皮肤衰老、祛斑、抗皱及防治皮肤瘢痕形成等作用[89,90]。化妆品领域中的SOD应用研究远比食品领域的研究成熟,且不像药物那样存在严格的安全性要求,是目前SOD市场最主要的需求,其需求量占全球需求量的50%以上[91]。现在国内外不少高级化妆品中都添加有SOD,可制成面膜、乳液、霜剂等多种形式。
4 展望
自SOD发现以来,其相关的研究一直是生物化学界的热门,多种生物的SOD基因序列、催化机制、酶活、功能及表达都有很多报道,但涉及SOD的转录控制、表观遗传调控和转录后修饰对SOD功能影响的研究还不够深入,特别是miRNA对SOD的转录调控更是鲜有报道[53]。另外,每个不同类型的SOD除受普通转录因子影响外,都有其自己独特的调控机制,而SOD家族成员之间是如何协调表达各自发挥其作用的现在了解的还很少。由于环境的污染,食品和饮用水等中的自由基含量都会大大增加,SOD作为生物体内重要的自由基清除剂,可避免机体内浓度过高引起的不良反应或损伤[92]。然而酶在治疗应用中的表现并未达到人们的预期目标,它的非药物应用包括化妆品、食品、农业、化工行业,药物应用仅限于动物[7]。究其原因,一是SOD的产率和稳定性,二是在胃肠道吸收较差和快速降解,三是静脉注射寿命极短。令人欣慰的是随着耐热的适应pH范围广的SOD发现或其突变体的获得,如土芽孢杆菌(Geobacillus sp.EPT3)Mn-SOD在90℃处理1h其酶活仍能保持57%,且该酶在pH5.0-11.0都很稳定[93];Li等[94]从嗜热栖热菌(Thermusthermophilus)获得的2种Fe-SOD突变体,其中His171Ala突变体在70℃处理1h,其酶活仍能保持51%,且该酶在pH5.0-10.0酶活仍保持80%以上。为了解决SOD吸收差和口服及注射的降解问题,许多学者尝试用脂质和蛋白质进行了SOD封装研究,现在认为用小麦醇溶蛋白封装SOD是比较有效的途径[95]。也有许多学者进行了人工SOD模酶的合成,由于模拟比天然酶分子量低、更稳定和更长的半衰期,且更容易渗透到细胞及不会引发免疫反应,现已成为SOD应用研究热点并取得了很好的效果[30]。随着现代生物技术的快速发展,用基因工程技术生产SOD,探索不同物种SOD差异性和遗传信息,深入研究各种SOD在细胞发育不同阶段发挥的作用,将为进一步加快SOD模拟酶的开发,为SOD的真正应用提供更加广阔的前景。
[1]Valavanidis A,Vlahogianni T,Dassenakis M,etal.Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants.Ecotoxicol Environ Saf,2006,64(2):178-189.
[2]Kim BM,Rhee JS,Park GS,et al.Cu/Zn-and Mn-superoxide dismutase(SOD)from the copepod Tigriopus japonicus:molecular cloning and expression in response to environmental pollutants.Chemosphere,2011,84(10):1467-1475.
[3]Holland HD.The oxygenation of the atmosphere and oceans.Philos Trans R Soc Lond B Biol Sci,2006,361(1470):903-915.
[4]Fridovich I.Superoxide dismutases.Prog Nucleic Acid Res Mol Biol,1991,40(10):221-253.
[5]Youn HD,Kim EJ,Roe JH,et al.A novel nickel-containing superoxide dismutase from Streptomycesspp.Biochem J,1996,318(3):889-896.
[6]Sheng Y,Abreu IA,Cabelli DE,et al.Superoxide dismutasesand superoxide reductases.Chem Rev,2014,114(7):3854-3918.
[7]Zeinali F,Homaei A,Kamrani E.Sources ofmarine superoxide dismutases:Characteristics and applications.Int JBiol Macromol,2015,79:627-637.
[8]Lefaix JL,Delanian S,Leplat JJ,et al.Successful treatment of radiation-induced fibrosis using Cu/Zn-SOD and Mn-SOD:an experimental study.Int J Radiat Oncol Biol Phys,1996,35(2):305-312.
[9]Kogawa K,Muramatsu H,Tanaka M,etal.Enhanced inhibition of experimentalmetastasis by the combination chemotherapy of Cu-Zn SOD and adriamycin.Clin Exp Metastasis,1999,17(3):239-244.
[10]Halliwell B,Jmc G.Oxygen toxicity,oxygen radicals,transition metals and disease.Biochem J,1984,219(1):1-14.
[11]Li C,Sun H,Chen A,et al.Identification and characterization of an intracellular Cu,Zn-superoxide dismutase(ic-Cu/Zn-SOD)gene from clam Venerupis philippinarum. Fish Shellfish Immunol,2010,28(3):499-503.
[12]Abreu IA,Cabelli DE.Superoxide dismutases-a review of the metal-associated mechanistic variations.Biochim Biophys Acta,2010,1804(2):263-274.
[13]Smith MW,Doolittle RF.A comparison of evolutionary rates of the twomajor kinds of superoxide dismutase.JMol Evol,1992,34(2):175-184.
[14]Bordo D,Djinovic K,Bolognesi M.Conserved patterns in the Cu,Zn superoxide dismutase family.JMol Biol,1994,238(3):366-386.
[15]Miller AF.Superoxide dismutases:ancient enzymes and new insights.FEBSLett,2012,586(5):585-595.
[16]Valentine JS,Doucette PA,Potter SZ.Copper-zinc superoxide dismutase and amyotrophic lateral sclerosis.Annu Rev Biochem,2005,74:563-593.
[17]Oury TD,Crapo JZ,Enghild JJ.Human extracellular superoxide dismutase is a tetramer composed of two disulphide-linked dimers-a simplified,high-yield purification of extracellular superoxide dismutase.Biochem J,1996,317(Pt1):51-57.
[18]Carlioz A,Touati D.Isolation of superoxide dismutasemutants in Escherichia coli:is superoxide dismutase necessary for aerobic life?EMBO J,1986,5(3):623-630.
[19]Cho YS,Lee SY,Bang IC,etal.Genomic organization and mRNA expression ofmanganese superoxide dismutase(Mn-SOD)from Hemibarbusmylodon(Teleostei,Cypriniformes).Fish Shellfish Immunol,2009,27(4):571-576.
[20]Martin W,Hoffmeister M,Rotte C,et al.An overview of endosymbiotic models for the origins of eukaryotes,their ATP-producing organelles(mitochondria and hydrogenosomes),and their heterotrophic lifestyle.Biol Chem,2005, 382(11):1521-1539.
[21]Keele B,McCord JM,Fridovich I.Superoxide dismutase from Escherichia coli B.A new manganese-containing enzyme.JBiol Chem,1970,245(22):6176-6181.
[22]Del Río LA,Sandalio LM,Altomare DA,et al.Mitochondrial and peroxisomalmanganese superoxide dismutase:differential expression during leaf senescence.J Exp Bot,2003,54(384):923-933.
[23]Shen X,Zheng S,Metreveli NS,et al.Protection of cardiac mitochondria by overexpression of MnSOD reduces diabetic cardiomyopathy.Diabetes,2006,55(3):798-805.
[24]Wong GH.Protective roles of cytokines against radiation:induction ofmitochondrial MnSOD.Biochim Biophys Acta,1995,1271(1):205-209.
[25]Gómez-Anduro GA,Barillas-Mury CV,Peregrino-Uriarte AB,et al.The cytosolic manganese superoxide dismutase from the shrimp Litopenaeus vannamei:molecular cloning and expression.Dev Comp Immunol,2006,30(10):893-900.
[26]Fréalle E,Noël C,Viscogliosi E,et al.Manganese superoxide dismutase in pathogenic fungi:an issue with pathophysiological and phylogenetic involvements.FEMS Immunol Med Microbiol,2005,45(3):411-422.
[27]Yost F,Fridovich I.An iron-containing superoxide dismutase from Escherichia coli.J Biol Chem,1973,248(14):4905-4908.
[28]Bowler C,Camp W,Montagu M,et al.Superoxide dismutases in plants.Crc Crit Rev Plant Sci,1994,13(3):199-218.
[29]FelisaWS,Daniel G,Oscar S,et al.The role and evolution of superoxide dismutases in algae.JPhycol,2005,41(3):453-465.
[30]Valdivia A,Pérez-Alvarez S,Aroca-Aguilar JD,et al.Superoxide dismutases:a physiopharmacological update.J Physiol Biochem,2009,65(2):195-208.
[31]Rubio MC,Becana M,Kanematsu S,et al.Immunolocalization of antioxidant enzymes in high-pressure frozen root and stem nodules of Sesbania rostrata.New Phytol,2009,183(2):395-407.
[32]Youn HD,Youn H,Lee JW,etal.Unique isozymes of superoxide dismutase in Streptomyces griseus.Arch Biochem Biophys,1996,334(2):341-348.
[33]Priya B,Premanandh J,Dhanalakshmi RT,et al.Comparative analysis of cyanobacterial superoxide dismutases to discriminate canonical forms.BMC Genomics,2007,8(1):435.
[34]Gao JJ.Gene expression and activities of sod in cucumber seedlings were related with concentrations of Mn2+,Cu2+,or Zn2+under low temperature stress.Scientia Agricultura Sinica,2009,8(6):678-684.
[35]Zhang Q,Li F,Wang B,et al.Themitochondrialmanganese superoxide dismutase gene in Chinese shrimp Fenneropenaeus chinensis:cloning,distribution and expression. Dev Comp Immunol,2007,31(5):429-440.
[36]ChengW,Tung YH,Liu CH,etal.Molecular cloning and characterisation of cytosolicmanganese superoxide dismutase(cytMn-SOD)from the giant freshwater prawn Macrobrachium rosenbergii.Fish Shellfish Immunol,2006,20(4):438-449.
[37]Oberley LW,Buettner GR.Role of superoxide dismutase in cancer:a review.Cancer Res,1979,39(39):1141-1149.
[38]Sampayo JN,GillMS,Lithgow GJ.Oxidative stress and aging-the use of superoxide dismutase/catalasemimetics to extend lifespan.Biochem Soc Trans,2003,31(Pt 6):1305-1307.
[39]Lund-Olesen K.Etiology of multiple sclerosis:role of superoxide dismutase.Med Hypotheses,2000,54(2):321-322.
[40]Bagis S,Tamer L,Sahin G,etal.Free radicals and antioxidants in primary fibromyalgia:an oxidative stress disorder?Rheumatol Int,2005,25(3):188-190.
[41]Zhang X,Wan Q,Liu F,et al.Molecular analysis of the chloroplast Cu/Zn-SOD gene(AhCSD2)in peanut.Cro J,2015,43(3):246-257.
[42]Miller AF.Superoxide dismutases:active sites that save,but a protein that kills.Curr Opin Chem Biol,2004,8(2):162-168.
[43]Orrell R,Debelleroche J,Marklund S,et al.A novel SOD mutant and ALS.Nature,1995,374(6522):504-505.
[44]Estévez AG,Crow JP,Sampson JB,et al.Induction of nitric oxide-dependent apoptosis in motor neurons by zinc-deficient superoxide dismutase.Science,1999,286(5449):2498-2500.
[45]Turner BJ,Talbot K.Transgenics,toxicity and therapeutics in rodent models of mutant SOD1-mediated familial ALS. Prog Neurobiol,2008,85(1):94-134.
[46]Ookawara T,Imazeki N,Matsubara O,etal.Tissue distribution of immunoreactivemouse extracellular superoxide dismutase.Am JPhysiol,1998,275(1):840-847.
[47]Mruk D,Cheng CH,Cheng YH,etal.Rat testicular extracellular superoxide dismutase:its purification,cellular distribution,and regulation.Biol Reprod,1998,59(2):298-308.
[48]Zelko IN,Mariani TJ,Folz RJ.Superoxide dismutasemultigene family:a comparison of the CuZn-SOD(SOD1),Mn-SOD(SOD2),and EC-SOD(SOD3)gene structures,evolution,and expression.Free Radic Biol Med,2002,33(3):337-349.
[49]Adachi T,Wang J,Wang XL.Age-related change of plasma extracellular-superoxide dismutase.Clin Chim Acta,2000,290(2):169-178.
[50]Iversen MB,Gottfredsen RH,Larsen UG,etal.Extracellular superoxide dismutase is present in secretory vesicles of human neutrophils and released upon stimulation.Free Radic Biol Med,2016,97:478-488.
[51]Kim Y,Kim BH,Lee H,et al.Regulation of skin inflammation and angiogenesis by EC-SOD via HIF-1αand NF-κB pathways.Free Radic Biol Med,2011,51(11):1985-1995.
[52]Kwon MJ,Kim BH,Yun SL,etal.Role of superoxide dismutase 3 in skin inflammation.JDermatol Sci,2012,67(2):81-87.
[53]Miao L,St Clair DK.Regulation of superoxide dismutase genes:implications in disease.Free Radic Biol Med,2009,47(4):344-356.
[54]Fattman CL,Schaefer LM,Oury TD.Extracellular superoxide dismutase in biology and medicine.Free Radic Biol Med,2003,35(3):236-256.
[55]Fukai T,UshiofukaiM.Superoxide dismutases:role in redox signaling,vascular function,and diseases.Antioxid Redox Signal,2011,15(6):1583-1606.
[56]Castellone MD,Langella A,Cantara S,et al.Extracellular superoxide dismutase inducesmouse embryonic fibroblast proliferative burst,growth arrest,immortalization,and consequent in vivo tumorigenesis.Antioxid Redox Signal,2014,21(10):1460-1474.
[57]Batinic-Haberle I,Tovmasyan A,Roberts ER,et al.SOD therapeutics:latest insights into their structure-activity relationships and impact on the cellular redox-based signaling pathways.Antioxid Redox Signal,2014,20(15):2372-2415.
[58]Dhar SK,St Clair DK.Manganese superoxide dismutase regulation and cancer.Free Radic Biol Med,2012,52(11-12):2209-2222.
[59]Hopkins EF.Manganese and the growth of lemna minor. Science,1931,74(1926):551-552.
[60]Galeotti T,Wohlrab H,Borrello S,et al.Messenger RNA for manganese and copper-zinc superoxide dismutases in hepatomas:Correlation with degree of differentiation.Biochem Biophys Res Commun,1989,165(2):581-589.
[61]Li Y,Huang TT,Carlson EJ,etal.Dilated cardiomyopathy and neonatal lethality inmutantmice lackingmanganese superoxide dismutase.Nat Genet,1995,11(4):376-381.
[62]Williams MD,Van RH,Conrad CC,et al.Increased oxi-dative damage is correlated to altered mitochondrial function in heterozygous manganese superoxide dismutase knockout mice.JBiol Chem,1998,273(43):28510-28515.
[63]Sutton A,Khoury H,Pripbuus C,et al.The Ala16Val genetic dimorphism modulates the import of humanmanganese superoxide dismutase into rat livermitochondria.Pharmacogenetics,2003,13(3):145-157.
[64]Zhang HJ,Yan T,Oberley TD,etal.Comparison of effects of two polymorphic variants of manganese superoxide dismutase on human breast MCF-7 cancer cell phenotype. Cancer Res,1999,59(24):6276-6283.
[65]Sadosky AB,Wilson JW,Steinman HM,etal.The iron superoxide dismutase of Legionella pneumophila is essential for viability.JBacteriol,1994,176(12):3790-3799.
[66]Priya B,Premanandh J,Dhanalakshmi RT,et al.Comparative analysis of cyanobacterial superoxide dismutases to discriminate canonical forms.BMC Genomics,2007,8(1):435.
[67]Ke WT,Dai GZ,Jiang HB,et al.Essential roles of iron superoxide dismutase in photoautotrophic growth of Synechocystis sp.PCC 6803 and heterogeneous expression ofmarine Synechococcus sp.CC9311 copper/zinc superoxide dismutase within its sodB knockdown mutant.Microbiology,2014,160(1):228-241.
[68]Zhang Y,Ding S,Lu Q,et al.Characterization of photosystem II in transgenic tobacco plants with decreased iron superoxide dismutase.Biochim Biophys Acta,2011,1807(4):391-403.
[69]Myouga F,Shinozaki K.A heterocomplex of iron superoxide dismutases defends chloroplast nucleoids against oxidative stress and is essential for chloroplast development in Arabidopsis.Plant Cell,2008,20(11):3148-3162.
[70]Foyer CH.Overexpression of iron superoxide dismutase in transformed poplarmodifies the regulation of photosynthesis at low CO2 partial pressures or following exposure to the prooxidant herbicide methyl viologen.Plant Physiology,1998,117(2):565-574.
[71]Van Camp W,Capiau K,Van Montagu M,et al.Enhancement of oxidative stress tolerance in transgenic tobacco plants overproducing Fe-superoxide dismutase in chloroplasts.Plant Physiol,1996,112(4):1703-1714.
[72]Breusegem FV,Slooten L,Stassart JM,et al.Overproduction of Arabidopsis thaliana FeSOD confers oxidative stress tolerance to transgenic maize.Plant Cell Physiol,1999,40(5):515-523.
[73]Kim EJ,Kim HP,Hah YC,etal.Differential expression of superoxide dismutases containing Ni and Fe/Zn in Streptomyces coelicolor.Eur JBiochem,1996,241(1):178-185.
[74]Kim EJ,Chung HJ,Suh B,et al.Expression and regulation of the sodF gene encoding iron-and zinc-containing superoxide dismutase in Streptomyces coelicolor Müller.J Bacteriol,1998,180(8):2014-2020.
[75]Schmidt A,Schmidt A,Haferburg G,etal.Superoxide dismutases of heavymetal resistant streptomycetes.JBasic Microbiol,2007,47(1):56-62.
[76]Carillon J,Rouanet JM,Cristol JP,et al.Superoxide dismutase administration,a potential therapy against oxidative stress related diseases:several routes of supplementation and proposal of an original mechanism of action.Pharm Res,2013,30(11):2718-2728.
[77]Baf A,Dutt S,Kumar S,et al.Superoxide dismutase:an industrial perspective.Crit Rev Biotechnol,2011,31(31):65-76.
[78]Porfire AS,Leucu?a SE,Kiss B,et al.Investigation into the role of Cu/Zn-SOD delivery system on its antioxidant and antiinflammatory activity in rat model of peritonitis. Pharmacol Rep,2014,66(4):670-676.
[79]黄维华,卢政,袁勤生.SOD在胃肠道内稳定性与口服吸收研究.中国医药工业杂志,1995,26(11):502-504.
[80]Pastorini S,Marino G,Brigato R,et al.The therapy of plastic penile induration using superoxide dismutase per os and injection combined with vasoactive intracavernous pharmacotherapy.Minerva Urol Nefrol,1991,43(2):75-78.
[81]Bernier M,Manning AS,Hearse DJ.Reperfusion arrhythmias:dose-related protection by anti-free radical interventions.Am JPhysiol,1989,256(5 Pt2):H1344-1352.
[82]Okada F,Shionoya HM,Kobayashi T,et al.Prevention of inflammation-mediated acquisition of metastatic properties of benign mouse fibrosarcoma cells by administration of an orally available superoxide dismutase.Br JCancer,2006,94(6):854-862.
[82]Qin Y,Dai W,Wang Y,et al.Fe-SOD cooperates with Nutlin3 to selectively inhibit cancer cells in vitro and in vivo.Biochem Biophys Res Commun,2013,431(2):169-175.
[84]陈祥娥,凌沛学,张天民.超氧化物歧化酶的应用.食品与药品,2013,15(4):283-286.
[85]Li C,Zhou H M.The role of manganese superoxide dismutase in inflammation defense.Enzyme Res,2011(1):387176-387176.
[86]许静,陈志文.SOD超氧化物歧化酶漱口剂临床疗效观察.口腔材料器械杂志,1995,4(2):84-85.
[87]陈瑞曦.超氧化物歧化酶研究及在海洋渔业中的应用.中国渔业经济,2014,32(5):85-91.
[88]Carillon J,Rio DD,Teissèdre PL,et al.Antioxidant ca-pacity and angiotensin Iconverting enzyme inhibitory activity of a melon concentrate rich in superoxide dismutase.Food Chem,2013,135(3):1298-1302.
[89]崔慧斐,张天民.超氧化物歧化酶在食品和化妆品中的应用及其发酵法生产进展.药物生物技术,2000,7(3):187-189.
[90]何献君,梁晓冬,吕晓峰,等.超氧化物歧化酶应用研究状态.中国医药指南,2010,8(15):37-39.
[91]张丽媛,王丕武,马红丹,等.超氧化物歧化酶的研究现状及在化妆品中的应用.农产品加工,2014,(8):65-68.
[92]季波,徐滢波,赵树进.125I-PEG-SOD及125I-SOD肠溶胶囊在家兔体内的药动学.中国药房,2003,14(10):587-589.
[93]Zhu Y,Li H,Hui N,et al.Molecular cloning and characterization of a thermostable lipase from deep-sea thermophile Geobacillus sp.EPT9.World J Microbiol Biotechnol,2014,31(2):1347-1357.
[94]Li H,Feng ZM,Sun YJ,et al.Engineering a thermostable iron superoxide dismutase based on manganese superoxide dismutase from Thermus thermophilus.Process Biochem,2016,51(2016):39-47.
[95]Romao S.Therapeutic value of oral supplementation with melon superoxide dismutase and wheat gliadin combination. Nutrition,2015,31(3):430-436.
Progress in the research of superoxide dismutase
Yuan Mu1,Wang Changliu*,Wang Yifei,Xu Guihua,Han Xiao
(School of Life Sciences,Ludong University,Yantai264025,China)
Superoxide dismutase(SOD)is an importantmember of the biological antioxidant system and one of the key enzymes that are responsible for the efficient removal of reactive oxygen species.As the first line of defense in the antioxidant system,it is almost ubiquitous in all forms of aerobic lives and is commonly distributed in the cytoplasm,mitochondria and chloroplasts.This paper reviews the progress in SOD research from its discovery,classification and distribution to itsmechanism of action,molecular structure and function,origin and evolution as well as application.The outlook for SOD study is also discussed.
Superoxide dismutase;reactive oxygen species;antioxidant
Q554
A
10.16705/j.cnki.1004-1850.2016.06.015
2016-08-17
2016-10-11
山东省自然科学基金资助(ZR2010CM030)
袁牧,男(1991年),汉族,硕士研究生
*通讯作者(To whom correspondence should be addressed):changliuwang@sina.com
