土壤环境因子对烯酰吗啉残留降解的影响
2016-03-01李春艳李福琴姚加加胡德禹
李春艳, 李福琴, 康 頔, 姚加加, 胡德禹
(贵州大学精细化工研发中心, 绿色农药与农业生物工程国家重点实验室培育基地和教育部重点实验室, 贵州 贵阳 550025)
土壤环境因子对烯酰吗啉残留降解的影响
李春艳, 李福琴, 康 頔, 姚加加, 胡德禹*
(贵州大学精细化工研发中心, 绿色农药与农业生物工程国家重点实验室培育基地和教育部重点实验室, 贵州 贵阳 550025)
为探明烯酰吗啉在不同土壤中的降解状况,采用LC-MS/MS检测方法,对烯酰吗啉在不同土壤中的降解进行测定。结果表明:烯酰吗啉在土壤中的添加回收率为85.55%~99.52%,相对标准偏差(RSD)为0.58%~1.75%,土壤中含水率越多,微生物越多,有机质越多,烯酰吗啉在土壤中的降解越快。烯酰吗啉在土壤中的降解主要受微生物和有机质含量影响。
烯酰吗啉; 土壤; 降解; LC-MS/MS
烯酰吗啉对多种病害有生物活性,可用于防治葡萄、番茄和马铃薯等作物上的真菌病害且低毒,对天敌和有益生物无害,是一种与环境相容性好的广谱杀菌剂[1]。但农药的长期大量使用使蔬菜水果中农药残留量超标问题突出[2-6]。农药在环境和土壤中的水解和降解是评价农药环境安全性的重要指标,对农药的持效性及残留消解动态有直接影响[7-10]。目前,有关烯酰吗啉在土壤中的降解研究较少。因此。笔者采用LC-MS/MS检测,通过室内模拟试验研究烯酰吗啉在不同土壤因素下的消解动态,探讨土壤环境因子对烯酰吗啉降解的影响,为该药剂在生产上的安全应用提供依据。
1 材料与方法
1.1 材料
烯酰吗啉标准品及试剂:烯酰吗啉标准品(纯度99.0%)(Dr.Ehrenstorfer Gmbh公司);色谱甲醇(美国霍尼韦尔公司),甲醇(AR)(上海申博化工有限公司),无水硫酸镁和无水硫酸钠(分析纯,550℃烘烤4 h)。
供试土壤:采于贵州(黄壤,有机质含量2.14%,pH 6.6)、黑龙江(黄壤,有机质含量2.08%,pH 8.2)和海南(黄壤,有机质含量2.30%,pH 5.9)3地,将土壤自然风干,研碎后过2 mm筛备用。
仪器:液相色谱质谱/质谱联用仪(LC-MS/MS),质谱为三重四级杆质谱仪;液相:岛津的LC-20A(美国Applied Biosystems公司);涡旋混合器(QL-901型,江苏海门市麒麟医用仪器厂);电子天平(ALC-210.4型,德国Sartorius公司);马弗炉(SX-4-10,沪南电炉烘箱厂);超声波清洗器(KQ-100B型,昆山市超声仪器有限公司)。
1.2 LC-MS/MS检测条件

质谱条件:离子源为电喷雾离子源ESI,扫描模式为正离子模式,离子源气体(GS1)60 psi,离子源气体(GS2)60 psi,离子喷雾电压5 500 V,气帘气30 psi,离子源温度650℃。检测方式为多重反应监测(MRM)(表2)。
表1 烯酰吗啉LC-MS/MS检测的梯度洗脱条件
Table 1 Gradient elution conditions of determining dimethomorph by LC-MS/MS
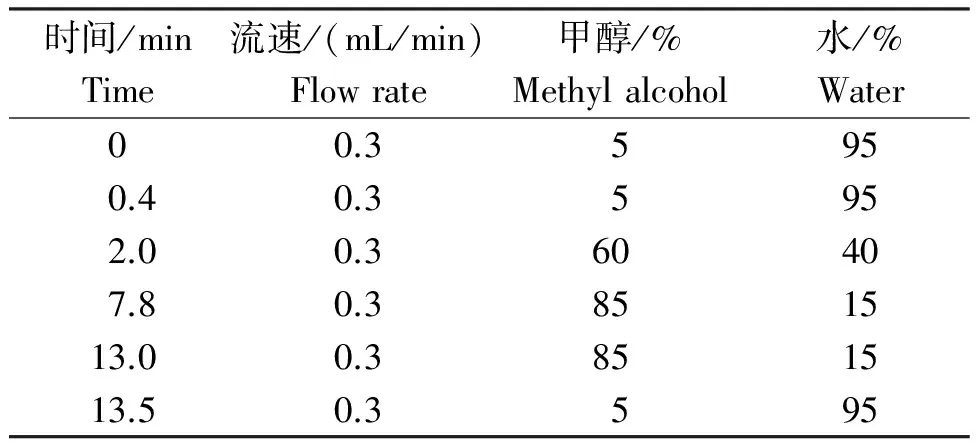
时间/minTime流速/(mL/min)Flowrate甲醇/%Methylalcohol水/%Water00.35950.40.35952.00.360407.80.3851513.00.3851513.50.3595
1.3 土壤样品前处理
称取5.00 g土壤于50 mL离心管内,加20 mL甲醇,超声20 min,加3 g无水硫酸镁和2 g无水硫酸钠,涡旋2 min。以6 000 r/min离心5 min,准确移取上清液1 mL,经0.22 μm滤膜过滤,转移至样品瓶内,待LC-MS/MS检测。
1.4 方法的灵敏度与添加回收率
分别添加3个水平的烯酰吗啉标液于土壤空白样品中,每个添加水平重复5次,并作间隔1 d的土壤添加回收试验。按1.3的方法提取和作LC-MS/MS检测。
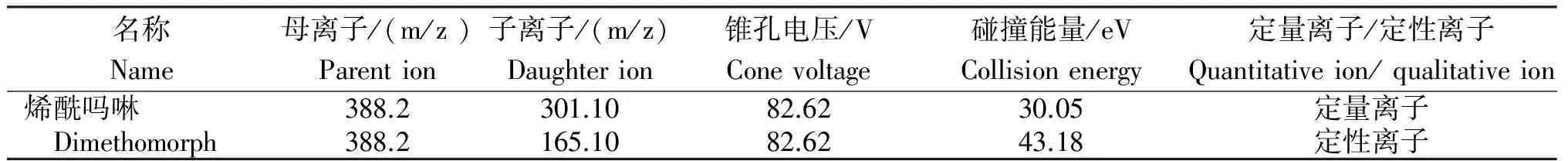
表2 烯酰吗啉LC-MS/MS检测的多重反应监测
1.5 不同土壤环境因素对降解的影响试验
1.5.1 不同含水率试验 称5.00 g土壤(贵州)于50 mL离心管中,调节含水率为10%、20%、30%,加烯酰吗啉标液使土壤样品初始浓度为0.5 mg/kg,置于25℃避光恒温箱,分别于加药后2 h、1 d、2 d、3 d、5 d、7 d、10 d、14 d、21 d、28 d、42 d、60 d取样,按照1.3的中方法测定土壤中烯酰吗啉的残留量。
1.5.2 灭菌与非灭菌试验 灭菌方法:将贵州空白土壤于180℃下烘3 h,备用。称5.00g土壤(贵州灭菌土、非灭菌土)于50 mL离心管中,调节含水率为20%,加入烯酰吗啉标液使土壤样品初始浓度为0.5 mg/kg,置于25℃避光恒温箱,分别于加药后2 h、1 d、2 d、3 d、5 d、7 d、10 d、14 d、21 d、28 d、42 d、60 d取样,按照1.3中方法测定土壤中烯酰吗啉的残留量。
1.5.3 去有机质与未去有机质试验 去有机质方法:称处理过的土壤100 g于500 mL烧杯中,加入少量灭菌水润湿土壤,静置片刻后加入30%的H2O2,边加边搅拌以加速其氧化,将去除有机质的土壤置于60℃烘箱中烘干,备用[11]。准确称5.00 g土壤(贵州含有机质土、去有机质土)于50 mL离心管中,调节含水率为20%,加入烯酰吗啉标液使土壤样品初始浓度为0.5 mg/kg,置于25℃避光恒温箱,分别于加药后2 h、1 d、2 d、3 d、5 d、7 d、10 d、14 d、21 d、28 d、42 d、60 d取样,按照1.3中方法测定土壤中烯酰吗啉的残留量。
1.5.4 不同土壤试验 称5.00 g土壤(贵州、黑龙江、海南)于50 mL离心管中,调节含水率为20%,加入烯酰吗啉标液使土壤样品的初始浓度为0.5 mg/kg,置于25℃避光恒温箱,分别于加药后2 h、1 d、2 d、3 d、5 d、7 d、10 d、14 d、21 d、28 d、42 d、60 d取样,按照1.3中的方法测定土壤中烯酰吗啉的残留量。
2 结果与分析
2.1 添加回收率
从表3可知,烯酰吗啉在土壤中的添加回收率为85.55%~99.52%,相对标准偏差(RSD)为0.58%~1.75%。表明,无论从方法的准确性还是精密度,均符合农药残留分析的要求[12]。
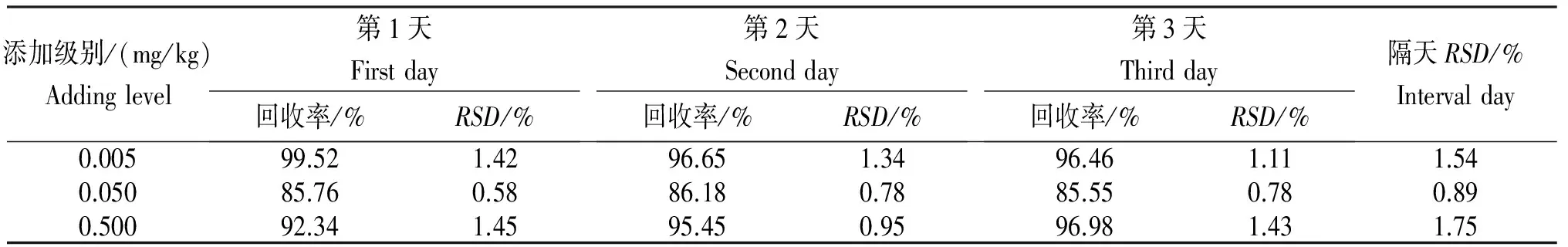
表3 烯酰吗啉在土壤中的平均添加回收率
2.2 土壤环境因子对烯酰吗啉残留降解的影响
从图示看出,烯酰吗啉在土壤中的前期降解较快,后期降解较慢。
采用一级动力学方程进行拟合,即:
Ct=C0e-kt,T1/2=ln2/K
式中,Ct为时间t时的农药残留量(mg/kg);C0为施药后的原始沉积量(mg/kg)。t为施药后时间(d);k为消解系数;T1/2为降解半衰期(d)。
根据具体消解数据(表4)和各种土壤环境因子中烯酰吗啉的降解曲线(图示)可知,在含水率为10%~30%的土壤中,含水率越小半衰期越大,降解缓慢;在灭菌和去有机质的土壤中烯酰吗啉的半衰期较大,其降解较慢。
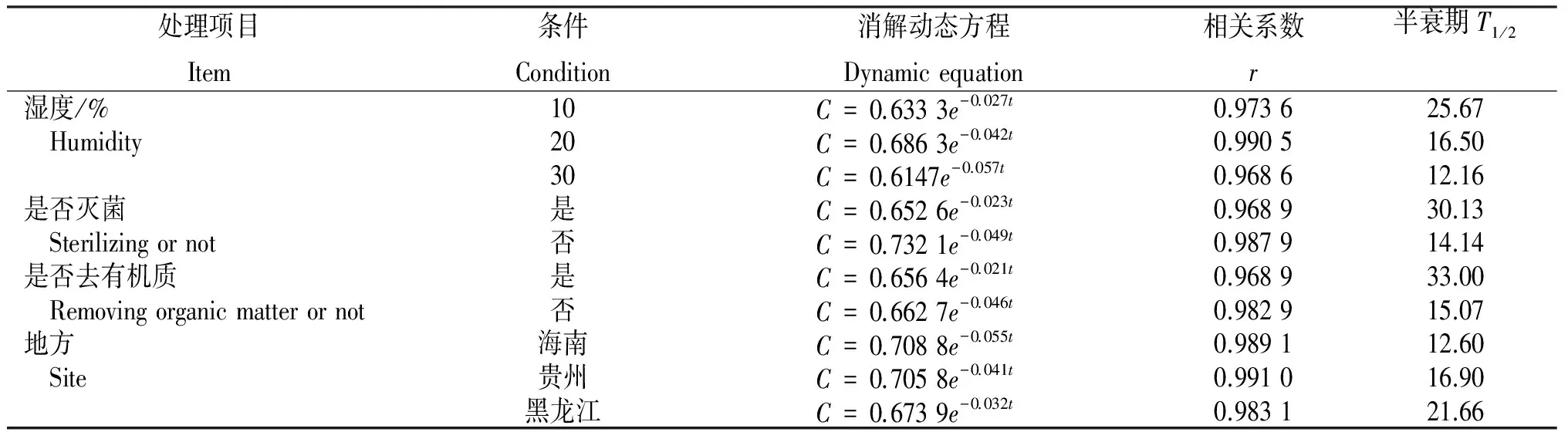
表4 烯酰吗啉在不同土壤环境因子中的降解情况

图示 不同土壤环境因子中烯酰吗啉的残留量
Fig. The residual content of dimethomorph in various soil environmental factors
3 小结与讨论
在含水率10%~30%范围内的土壤中,含水率越高,烯酰吗啉的降解速率越快。原因在于水分使微生物生长旺盛,改变了土壤透气性能和土壤氧化还原电位,从而决定了农药化学降解的快慢。烯酰吗啉在灭菌和去有机质土中降解得较慢,故土壤微生物和有机质对烯酰吗啉的降解起促进作用,主要是因为有机质中存在大量具有催化分解过程的官能团,可以加速农药分解[13]。烯酰吗啉在海南土壤中降解得相对较快,半衰期为12.60 d,在贵州和黑龙江土壤中降解较慢。试验结果表明,土壤中含水率越高,微生物越多,有机质含量越高,烯酰吗啉在土壤中的降解越快,且烯酰吗啉在土壤中的降解主要受微生物和有机质的影响。
[1] 凌世海.固体制剂[M].北京:化学工业出版社,2003:369.
[2] 何 强,郭新东.土壤中烯酰吗啉残留量的气相色谱分析[J].广东化工,2006,34(4):67-68.
[3] 李荣玉,谢庆艳.烯酰吗啉在土壤及番茄中残留量的气相色谱分析[J].山地农业生物学报,2013,32(6):495-498.
[4] 吴南村,张 群.莴笋和油麦菜中烯酰吗啉的GC-ECD分析[J].农药残留,2014,35(1):35-37.
[5] 余 磊,刘彬,李飞飞,等.气相色谱法测定大白菜中甲氰菊酯和溴氰菊酯的残留分析[J].贵州农业科学,2010,38(6):213-215.
[6] 孙向东.蔬菜农药残留的危害、种类、超标原因及应对措施[J].贵州农业科学,2005,33(6):99-100.
[7] Ma X L, Yu P B, Gao H N, et al. Bioremediation of exogenous degrading bacteria to the nicosulfuron-contaminated soil[J].Journal of Safety and Environment, 2011,11(4):44-47.
[8] 吴春先,吕 潇,慕 卫,等.环境条件和微生物对灭线磷降解的影响[J].农药学学报,2002,4(1):45-51.
[9] 朴秀英,陶传江,姜 辉,等.烯酰吗啉顺反异构体在土壤中的降解动态研究[J].农药学学报,2011,13(2):169-173.
[10] Hoehl H, Barz W. Metabolism of the insecticide phoxim in plants and cell suspension cultures of soybean[J].Journal of Agricultural and Food Chemistry,1995,28(4):1052-1056.
[11] 刘祥云,崔 滢,杨 艳.影响霜脲氰在土壤中降解的因素研究[J].广州化工,2014,42(8):101-104.
[12] 杨安军,林 超.固体废弃物严重威胁水环境[J].海河水利,1998(5):18-20.
[13] 惠玉虎.土壤有机质对农药行为的影响[J].土壤学进展,1989,17(2):40-44.
(责任编辑: 聂克艳)
Effects of Soil Environmental Factors Influencing the Degradation of Dimethomorph
LI Chunyan, LI Fuqin, KANG Di, YAO Jiajia, HU Deyu*
(ResearchandDevelopmentCenterforFineChemicals,StateKeyLaboratoryBreedingBaseofGreenPesticideandAgriculturalBioengineering,KeyLaboratoryofGreenPesticideandAgriculturalBioengineering,GuizhouUniversity,Guiyang,Guizhou550025,China)
In order to explore the degradation factors of dimethomorph in different soils,a method of determining dimethomorph in soil was developed by LC-MS/MS. The results showed the adding recovery rate of dimethomorph in the soil was 85.55%~99.52%, the relative standard deviation (RSD) was 0.58%~1.75%, the more the moisture content, microorganism, and organic matter in soil, the faster the degradation of dimethomorph in the soil. The speed of dimethomorph’s degradation in soil was mainly influenced by microorganism and organic matter content in soil.
dimethomorph; soil; degradation; LC-MS/MS
2015-12-25; 2016-03-11修回
李春艳(1989-),女,在读硕士,研究方向:农药残留分析。E-mail:15285521846@163.com
*通讯作者:胡德禹(1965-),女,研究员,从事农药残留分析研究。E-mail:fcc.dyhu@gzu.edu.cn
1001-3601(2016)03-0118-0083-03
S481+.8
A
