1株高效解钾菌的分离、鉴定及培养条件优化
2016-03-01伍善东郭照辉单世平付祖姣
伍善东, 雷 平, 郭照辉, 单世平, 付祖姣, 程 伟
(湖南省微生物研究院, 湖南 长沙 410009)
1株高效解钾菌的分离、鉴定及培养条件优化
伍善东, 雷 平, 郭照辉, 单世平*, 付祖姣, 程 伟
(湖南省微生物研究院, 湖南 长沙 410009)
为获得高效的解钾菌株,从长沙县油菜田土壤中分离有较强解钾能力的菌株,结合菌落形态和生理生化特性及16SrDNA序列分析鉴定菌株,通过单因子试验与正交试验对解钾能力最强的菌株发酵条件进行优化。结果表明:解钾能力最强菌株JK-3为枯草芽孢杆菌(Bacillussubtilis),其发酵上清液中有效钾含量较对照增加13.7 mg/L。最优培养基为4.0%葡萄糖、0.1%蛋白胨、1.0%鱼粉、0.5%MgSO4·7H2O;最优培养条件为培养温度28℃、培养时间36 h、初始pH 7.2、转速180 r/min、接种量2.0%,500 mL三角瓶装液量为40 mL。
解钾菌; 分离; 枯草芽孢杆菌; 微生物肥料
钾是作物生长的重要营养要素之一。据土壤普查资料显示[1],我国耕地缺钾和严重缺钾的比例分别约为70%和45%,肥料中的氮、磷、钾比例为1∶0.4∶0.16,远小于发达国家的 1∶0.5∶0.4,已成为限制作物产量和品质提高的重要因素。农业生产中常施用化学钾肥提供给作物生长所需的钾元素,但易破坏土壤结构、有机质含量下降[2],不利于农业的可持续性发展。土壤中95%的钾为矿物钾形态,存在于钾长石和云母这二大矿物中[3],不能直接被植物吸收利用。解钾细菌多是硅酸盐细菌,其能分解矿物并释放钾等元素供植物利用,将土壤中无效钾元素转化为有效态钾,同时也有固氮和解磷功能[4]。利用微生物从钾长石中获得可供作物利用的有效钾,有能耗低、成本少、无污染和方法简单等优势,被认为是最有前途的钾长石提钾方法[5]。盛下放等[6]分离到有高效解钾活性的硅酸盐细菌NBT,经摇瓶振荡培养120 h,菌株NBT的释钾量较对照增加226.0%。这些研究表明,解钾菌释钾的相对量较多,但绝对量较小,有必要筛选更具解钾效率的菌株。因此,笔者从油菜田中分离高效解钾菌,对其进行鉴定并且优化菌株的发酵条件,以期为微生物肥料的开发与应用提供理论依据。
1 材料与方法
1.1 试验材料
NA培养基:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂18.0 g,pH 7.2,去离子水1000.0 mL。亚历山鲍罗夫培养基[7]:蔗糖5.0 g,Na2HPO42.0 g,MgSO4·7H2O 0.5 g,FeCl35.0 mg,CaCO30.1 g,钾长石粉1.0 g(去离子水5次清洗),琼脂20.0 g,pH 7.0,去离子水1 000.0 mL。液体培养基不加琼脂。基础培养基:蔗糖10.0 g,MgSO4·7H2O 0.5 g,CaCO31.0 g,(NH4)2SO41.0 g,NaCl 0.1 g,酵母膏0.5 g,K2HPO42.0 g,pH 7.4,去离子水1 000.0 mL。
1.2 解钾菌的分离
采用5点取样法,从长沙县油菜田采集土壤。称取10 g土壤样品加入到90 mL无菌水中,充分混匀,静置5 min,按梯度稀释至10-7,分别从10-5、10-6、10-73个稀释梯度中各吸取0.2 mL菌液加入亚历山鲍罗夫培养基平皿中,涂抹均匀,每个稀释梯度3次重复,平皿倒至于30℃恒温箱中培养4~5 d,挑取生长势好的菌落,划线纯化,3次重复,直至获得纯培养,保藏于4℃冰箱中。
1.3 菌株解钾能力的测定
将待测菌株挑取一环接种于50 mL亚历山鲍罗夫液体培养基中,以不接种的作为空白对照,30℃,180 r/min摇床培养14 d。培养液经4℃,5 000 r/min离心10 min,收集上清液,利用火焰分光光度计测其钾含量[8]。
1.4 菌株的鉴定
1.4.1 解钾菌株的形态特征、生理生化鉴定 将菌株划线接种于NA培养基上,置于30℃的恒温箱中培养2 d,观察菌落特征,用接种环挑取纯化后的菌株进行革兰氏染色,镜检。生理生化试验依据《常见细菌系统鉴定手册》[9]对菌株进行鉴定。
1.4.2 解钾菌株的16SrDNA序列分析 提取DNA后,对16S rDNA目的片断进行PCR扩增[10]。引物序列:F, 5′-AGAGTTTGATCCTGGCTCAG-3′;R,5′-GGTTACCTTGTTACGACTT-3′。
PCR反应体系(50 μL):去离子水39 μL,PCR buffer 5 μL,dNTP 2 μL,上、下游引物各1 μL,模板DNA 1 μL,Taq DNA聚合酶1 μL。PCR反应条件:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸90 s,30个循环。72℃终末延伸10 min。PCR产物由上海生工进行序列测定。序列输入GenBank数据库中进行比对,选择同源性高的序列使用MEGA5.2软件邻接法构建系统发育树。
1.5 培养基成分的筛选试验
1.5.1 种子液的制备 将活化后的菌株接种于NA液体培养基,在30℃、180 r/min的条件下,摇床培养20 h。
1.5.2 培养基成分的筛选 通过单因子试验筛选适合菌株的最佳碳源、氮源和无机盐,再用正交试验法确定培养基各组分的最佳含量。
1) 碳源。分别以含量为20 g/L的淀粉、麦芽糖、木糖、葡萄糖、甘露醇和蔗糖替换基础培养基中碳源,500 mL三角瓶中装液量为100 mL,每个摇瓶中接入5 mL种子液,于30℃,180 r/min条件下摇床培养48 h。按平板菌落计数法测定发酵液中的活菌数。
2) 氮源。分别以含量为20 g/L的黄豆粉、牛肉膏、鱼粉、蛋白胨、尿素、NH4NO3替换基础培养基中的氮源,方法同上。
3) 无机盐。分别添加1 g/L的K2HPO4、MgSO4·7H2O、FeSO4、ZnSO4、NaCL、CaCO3,替换基础培养基中的无机盐,方法同上。
1.5.3 正交试验 以优化的碳源、氮源、无机盐进行正交试验,确定各组分的最佳含量,方法同上。
1.6 培养条件的优化试验
以优化的碳源、氮源及无机盐配制培养基,进行最适培养温度、培养时间、初始pH、转速、接种量和装液量试验[11-12]。培养温度设置为20℃、24℃、28℃、32℃、36℃、40℃,培养时间设置为12 h、18 h、24 h、30 h、36 h、42 h、48 h和54 h,初始pH设置为6.0、6.4、6.8、7.2、7.6和8.0,转速设置为90 r/min、120 r/min、150 r/min、180 r/min和210 r/min,接种量设置为l.0%、2.0%、3.0%、4.0%、5.0%和6.0%,500 mL三角瓶装液量设置为40 mL、60 mL、80 mL、100 mL、120 mL和140 mL,方法同上。
1.7 试验验证
培养基成分和培养条件优化后,进行50 L罐发酵验证,测定发酵液中的活菌数。
2 结果与分析
2.1 菌株的分离筛选
从亚历山鲍罗夫培养基培养皿中初步分离到21株细菌,从中挑取生长势好的菌株6株,划线纯化后分别命名为JK-1、JK-2、JK-3、JK-4、JK-5和JK-6,保藏于4℃冰箱中。
2.2 菌株的解钾效果
6株菌经摇瓶发酵试验与对照上清液中有效钾的含量分别为3.6~14.5 mg/L和0.8 mg/L,上清液中有效钾的增加量为2.6~13.7 mg/L。其中,以JK-3发酵上清液中有效钾的增加量最大,为13.7 mg/L。故选择JK-3菌株进行下一步试验。
2.3 菌株的鉴定
2.3.1 菌落与形态特征 JK-3菌落在NA培养基上呈椭圆形或圆形,白色,表面干燥,边缘不整齐。油镜下观察,菌体呈杆状,圆端,有芽孢,卵圆形。(0.8~1.6)μm ×(1.9~5.5)μm,革兰氏染色阳性。
2.3.2 生理生化特征 JK-3能利用葡萄糖、蔗糖、木糖发酵产酸,甲基红、V. P.试验阳性,不能产生吲哚和卵黄卵磷脂酶,能使明胶液化,水解淀粉,产生过氧化氢酶、氧化酶、硫化氢,利用柠檬酸盐。初步确定JK-3为芽孢杆菌属。
2.3.3 16S rDNA序列 菌株JK-3与枯草芽孢杆菌(Bacillussubtilis)亲缘关系最近(图示),结合JK-3菌株的菌落形态特征和生理生化特征,确定该菌株为枯草芽孢杆菌。

图示 16S rDNA序列为基础构建的JK-3 菌株的系统发育树
Fig. The phylogenetic tree of JK-3 strain based on 16S rDNA sequence
2.4 最佳培养基成分的确定
2.4.1 最佳碳源、氮源和无机盐的筛选 由表1可知,当以葡萄糖为碳源时,其发酵液中的菌液浓度达最大值,为6.2×108CFU/mL;以淀粉为碳源时,其发酵液中的菌液浓度最小,仅0.9×108CFU/mL。故最佳碳源为葡萄糖。在最佳氮源的筛选试验中,以蛋白胨为唯一氮源时,其发酵液中的菌液浓度最大,为8.9×108CFU/mL;其余依次为牛肉膏、鱼粉、黄豆粉、尿素和NH4NO3,考虑成本因素,选择蛋白胨和鱼粉为氮源。在最佳无机盐的筛选试验中,当培养基中添加MgSO4·7H2O时,其发酵液中的菌液浓度最大,为6.4×108CFU/mL,故最佳无机盐为MgSO4·7H2O。
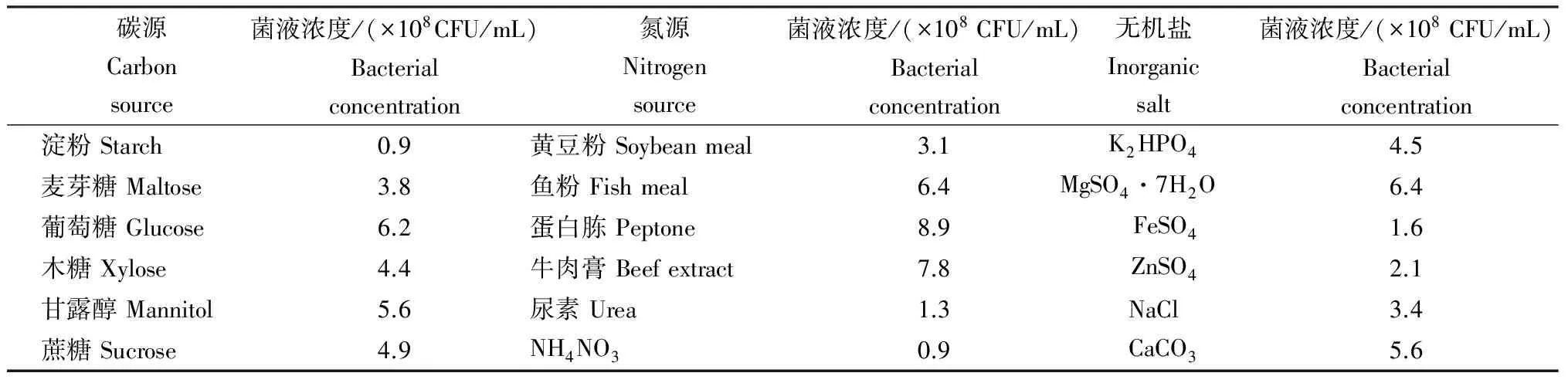
表1 培养基中加入不同碳源、氮源和无机盐后发酵液中的活菌数
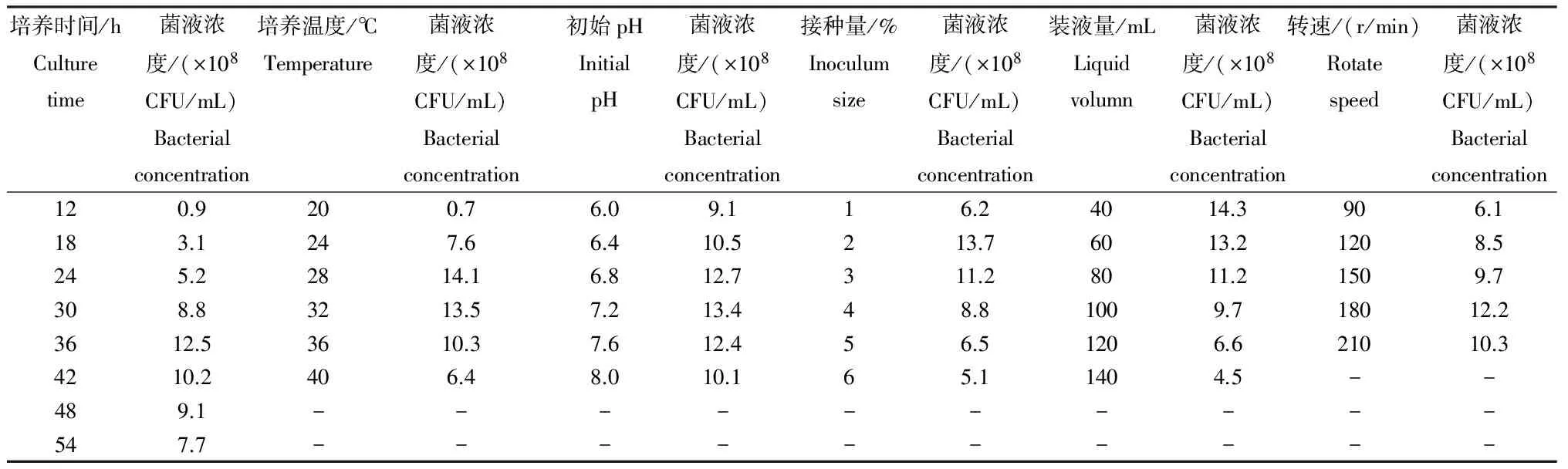
2.4.2 碳源、氮源、无机盐的最佳添加量 由表2可见,通过正交试验统计均值和极差分析,影响菌株JK-3发酵液中的菌液浓度的因素依次为B蛋白胨>A葡萄糖>D MgSO4·7H2O>C鱼粉。经方差分析,A葡萄糖(F=973.25>F0.01=6.23)、B蛋白胨(F=1226.00>F0.01=6.23)、C鱼粉(F=140.25>F0.01=6.23)和D MgSO4·7H2O(F=369.25>F0.01=6.23)对菌株JK-3发酵液中菌液浓度影响均达极显著水平,区组间差异不显著(F=0.25 表2 菌株发酵的正交试验各因素水平均值及极差 2.5 培养条件的优化试验 从表3可知,随着培养温度的升高,菌株JK-3发酵菌液浓度逐渐变大,当培养温度为28℃时,菌液浓度达最大值,为14.1×108CFU/mL,随后培养温度的升高菌液浓度逐渐变小。随着培养时间的增加,其菌液浓度呈先升高后降低趋势,当培养36 h时,其菌液浓度最高,达12.5×108CFU/mL。当培养基的初始pH在6.0~8.0时,发酵液中菌液浓度的变化较小,当初始pH为6.0时,其菌液浓度最小,为9.1×108CFU/mL,初始pH为7.2时,其菌液浓度最大,为13.4×108CFU/mL。随着转速的增加,菌液浓度呈先升高后降低趋势,当转速为180 r/min时,菌液浓度达最大,为12.2×108CFU/mL。当接种量为2%时,菌液浓度达最大值,为13.7×108CFU/mL,但接种量再增大,菌液浓度反而变小,说明接种量过大造成营养物质消耗增大,不利于菌体生长。当装液量为40 mL时,发酵液菌液浓度最大,为14.3×108CFU/mL,随着装液量的增加,菌液浓度减小。综合分析,最优培养条件为培养温度为28℃,培养时间36 h,初始pH7.2,转速180 r/min,接种量2%,装液量40 mL。 表3 不同处理方式发酵液中的活菌数 2.6 50 L发酵罐试验验证 依据培养基的最优成分及其添加量和最优培养条件,采用50 L罐进行菌株JK-3的发酵,其发酵菌液浓度为2.4×109CFU/mL,说明此培养成分和培养条件有利于菌株JK-3的发酵。 已报道的解钾菌(硅酸盐细菌)虽破坏钾矿释放可溶性钾的能力显著,但解钾绝对量却十分有限[13-14]。解钾细菌从硅酸盐矿物中滤取SiO2和K+的作用,是胞外多糖和有机酸等共同参与的结果[15]。钾细菌浸取钾矿释放有效钾仍存在解钾效率低、解钾速度慢等问题,限制了其工业应用[5]。因此,分离选育高效解钾菌株很有必要。 本研究从土壤中分离到1株有较强解钾能力的菌株JK-3,发酵上清液中有效钾的含量比对照增加13.7 mg/L,结合其菌落形态和生理生化特性及16SrDNA序列分析,鉴定其为枯草芽孢杆菌。经单因子试验和正交试验,确定发酵培养条件为4.0%葡萄糖、0.1%蛋白胨、1.0%鱼粉、0.5%MgSO4·7H2O、培养温度28℃、培养时间36 h、初始pH 7.2、转速180 r/min、接种量2.0%、装液量40 mL。50 L罐发酵验证,发酵菌液浓度为2.4×109CFU/mL。下一步的工作将是JK-3菌肥的生产及大田试验。 [1] 李新新,高新新,陈 星,等.一株高效解钾菌的筛选、鉴定及发酵条件的优化[J].土壤学报,2014,51(2):381-388. [2] 马光庭.生态有机肥与农业可持续发展[J].中国生态农业学报,2004,12(3):191-193. [3] 别运清,胡正嘉.硅酸盐细菌几种功能的研究[J].襄樊职业技术学院学报,2002,1(1):12-15. [4] 曲忠诚,孙冬梅,迟 莉.解钾微生物K3与K4的分离及特性研究[J].黑龙江农业科学,2009(5):17-19. [5] 易浪波,彭清忠,何齐庄,等.高效钾长石分解菌株的筛选、鉴定及解钾活性研究[J].中国微生态学杂志,2012,24(9):773-776. [6] 盛下放,黄为一,殷永娴.硅酸盐菌剂的应用效果及其解钾作用的初步研究[J].南京农业大学学报,2000,23(1):43-46. [7] 杜连祥,路福平.微生物学实验技术[M].北京:中国轻工业出版社,2006:131-132. [8] 周毅峰,罗云霞,刘华中,等.解钾菌的筛选[J].湖北民族学院学报:自然科学版,2009,27(3):285-288. [9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001. [10] 别小妹,陆兆新,房耀维,等.利用16SrDNA序列分析鉴定一株产抗菌物质的微生物菌株[J].食品科学,2006,27(11):466-470. [11] 伍善东,刘冬华,郭照辉,等.枯草芽孢杆菌生防菌株LY-38发酵条件优化[J].贵州农业科学,2015,43(2):53-56. [12] 明道绪,欧阳西荣,徐向宏,等.田间试验与统计分析[M].北京:科学出版社,2008. [13] 赵 飞,黄 智,何琳燕,等.不同风化程度钾长石表面矿物分解细菌的筛选及遗传多样性[J].微生物学报,2010,50(5):647-653. [14] 李海龙,谷 洁,张宏斌,等.秦岭山区硅酸盐细菌的分离、筛选以及初步鉴定[J].西北农业学报,2011,20(4):194-199. [15] Liu W X,Luo Y M,Christie P.Decomposition of silicate minerals by Bacillus mucilaginosus in liquid culture[J].Environmental Geochemistry and Health,2006,28:133-140. (责任编辑: 刘忠丽) Isolation and Identification of an Efficiency Potassium-releasing Bacterium Strain and Its Optimization of Culture Conditions WU Shandong, LEI Ping, GUO Zhaohui, SHAN Shiping*, FU Zujiao, CHENG Wei (HunanAcademyofMicrobiology,Changsha,Hunan410009,China) An efficient potassium-releasing bacterium strain isolated from the soil of rape fields in Changsha County was identified by 16 S rDNA sequence analysis according to its colony morphological feature and physiological-biochemical characteristics and then the fermentation conditions were optimized by single-factor and orthogonal tests. Results: Jk-3 strain, an efficient potassium-releasing bacterium strain isBacillussubtilisand the available potassium content in the fermented supernatant fluid increases by 13.7% compared with CK. The optimal medium for JK-3 strain is 4.0% glucose, 0.1% peptone, 1.0% fish meal and 0.5% MgSO4· 7H2O, and the optimal culture conditions include 2.0% inoculum size, 40 mL liquid volume/500mL triangular bottle, initial pH 7.2, 180 r/min and 28℃ for 36 h. potassium-releasing bacterium; isolation;Bacillussubtilis; microbial fertilizer 2015-09-01; 2016-04-10修回 湖南省科技计划项目“抗油菜菌核病微生物农药的研究与示范”(2015HK3056);湖南省自然科学基金项目“贪铜菌6-5富集土壤中重金属镉的分子机理研究”(13JJ2035) 伍善东(1978-),男,工程师,从事植物保护与微生物肥料研究。E-mail:1059995305@qq.com *通讯作者:单世平(1978-),男,副研究员,博士,从事农田土壤重金属污染防控、土壤肥料发酵工艺等研究。E-mail:ssp312@ hotmail.com 1001-3601(2016)05-0206-0077-04 Q938.1+3 A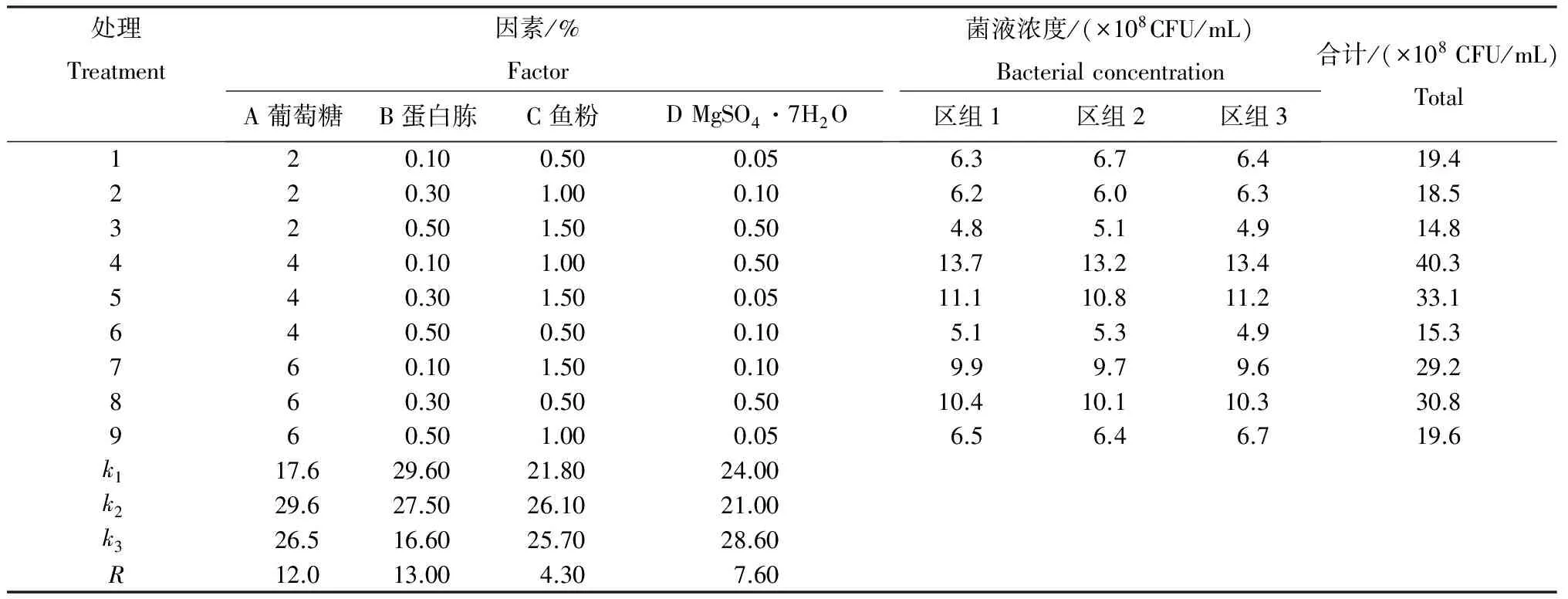
3 结论与讨论
