改良QuEChERS /LC-MS /MS联用检测水稻及其土壤中呋虫胺的方法
2016-03-01韩昕炜张海珍胡德禹
韩昕炜, 康 頔, 张海珍, 卢 平, 胡德禹
(贵州大学 精细化工研究开发中心, 绿色农药与农业生物工程国家重点实验室培育基地和教育部绿色农药与生物工程重点实验室, 贵州 贵阳 550025)
改良QuEChERS /LC-MS /MS联用检测水稻及其土壤中呋虫胺的方法
韩昕炜, 康 頔, 张海珍, 卢 平, 胡德禹*
(贵州大学 精细化工研究开发中心, 绿色农药与农业生物工程国家重点实验室培育基地和教育部绿色农药与生物工程重点实验室, 贵州 贵阳 550025)
为了寻求水稻中快速定量检测呋虫胺的方法,稻田土壤、糙米、稻壳及植株样品采用改良的QuEChERS法处理,稻壳和植株样品采用PSA和C18吸附剂净化,LC-MS/MS检测,外标法定量,建立改良QuEChERS/LC-MS/MS联用分析检测水稻田中的呋虫胺。结果表明:在0.015~0.4 mg/kg添加水平范围内,稻田土壤、糙米、稻壳以及植株中的平均回收率分别为92.32%~97.45%,93.90%~101.0%,84.30%~99.20%和77.50%~79.00%;相对标准偏差(RSD,n=5)分别为3.52%~4.32%,1.20%~2.60%,0.60%~3.30%和1.20%~2.00%。此方法的最低检测限(LOD)为1.75×10-12g,最低定量限(LOQ)为5.84×10-12g。该方法前处理简便,快速,灵敏度高,重现性好,符合农药检测分析的技术要求。
呋虫胺; LC-MS/MS; 水稻; 残留量
呋虫胺(dinotefuran)是日本三井化学公司研发的第三代新烟碱类杀虫剂[1-2]。呋虫胺的化学名称为1-甲基-2-硝基-3-(四氢-3-呋喃甲基)胍。呋虫胺杀虫谱广,具有很强的内吸渗透作用,可防治各种半翅目、鳞翅目、甲虫目、膜翅目等各种害虫[3]。主要作用于昆虫的神经传递系统,引起昆虫麻痹从而起到杀虫作用[4]。
关于呋虫胺的分析检测方法主要有高效液相色谱法、高效液相-串联质谱法和超高液相-串联质谱法。高效液相色谱法主要集中在大米、蔬菜、水果和牛科动物肌肉与肝脏上[5-11];高效液相-串联质谱法主要集中在玉米、茶叶和棉花上[12-14];超高液相-串联质谱法主要集中在蔬菜水果上[15-16]。已报道前处理过程多采用乙腈作为提取剂,净化方法主要是SPE固相萃取[5-16],耗时且过程复杂,但采用近年来国际上最新发展起来的用于农产品检测的快速样品前处理技术(QuEChERS)结合液相-串联质谱法在水稻上检测的相关研究尚未见报道。故笔者采用改良的QuEChERS法提取,PSA和C18分散固相萃取净化,旨在建立一种便捷的水稻及其环境中呋虫胺检测分析方法,为水稻田中呋虫胺及其他新烟碱类杀虫剂的快速定量检测提供依据。
1 材料与方法
1.1 仪器及试剂
1.1.1 仪器 液相色谱仪(LC-20ADXR型)购自日本岛津公司,三重四级杆质谱仪(4000 QTRAP型)购自America A.B. Company;色谱柱,ZORBAX SB-C18 (4.6 mm×150 mm,5 μm);涡旋混合器(QL-901)购自江苏海门市麒麟医用仪器厂,高速离心机(TGL-20B)购自上海安亭科学仪器厂,旋转蒸发器(RE-52AA)购自上海亚荣生化仪器厂,循环式真空泵[SHZ-D(Ⅲ)]购自上海亚荣生化仪器厂。
1.1.2 试剂 呋虫胺标准品(纯度98%,Dr. Ehrenstorfer GmbH)、甲醇(HPLC)、乙腈(AR)、蒸馏水、N-丙基乙二胺(PSA)、十八烷基键合硅胶(C18)、石墨化碳黑(GCB)和0.22 μm有机滤膜。
1.2 仪器条件的选择
1.2.1 色谱条件 色谱柱为SB-C18(4.6 mm×150 mm,5 μm );流动相A,水(0.1%甲酸);流动相B,甲醇(0.2%甲酸);梯度洗脱条件为0~1 min,80%A;1~3 min,80%~10%A;3~5 min,10%A;5~10 min,10%~80%A;流速,0.5 mL/min;柱温40℃;进样体积5 μL。
1.2.2 质谱分析条件 电喷雾离子源:正离子扫描模式(ESI+);离子源气体(GS1):60 psi;离子源气体(GS2),60 psi;离子喷雾电压:5500 V;气帘气:30 psi;离子源温度:650°C;采用多重反应监测(MRM)方式
1.3 标准溶液的配制
准确称取0.020 4 g呋虫胺至100 mL容量瓶,用甲醇配制成200 μg/mL呋虫胺母液,4℃避光保存备用。将200 μg/mL呋虫胺母液用甲醇稀释成0.005 μg/mL、0.01 μg/mL、0.1 μg/mL、0.5 μg/mL和1 μg/mL系列标准溶液,绘制标准工作曲线,其中y为呋虫胺峰面积,x为标准溶液浓度。
1.4 样品的提取
1.4.1 土壤、糙米 称取10.0 g样品,于50 mL离心管中,加入1.5 g NaCl,加入乙腈提取(土壤30 mL,糙米15 mL),涡旋1 min,离心3 min(6 000 r/min),取1 mL上清液,过0.22 μm滤膜,LC-MS/MS检测。
1.4.2 稻壳、植株 称取5.0 g样品于50 mL离心管中,加入1.5 g NaCl,加入20 mL乙腈,涡旋1 min,离心3 min(6 000 r/min),取1 mL上清液,待净化。
1.5 样品的净化
将1.3节1 mL上清液转移至微型离心管中,加入0.05 g PSA和0.05 g C18,涡旋振荡1 min,与6 000 r/min离心1 min,取上清液,过0.22 μm滤膜,LC-MS/MS检测。
1.6 样品的回收率与精密度测定
空白稻田土壤、糙米、稻壳及植株样品分别作3个不同水平的添加回收率试验。按上述分析方法提取、净化和测定。
2 结果与分析
2.1 质谱条件的确定
呋虫胺的亲水性较强,且在碱性环境中不稳定,故流动相应选择中性或偏酸性环境,因此选择正离子扫描模式。在电喷雾电离模式下对0.5 mg/kg呋虫胺标准溶液以50~250一级质谱扫描,确定呋虫胺母离子质荷比为203.1和响应信号最高时的锥孔电压(DP),然后优化DP,最终确定为51.31 V。以50~220二级质谱扫描,找到呋虫胺2个特征子离子,质荷比分别为113.9和129.0,以丰度较强的子离子129.0定量;优化碰撞电压(CE),最终分别确定为16.49 eV和18.01 eV。
2.2 色谱条件的确定
2.2.1 流动相 在中性流动相条件下,在单一梯度流动相(甲醇∶水)色谱条件下,出峰时间较早且峰形较差,故采用梯度洗脱程序。在采用梯度流动相条件下,流动相为甲醇(0.2%甲酸)∶水(0.1%甲酸)。呋虫胺标准溶液的峰形良好,保留时间为5.55 min(图1)。
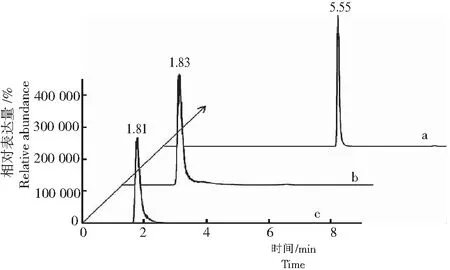
注:a为含甲酸梯度流动相色谱,b为不含酸梯度流动相色谱,c为单一流动相色谱。
Note: a, Chromatography of the mobile phase with formic acid gradient; b, Chromatography of the mobile phase without acid gradient; c, Chromatography of single mobile phase.
图1 不同条件流动相的色谱图
Fig.1 Chromatogram of mobile phase under different conditions
2.2.2 色谱柱 在确定流动相选用酸性条件的情况下,考察C18色谱柱。SB C18色谱柱适用于在pH较低的环境下分离药物且在高含水量流动相中重现性好。鉴于SB C18色谱柱的特点和良好的性能,故选用色谱柱SB-C18(4.6 mm×150 mm,5 μm)。
2.3 净化剂的选择
水稻植株的净化选用不同质量(30 mg和15 mg)GCB 净化时,对呋虫胺均有吸附作用,添加回收率均小于70%,不能满足分析的要求(NY/T 788-2004);选用C18或PSA时,添加回收率均>120%,也不能满足分析的要求;选择50 mg PSA+50 mg C18组合净化时,净化效果较好,且回收率为77.5~99.2%,能满足分析的要求(图2)。
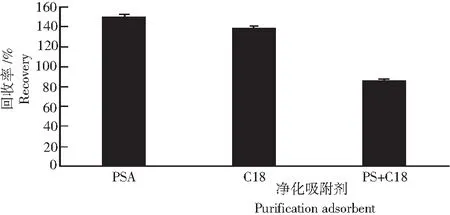
图2 不同吸附剂的回收率
2.4 标准曲线的绘制
在1.2液相色谱/质谱条件下进行测定,呋虫胺的峰面积与其质量浓度间呈线性关系,标准曲线性方程为y=5.17×106x+5.46×105,R2=0.991 3,该方法的最小检出限(LOD)为1.75×10-12g,最小定量限(LOQ)为5.84×10-12g。
2.5 样品的回收率与精密度
由表可见:在0.015~0.4 mg/kg添加水平范围内,稻田土壤、糙米、稻壳以及植株中的平均回收率为77.50%~101.0%,相对标准偏差(RSD,n=5) 为0.60%~4.32%。呋虫胺在稻田土壤、糙米、稻壳以及植株上的验证添加回收包括空白对照、基质加标准溶液和添加回收试验,添加回收色谱较好(图3)。
表 呋虫胺水稻田基质(n=5)中的平均添加回收率
Table Average added recovery of Dinotefuran in paddy soil brown rice, rice hull and rice plant
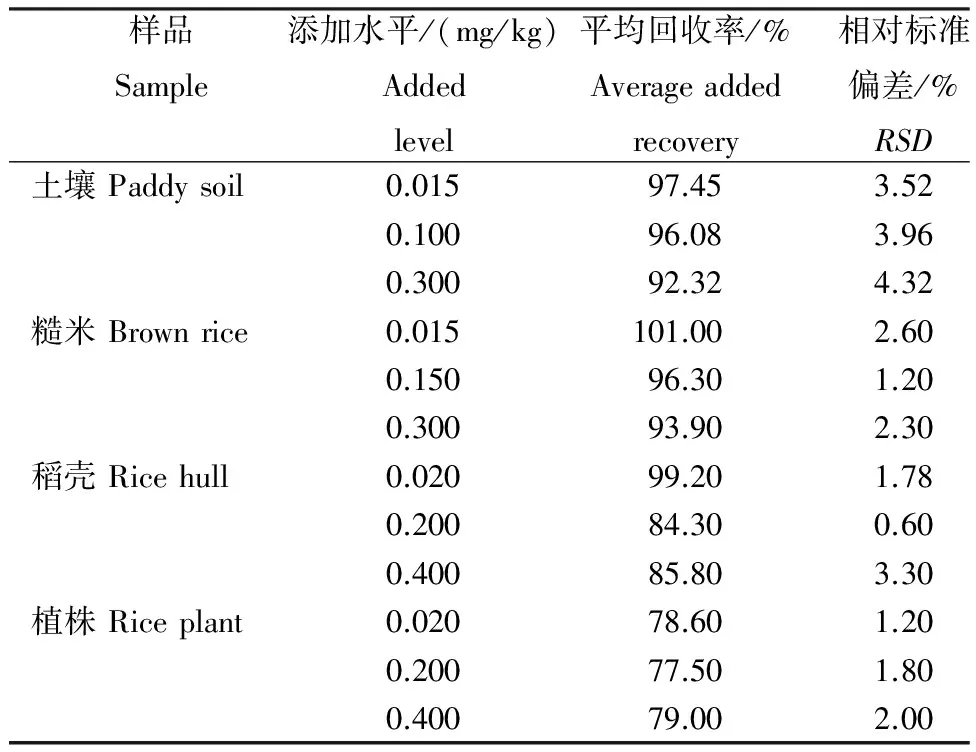
样品Sample添加水平/(mg/kg)Addedlevel平均回收率/%Averageaddedrecovery相对标准偏差/%RSD土壤Paddysoil0.01597.453.520.10096.083.960.30092.324.32糙米Brownrice0.015101.002.600.15096.301.200.30093.902.30稻壳Ricehull0.02099.201.780.20084.300.600.40085.803.30植株Riceplant0.02078.601.200.20077.501.800.40079.002.00
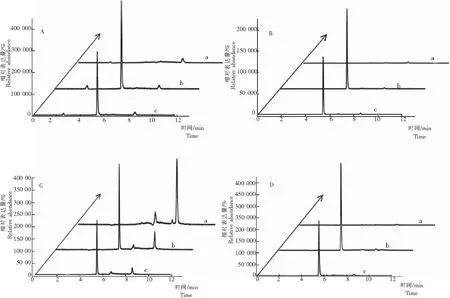
注:A为土壤,B为糙米,C为稻壳,D为植株;a为空白对照,b为基质加标准溶液,c为添加回收液。
Note: A, Paddy soil; B, Brown rice; C, Rice hull; D, Rice plant; a, CK; b, Substrate + standard solution; c, Addition recovery.
图3 水稻田4种基质的添加回收色谱
Fig.3 Addition recovery chromatography of paddy soil, brown rice, rice hull and rice plant
3 小结
目前,针对呋虫胺的分析残留方法研究报道仅见采用高效液相色谱法和超高效液相色谱-串联质谱法[11,14,17],前处理过程中提取方法复杂,净化方法耗时,且操作较为繁琐。本试验通过对水稻田中土壤、糙米、稻壳和植株4种基质的前处理条件、流动相条件、质谱条件等的优化,建立改良的QuEChERS法结合液相色谱-串联质谱(LC-MS/MS)检测水稻田4种基质的呋虫胺残留量的分析方法。该方法前处理操作简单、省时,高效液相-串联质谱法检测,选择性和灵敏度高,为水稻田中呋虫胺和其他新烟碱类杀虫剂的快速定量检测提供依据。
[1] 刘安昌,张 良,谭珍友, 等. 新型烟碱类杀虫剂呋虫胺的合成研究[J]. 世界农药, 2009, 31(2): 22-23.
[2] 赵 聪,杨文革,胡永红,等.呋虫胺及其中间体的合成方法[J].现代农药,2009,8(2):13-19.
[3] 张亦冰.新内吸杀虫剂-呋虫胺[J].世界农药,2003,25(5):46-47.
[4] 吴鸿飞,孙 克,张敏恒.呋虫胺合成方法评述[J].农药,2013,52(1):71-74.
[5] 乙小娟,朱加叶,丁 萍,等.高效液相色谱法快速测定大米中的4种烟碱农药残留量[J].食品科学,2011,132(6):169-172.
[6] Zhiming Xiao,Xiaowei Li,Xiaolin Wang, et al.Determination of neonicotinoid insecticides residues in bovine tissues by pressurized solvent extraction and liquid chromatography tandem mass spectrometry[J].Journal of Chromatography B.2011,879(1):117-122.
[7] 侯如燕,卞红正,赵秀霞,等.固相萃取-液相色谱测定复杂基质蔬菜中9种烟碱类残留[J].分析测试学报,2011,30(1):58-63.
[8] Lina Hem, Abd El-Aty A M, Jong-Hyouk Park, et al. Determination of Dinotefuran in Pepper UsingLiquid Chromatography: Contribution to Safety Evaluation[J]. Journal of the Korean Society for Applied Biological Chemistry, 2012, 55(6): 756-768.
[9] Rahman M M,Park J H,Abd E A,et al.Feasibility and application of an HPLC/UVD to determine dinotefuran and its shorter wavelength metabolites residues in melon with tandem mass confirmation[J].Food chemistry,2013,136(2):1038-1046.
[10] 张小东,龚道新,吴 亮,等.高效液相色谱法测定稻田样品中3中新烟碱类杀虫剂残留[J].农药学学报,2015,17(5):627-632.
[11] 韦 婕,邓 婕,黄慧俐,等.高效液相色谱检测呋虫胺在稻田水和土壤中的残留及消解动态[J].农药学学报,2015,17(2):195-200.
[12] 李 立,付 建,初玉圣,等.食品中呋虫胺残留量的HPLC-MS/MS检测方法研究[J].食品科学,2008,29(11):538-540.
[13] Rahman M M,Abd El-Aty A M,Choi J H,et al.Consequences of the matrix effect on recovery of dinotefuran and its metabolites in green tea during tandem mass spectrometry analysis[J].Food Chemistry,2015,168:445-453.
[14] 张雯雯,徐 军,张 盈,等.超高液相色谱-串联质谱法检测棉花和土壤中呋虫胺残留[J].植物保护,2015,41(2):125-129.
[15] Ying Zhang,Jun Xu,Fengshou Dong, et al.Simultaneous determination of four neonicotinoid insecticides residues in cereals, vegetables and fruits using ultra-performance liquid chromatography/tandem mass spectrometry[J].Analytical Methods,2013,5(6):1449-1455.
[16] Shaoying Liu,Zuntao Zheng,Fanglin Wei,et al.Simultaneous determination of seven neonicotinoid pesticide residues in food by ultraperformance liquid chromatography tandem mass spectrometry[J].Journal of agricultural and food chemistry,2010,58(6):3271-3278.
[17] 彭 莎,杨仁斌,邹 蓉,等.高效液相色谱测定水稻和稻田中呋虫胺残留分析法的建立[J].湖南农业科学,2013(7):79-81.
(责任编辑: 刘忠丽)
Dinotefuran Residue in Paddy Soil, Brown Rice, Rice Hull and Rice Plant Determined by Modified QuEChERS/LC-MS/MS
HAN Xinwei, KANG Di, ZHANG Haizhen, LU Ping, HU Deyu*
(TheCultivationBasisofNationalKeyLaboratoryforGreenPesticideandAgriculturalBioengineering/KeyLaboratoryofGreenPesticideandAgriculturalBioengineering,MinistryofEducation,CenterforResearchandDevelopmentofFineChemicals,GuizhouUniversity,Guiyang,Guizhou550025,China)
The paddy soil, brown rice, rice hull and rice plant samples were first pre-treated with modified QuEChERS, then the rice hull and plant samples were purified by PSA and C18adsorbent and finally the Dinotefuran residue in four samples was detected by LC-MS/MS to discuss the rapid quantitative method of detecting Dinotefuran residue in paddy soil, brown rice, rice hull and rice plant. Results:The average recovery of paddy soil, brown rice, rice hull and rice plant samples is 92.32%~97.45%, 93.90%~101.0%, 84.30%~99.20% and 77.50%~79.00% within the addition range of 0.015~0.4 mg/kg Dinotefuran separately and RSD of paddy soil, brown rice, rice hull and rice plant samples is 3.52%~4.32%, 1.20%~2.60%, 0.60%~3.30% and 1.20%~2.00% respectively. The limit of detection (LOD) and limit of quantitation (LOQ) of the modified QuEChERS/LC-MS/MS is 1.75×10-12g and 5.84×10-12g respectively. The modified QuEChERS/LC-MS/MS with the advantages of simple pretreatment, rapidity, high sensitivity and good repeatability accords with the technical requirement of pesticide detection analysis.
Dinotefuran; LC-MS/MS; rice; residue
2015-02-24; 2016-04-20修回
贵州省重大科技专项“贵州省茶叶、蔬菜质量安全评价、检测和可追溯关键技术研究与应用” [黔科合重大专项字(2013)6024];贵州大学创新基金项目“20%呋虫胺泡腾片在水稻上的残留分析及消解动态研究”(2015048)
韩昕炜(1990-),女,在读硕士,研究方向:农药学。E-mail:18286155960@163.com
*通讯作者:胡德禹(1965-),女,研究员,从事农药分析研究。E-mail:gzu_dyhu@126.com
1001-3601(2016)05-0199-0047-04
S482.3+9
A
