萼脊兰EF1α基因片段的克隆及序列分析
2016-03-01蒋素华王默霏宋彩霞李艳辉
蒋素华, 王默霏, 宋彩霞, 梁 芳, 李艳辉, 崔 波*
(1.郑州师范学院 生物工程研究所, 河南 郑州 450044; 2.河南农业大学 生命科学学院, 河南 郑州 450002; 3.封丘县农业局, 河南 新乡 453300)
萼脊兰EF1α基因片段的克隆及序列分析
蒋素华1, 王默霏1, 宋彩霞2, 梁 芳1, 李艳辉3, 崔 波1*
(1.郑州师范学院 生物工程研究所, 河南 郑州 450044; 2.河南农业大学 生命科学学院, 河南 郑州 450002; 3.封丘县农业局, 河南 新乡 453300)
为探明萼脊兰EF1α基因在生长发育过程中的生理功能和作为内参基因的稳定性及适用性,根据NCBI中植物翻译延长因子同源核苷酸保守序列设计简并引物,以萼脊兰叶片为试验材料,采用RNAprep多糖多酚植物总RNA提取试剂盒提取RNA,利用RT-PCR技术克隆翻译延伸因子EF1α,并进行生物信息学分析。结果表明:EF1α基因长620 bp,编码206 个氨基酸,编码的蛋白为亲水性蛋白,相对分子质量为23.16 KD,等电点为8.50;经二级结构分析,α-螺旋占29.61%,延伸链占31.55%,无规则卷曲占38.83%;亚细胞定位在细胞质;EF1α基因与朵丽蝶兰杂交品种翻译延伸因子蛋白的一致性较高,进化距离最近。在GenBank登录号为KT223116。
萼脊兰;EF1α; 基因克隆; 二级结构
在单子叶植物中,兰科是第二大科。萼脊兰(Sedireajaponica) 为兰科(Orchidaceae)萼脊兰属(Sedirea),萼脊兰的花小而素雅,其花色典雅且具有迷人的芳香,观赏期较长,养护简单,且耐寒[1-2]。萼脊兰的茎被宿存的叶鞘所包,叶片长圆形、倒卵形或披针形,苞片为凹的宽卵形,淡褐色,花梗以及子房长为18 mm左右;花香与橘子香相似,有萼片,花瓣椭圆形,细圆柱形的蕊柱,花期一般为6月[3-4]。
蛋白质的生物合成是十分复杂又普遍的生命现象,蛋白质合成分为起始阶段、延伸阶段和终止阶段[5-6]。蛋白质的生物合成需要许多生物大分子参与,如启动子、终止子、核糖体、氨酰合成酶、信使RNA、tRNA和延伸因子等[7]。植物蛋白质合成延伸因子有EF1和EF2,其通过在核糖体上催化氨基酸链的延伸而推动和控制蛋白质的合成,在植物生长代谢过程中发挥重要作用[8-10]。EF1α是主要的翻译因子之一,调控蛋白质的翻译过程,基因表达及调控非常保守,几乎存在于每个细胞内,仅次于肌动蛋白,在真核生物体内属于数量较多的一类蛋白。目前,许多植物中都可以克隆得到EF1α,如油桐、油棕、玉米、拟南芥、苹果、沙梨、碧桃、可可树、中果咖啡、亚麻芥、金丝小枣、甘蔗、棉花、玫瑰和水稻等植物[11-13]。
在蛋白质合成中起重要作用的延伸因子是一种多功能的蛋白因子[14-15]。其还与细胞生长与增殖速度有关,除参与翻译控制[16]、应激反应、细胞生长和运动性有关的信号传导[17]外,还可与细胞结构结合[18],如细胞骨架和有丝分裂装置等,与细胞骨架的结合可以显著提高蛋白质的翻译[19-20]。但有研究发现,eEF1A在香蕉果实采摘后的不同时期以及在香蕉不同器官中的表达均有差异,即其在细胞中的表达并不是恒定不变,在不同的生理状态下,不同细胞类型中都有差异[21]。因此,研究萼脊兰的内参基因显得尤为重要。而在萼脊兰相关基因的研究中,对萼脊兰内参基因的研究尚未见报道。笔者采用萼脊兰叶片为材料,利用RT-PCR的方法,克隆萼脊兰的EF1α基因序列,并进行生物信息学分析,以期为下一步萼脊兰相关基因的表达分析奠定基础。
1 材料与方法
1.1 试验材料
萼脊兰由郑州师范学院兰花工程技术中心的智能日光温室培养。
1.2 试验试剂
氨苄青霉素、IPTG、X-Gal、DH5α感受态细胞和pMD19-T载体购自TaKaRA公司,凝胶回收试剂盒和RNAprep多糖多酚植物总RNA提取试剂盒购自天根试剂公司,LB固体/液体培养基为实验室保存配制试剂。
1.3 萼脊兰EF1α基因的克隆
1.3.1 RNA的提取及检测 将萼脊兰叶片在液氮中研磨,用RNAprep多糖多酚植物总RNA提取试剂盒提取其总RNA,采用琼脂糖凝胶电泳鉴定RNA的完整性,采用Quawell Q5000微量紫外可见分光光度计测定总RNA的A260/A280值和A260/A230值,同时测定其浓度。
1.3.2 cDNA的合成 反转录参照RevertAid TM First strand cDNA synthesis Kit说明书合成第1链cDNA,并于-20℃保存。
1.3.3EF1α基因RT-PCR扩增 以NCBI中已登录的其他植物翻译延伸因子同源DNA保守序列为参考,采用primer5.0设计1对克隆萼脊兰EF1α基因的简并引物:EF1aF,5′-ACATCAACATYGTGGTCATTGG-3′;EF1aR,5′-GCCYTTGTACCA
GTCAAGGTTG-3′。将设计的引物送到上海英俊生物技术公司合成。以萼脊兰cDNA为模板进行PCR扩增。反应体系:10×PCR buffer 2.0 μL,dNTP(2.5 μmol/L)1.6 μL,MgCl2(25 μmol/L)1.5 μL,F、R引物(10 μmol/L)各1.0 μL,TaqDNA聚合酶(5 U/μL)0.2 μL,模板cDNA1.0 μL,定量补足ddH2O至20 μL。反应条件:95℃预变性3 min,95℃变性30 s,58.5℃复性30 s,72℃延伸40 s,35个循环,最后72℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳后,切下目的条带,按照凝胶回收试剂盒说明回收。
1.3.4 重组质粒的构建 取3 μL回收产物连接至pGEM-Teasy vector,构建重组质粒,将重组质粒转化大肠杆菌DH5α感受态细胞,涂布在含有50 mg/L氨苄青霉素、IPTG和X-Gal的LB固体培养基上,置于37℃培养箱培养12 h,蓝白斑筛选重组子。
1.3.5 重组质粒的鉴定和测序分析 挑取单克隆摇菌扩增,进行PCR鉴定,最后将阳性单克隆送上海英骏生物技术公司测序。序列分析使用http://www.expasy.org和http://www.bioinfo.tsinghua.edu.cn/SubLoc/在线分析软件,序列的检索使用GenBank的Blast(http:// www. ncbi. nlm. nih. gov/blast/),系统进化树采用MEGA4.0 软件中的NJ法构建系统树。
2 结果与分析
2.1 萼脊兰EF1α基因的RNA 完整性和基因克隆
由图1可见,萼脊兰总RNA溶液普通琼脂糖凝胶电泳显示,28S、18S和5S条带清晰,28S条带的亮度大约是18S的2倍,OD260/280为1.8~2.1,RNA浓度为407.59 ng/μL。表明,提取的总RNA完整性较好,能够进行下一步RT-PCR扩增。由图2可见,cDNA经PCR扩增得到620 bp左右的片段,将图2目的条带切胶回收、培养和扩增,并电泳检测,将检测正确的单菌落测序,经过BLAST分析,测序结果正确,证明EF1α基因克隆成功。
2.2 萼脊兰EF1α基因的序列比较
该片段的核苷酸序列与其他植物EF1α基因的核苷酸序列的同源性均在80%~85%,与其他植物氨基酸序列同源性也均在99%以上,反映出该基因在进化上较为保守,表明已克隆EF1α基因的部分cDNA序列,在NCBI上对EF1α编码的蛋白质进行比对结果(图3)显示,该蛋白属于延长因子1-alpha(EF1-alpha)蛋白家族,ABC-ATPase超家族。克隆的EF1α基因在GenBank注册后登录号为KT223116。
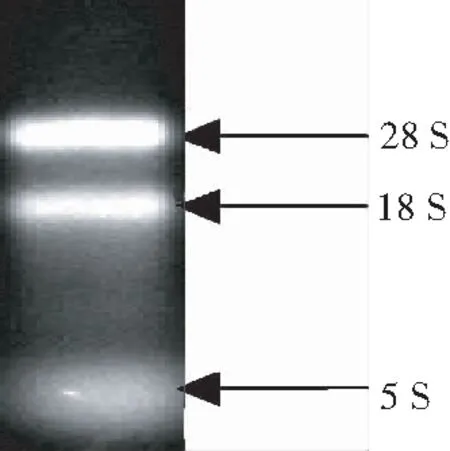
图 1 萼脊兰EF1α基因的总RNA
Fig.1 Total RNA extracted from geneEF1αfromS.japonica
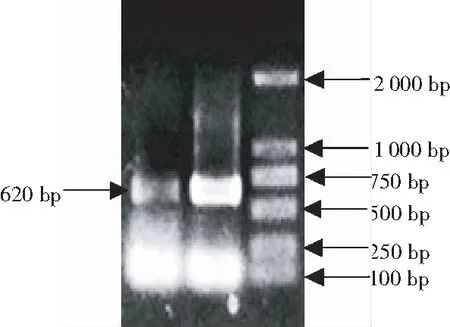
注:M, DNA Marker 2 000; 1~2, SeAP1-like基因。
Note: M, DNA Marker 2 000; 1~2, SeAP1-like gene.
图 2 萼脊兰EF1α基因克隆
Fig.2 Gene clone ofEF1αfromS.japonica

图3 萼脊兰EF1α 基因的功能域
2.3 萼脊兰EF1α基因编码蛋白质的理化性质与二级结构
EF1α编码编码蛋白的分子量为23.16 KD,其中含量最丰富的氨基酸为赖氨酸(Lys)21 个,约占10.2%,其次是异亮氨酸(Ile)20 个,约占9.7%。带负电的氨基酸(Asp+Glu)总共27 个、带正电荷(Arg+Lys)的氨基酸总共30 个,等电点为8.50。由图4可见,其二级结构主要有4种形式组成,α-螺旋(Alpha helix)占29.61%,延伸链(Extended strand)占31.55%,无则卷曲(Random coil)占38.83%。

注:H, α-螺旋;e, 延伸链;c,无则卷曲。
Note: H, alpha helix; e, extended strand; c, random coil.
图 4 萼脊兰EF1α 蛋白的二级结构
Fig.4 Protein secondary structure analysis of EF1α fromS.japonica
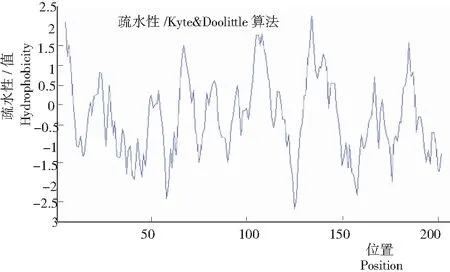
图 5 萼脊兰 EF1α氨基酸序列的亲水性

图6 萼脊兰EF1α 的进化树
2.4 萼脊兰EF1α基因编码蛋白质的亲水性/疏水性与亚细胞定位在http://web.expasy.org/protscale/对EF1α编码的蛋白分析(图5)发现,平均亲水系数为-0.311,蛋白其编码的氨基酸序列属于亲水蛋白。在http://www.bioinfo.tsinghua.edu.cn/SubLoc/上对其进行预测发现可能的位点在细胞质,进一步说明EF1α是翻译延伸因子。
2.5 萼脊兰EF1α基因的进化树如图6所示,萼脊兰EF1α所编码的蛋白与朵丽蝶兰杂交品种的蛋白同属一个分支,进化的同源性最高。
3 结论与讨论
EF1α高度保守,分布广泛,但并不是简单的内参基因,还是一类具有多种生物学功能的重要调控蛋白,延伸因子参与蛋白合成、细胞调控和植物抗逆,研究延伸因子对植物发育和植物抗逆有重要意义,也为改良作物品质、提高作物抗逆水平提供研究基础。因此,对EF1α生物学功能的研究具有重要的应用价值,为植物生理过程的研究和生产应用打开新思维。笔者研究克隆了萼脊兰的EF1α基因片段,与其他植物EF1α基因的核苷酸序列的同源性均在80%~85%,与其他植物氨基酸序列同源性也均在99%以上,反映出该基因在进化上较为保守;蛋白质分析该蛋白属于延长因子1-alpha(EF1-alpha)蛋白家族,ABC-ATPase超家族;属于亲疏水性蛋白,系统树的进化分析发现,萼脊兰EF1α编码的蛋白与朵丽蝶兰杂交品种的蛋白同属一个分支,进化的同源性最高。
在很多植物中通过克隆得到延伸因子EF1α,如苹果、碧桃、沙梨、玉米和水稻等[22-23],由于延伸因子表达比较稳定,近几年在许多文献中都有以EF1α作为植物重要的内参基因,如香蕉延伸因子1A基因的分离及特征分析[24-25],独行菜Eef-1α基因片段分离克隆及RT-PCR分析[26],本研究克隆并分析了EF1α基因,目的是研究其作为内参基因在萼脊兰不同组织中的表达量是否一致,若一致并表达稳定,可将其列为看家基因。
本研究填补了萼脊兰内参基因的空白,增加了EF1α基因研究领域,内参基因的表达在不同类型的细胞、组织中并不完全相同,在不同的试验条件下的表达也不相同,因此选择合适的内参基因显得尤为重要,合适的内参基因的选择,需要不同细胞和组织在各种试验条件下进行比较[27-28]。近年来,随着RACE和实时荧光定量PCR技术的发展与成熟,全长功能基因被克隆与分析,基因相对表达量的研究也越来越受到关注,随之内参基因的研究也成为热点研究对象,延伸因子EF1α是否能够成为萼脊兰生长发育和生理过程的内参标准,还需进一步研究。
[1] 陈心启,吉占和.中国兰花全书[M].北京:中国林业出版社,1998:30-59.
[2] 卢思聪.中国兰与洋兰[M].北京:金盾出版社,1994:80-160.
[3] 陈心启.中国野生兰科植物彩色图鉴[M].北京:科学出版社,1999:120-136.
[4] 麦 奋.兰花育种其乐无穷[J].中国花卉园艺,2002(9):20-21.
[5] 程 君,芮耀诚.真核延长因子eEFIA功能研究进展[J].药学实践杂志,2012,30(2):89-91,124.
[6] 陈建中,戴 剑,章 镇,等.黄羽扇豆翻译延伸因子2的序列分析[J].中国农业科学2002,35(1):102-105.
[7] 周 冰,曹 诚,刘 传.翻译延伸因子1A的研究进展[J].生物技术通讯,2007,18(2):281-284.
[8] 覃迎姿,黄先益,叶兴枝,等.植物延伸因子eEFlA研究进展[J].广西农业科学,2009,40(5):472-477.
[9] 孙 伟,李 燕,赵彦修,等.盐地碱蓬延伸因子(SsEF-α)的克隆与表达分析[J].西北植物学报,2004,24(9):1657-1661.
[10] Wang A Q,Qin Y Z,Ye x z,et al. Molecular cloning and tissue specific expression of an elongation factor IA gene in sugarcane stalks[J].Sugar Tech,2008,10(2):119-123.
[11] 董晓丽,王加启,卜登攀,等.内参基因在实时定量PCR中应用的研究进展[J].中国畜牧兽医,2006,36(9):83-85.
[12] Kavaliauskas D,Nissen P,Knudsen C R.The busiest of all ribosomal assistants:elongation factor Tu[J].Biochemistry,2012,51(13):2642-2651.
[13] Sasikumar A N,Perez W B,Kinzy T G. The many roles of the eukaryotic elongation factor 1 complex[J].Wiley Interdisciplinary Reviews:RNA,2012,3(4):543-555.
[14] Kim S,Coulombe P A.Emerging role for the cytoskeleton as an organizer and regulator of translation[J].Nature Reviews Molecular Cell Biology,2010,11(1):75-81.
[15] Gross S R,Kinzy T G. Translation elongation factor 1A is essential for regulation of the actin cytoskeleton and cell morphology[J].Nature Structural and Molecular Biology,2005,12(9):772-778.
[16] Pittman Y R,Kandl K,Lewis M,et al.Coordination of eukaryotic translation elongation factor 1A(eEF1A)function in actin organization and translation elongation by the guanine nucleotide exchange factor eEF1Bα[J].Journal of Biological Chemistry,2009,284(7):4739-4747.
[17] Yue J,Shukla R,Accardi R,et al.Cutaneous human papillomavirus type 38 E7 regulates actin cytoskeleton structure for increasing cell proliferation through CK2and the eukaryotic elongation factor 1A[J].J Virol,2011,85(17):8477-8494.
[18] Li H T,Su Y P,Cheng T M,et al.The interaction between interferon-induced protein with tetratricopeptide repeats-1 and eukaryotic elongation factor-1A[J]. Molecular and Cellular Biochemistry,2010,337(1/2):101-110.
[19] Chang R Y,Eugenia W.Mouse translation elongation factor eEF1A-2 interacts with Prdx- I to protect cells against apoptotic death induced by oxidative stress[J].Journal of Cellular Biochemistry,2007,100(2):267-278.
[20] Murthi A,Shaheen H H,Huang H Y,et al.Regulation of tRNA bidirectional nuclear-cytoplasmic trafficking in Saccharomyces cerevisiae[J].Molecular biology of the cell,2010,21(4):639-649.
[21] 赵丽娟,袁彬青,王秀珍,等.橡胶延伸因子REF基因的克隆、转化及功能分析[J].西北农业学报,2015,21(1):144-150.
[22] 王志敏,牛 义,许俊强,等.结球甘蓝花粉蛋白延伸因子基因的克隆及其序列分析[J].园艺学报,2013,40(10):1990-1998.
[23] 林淑芳,帅凌飞,袁 媛,等.黄芩延长因子1a基因全长cDNA的克隆及其功能[J].中国实验方剂学杂志,2011,57(20):126-128.
[24] 陈 燕,王伟倩,张红莉,等.拟南芥翻译延伸因子EF1A的亚细胞定位研究[J].河南师范大学学报:自然科学版,2015,43(1):106-109,115.
[25] 李 东,吴先军,陈 新.热胁迫下丹参迷迭香酸代谢途径关键酶基因的表达研究[J].核农学报,2012,26(1):60-67.
[26] Li Zh H,Pogany J,Panavas T,et al.Translation elongation factor 1A is a component of the tombusvirus replicase complex and affects the stability of the p33 replication co-factor[J].Virology,2009,385(1):245-260.
[27] 苏慧慧,李 涛,黎振兴,等.番茄GRX基因家族的鉴定及表达分析[J].核农学报,2015,29(4):663-673.
[28] 高 爽,查笑君,潘建伟.真核翻译延伸因子eEF1A功能研究进展[J].浙江师范大学学报:自然科学版,2013,36(4):444-449.
(责任编辑: 刘忠丽)
Cloning and Sequence Analysis of GeneEF1αfromSedireajaponica
JIANG Suhua1, WANG Mofei1, SONG Caixia2, LIANG Fang1, LI Yanhui3, CUI Bo1*
(1.InstituteofBioengineering,ZhengzhouNormalCollege,Zhengzhou,Henan450044; 2.CollegeofLifeScience,HenanAgriculturalUniversity,Zhengzhou,Henan450002; 3.FengqiuBureauofAgriculture,Xinxiang,Henan453300,China)
To explore geneEF1αin the process of growth and development, physiological functions and lay a foundation as internal genetic stability and applicability,EF1αofS.japonicawas cloned and sequence analyzed. According to the NCBI login plant translation elongation factor homologous conserved sequences of nucleotide primers to design degenerate primers,S.japonicaleaves as experimental materials, RNAprep pure plant kit was used to extract RNA, and use RT-PCR technology to clone the translation elongation factorEF1a. Through a series of bioinformatics analysis, the results showed that the gene sequence was 620 bp, encoding 206 amino acid residues, was a hydrophilic protein, molecular weight was 23.16 KD, isoelectric point was 8.50. Secondary structure analysis showed that the alpha helix occupied 29.61%, extended strand accounted for 31.55%, Random coil accounted for 38.83%. Subcellular located in cytoplasm. Protein sequence and phylogenetic analysis showed that it had high consistency and short evolutionary distance with theDoritaenopsishybrids of translation elongation factor protein. The authors registered them into GenBank (respective accession number: KT223116 ).
Sedireajaponica;EF1α; gene clone; secondary structure
2015-10-29; 2016-04-22修回
河南省科技攻关项目“蝴蝶兰的分子育种”(092102110128);郑州市普通科技攻关项目“蝴蝶兰新品种选育研究”(141PPTG G420)
蒋素华(1983-),女,讲师,硕士,从事花卉分子生物学研究。E-mail:jiangsuhua2006@163.com
*通讯作者:崔 波(1962-),男,研究员,博士,从事花卉分子生物学研究。E-mail:laocuibo@163.com
1001-3601(2016)05-0189-0005-04
S685; Q789
A
