基因沉默白介素8对激素非依赖前列腺癌干细胞的生物特性的影响
2016-02-29孙梦奎张纪恒
孙梦奎 张纪恒 崔 韵 金 杰
作者单位:100034 北京大学第一医院
基因沉默白介素8对激素非依赖前列腺癌干细胞的生物特性的影响
孙梦奎张纪恒崔韵金杰
作者单位:100034 北京大学第一医院
【摘要】目的探讨小干扰RNA沉默激素非依赖前列腺癌DU145细胞白介素8基因对肿瘤干细胞生物学特性及耐药性的影响。方法用不同剂量的小干扰RNA沉默激素非依赖前列腺癌DU145细胞IL-8基因,应用流式仪检测ALDH阳性细胞比例的变化。采用悬浮细胞成球和克隆形成实验分别观察肿瘤干细胞自我更新和体外成瘤能力的变化。Annexin V-PE/7-AAD细胞凋亡双染试剂盒检测细胞凋亡率的变化,Western-blot法分析Akt蛋白的变化。结果DU145细胞IL-8基因的沉默能降低肿瘤干细胞的比例,显著降低肿瘤干细胞悬浮细胞成球率和克隆形成率。多西他赛能显著抑制IL-8基因沉默DU145细胞的活性。Western-blot显示Akt的磷酸化被显著抑制。结论IL-8基因的沉默能显著抑制激素非依赖前列腺癌干细胞的自我更新和体外成瘤能力,增加该群细胞对多西他赛的化疗敏感性,同时显著抑制了Akt的磷酸化,这可能是IL-8基因沉默抑制该群细胞干细胞特性的作用机制之一。
【关键词】IL-8;DU145;肿瘤干细胞;Akt
(ThePracticalJournalofCancer,2016,31:191~194)
有研究表明IL-8在激素非依赖前列腺癌中高表达,而在激素敏感前列腺癌和正常前列腺上皮中低表达[1]。有报道称白细胞介素8(interleukin-8,IL-8)能够促进肝癌干细胞的生长,促进神经胶质瘤干细胞的转移,阻断IL-8能够很有效的杀伤乳腺癌干细胞[2-4]。本实验将通过小干扰RNA沉默前列腺癌细胞IL-8基因,观察肿瘤干细胞比例、干细胞特性、化疗敏感性的变化以及出现该现象的潜在机制,为激素非依赖前列腺癌的临床治疗提供一定的参考。
1材料与方法
1.1 激素非依赖前列腺癌细胞系
激素非依赖前列腺癌细胞株DU145购于ATCC(American Type Culture Collection)公司。细胞培养于10%胎牛血清的RPIM-1640培养基(Hyclone公司)中,添加青霉素 100 IU/mL、链霉素 100 IU/mL。
1.2 试剂与仪器
IL-8 siRNA购于苏州吉玛公司,ALDEFLUORTM试剂盒购于STEMCELL公司,Annexin V-PE/7-AAD细胞凋亡双染试剂盒购于南京凯基生物科技有限公司,CCK-8购于日本东仁公司,CD44、Oct4、IL-8、GAPDH抗体购于美国CST公司,极低黏附培养板购于美国康宁公司,流式仪(FAS Scan,Becton Dickinson,美国),酶标仪(Thermo公司,美国)。
1.3 主要方法
1.3.1siRNA转染IL-8 siRNA有效序列为:上游:5’-GCCAGAUGCAAUACAAGAUTT-3’下游:5’-AUCCUUGUAUUGCAUCUGGCTT-3’,阴性对照组(negative control,NC),序列为:上游:5’-UUCUCCGAACGUGUCACGUTT-3’,下游:5’-ACGUGACACGUUCGGAGAATT-3’。细胞接种于含10%胎牛血清的RPIM 1640培养液中,置于37 ℃、5% CO2培养箱中常规培养,使用INTERFERINGTM试剂转染(Polyplus Transfection,法国),按试剂盒操作说明优化转染条件,分别将IL-8 siRNA以20、40和80 nM的终浓度加入DU145细胞培养液,转染48 h以后,细胞用于其它功能实验。
1.3.2流式仪鉴定和分选前列腺癌肿瘤干细胞胰酶消化不同浓度转染后的DU145细胞,2 000 rpm/min水平离心5 min,弃上清,用磷酸盐缓冲液重悬,使细胞浓度达到106个/mL。按5 μL/mL的浓度加入Aldefluor的底物与离心管中,对二乙氨基苯甲醛(DEAB)为阴性对照组。混合均匀,37 ℃培养30 min,2 000 rpm/min,离心5 min,弃上清液,Aldefluor缓冲液重悬细胞,上机检测与分选。
1.3.3悬浮细胞成球实验操作方法如以前文章报道[5],即分选后的DU145细胞,以5×103个/孔的细胞密度接种在极低黏附6孔板,每孔加入4 mL的无血清DMEM/F12培养基、2% B27(Invitrogen)、20 ng/mL 表皮生长因子(EGF)、20 ng/mL 碱性成纤维细胞生长因子(bFGF)(Peprotech)。10天以后,计数大于20个细胞的悬浮细胞球,悬浮细胞成球率(%)=(悬浮细胞球数/接种细胞数)×100%。
1.3.4克隆形成实验分选后的DU145细胞,以500个/孔接种于普通6孔板,细胞培养在10%FBS的RPIM-1640培养基中。10天后,细胞用4%多聚甲醛固定,0.5%结晶紫染色。计数大于50个细胞的克隆数,克隆形成率(%)=(形成克隆数/接种细胞数)×100%。
1.3.5细胞活性检测用40 nM siRNA和Scramble siRNA转染DU145细胞,24 h后用流式仪分选出ALDH+细胞,各组分别以5×103个/孔的密度接种到96孔板中,并给予DMSO、1 nM、2 nM、4 nM、8 nM多西他赛处理72 h,然后每孔加入10 μL的CCK-8试剂和100 μL的新鲜培养基混合液。在37 ℃孵育1 h后,于波长450 nm处用酶标仪测定光密度(OD)值。细胞活性(%)=(siIL-8组OD值/对照组OD值)×100%。
1.3.6Western Blot以RIPA裂解细胞获得裂解液,等量蛋白采用12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后电转到聚偏氟乙烯膜上,5%脱脂牛奶常温封闭2 h,加入一抗,4 ℃过夜,TBST洗膜3次,每次5 min,二抗常温孵育1 h,ECL化学发光和曝光显影。其中一抗效价是1∶1 000~1∶2 000,选择对照为GAPDH。
1.4 统计学方法
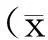
2结果
2.1 DU145细胞株中肿瘤干细胞的分选和鉴定
DU145细胞系中,运用流式细胞分选技术检测ALDH+的细胞比例为(3.32±0.42)%(图1)。

图1 DU145细胞株前列腺癌干细胞的分选
2.2 IL-8 siRNA降低肿瘤干细胞的比例
IL-8 siRNA能显著抑制IL-8基因的表达。20 nM、40 nM、80 nM siRNA处理DU145细胞后,前列腺癌干细胞的比例依次降低到(2.43±0.13)%、(1.56±0.12)%、(0.84±0.07)%(图2)。

图2 基因沉默IL-8对DU145细胞株肿瘤干细胞比例的影响
2.3 IL-8 siRNA增强前列腺癌干细胞对多西他赛的敏感性
相比阴性对照组,多西他赛能显著抑制基因敲除组的细胞活性(图3)。

图3 基因沉默IL-8影响肿瘤干细胞对多西他赛
2.4 IL-8 siRNA抑制了Akt的磷酸化
分选的ALDH+细胞,用不同浓度的siRNA转染48 h,发现IL-8 siRNA能抑制Akt蛋白的磷酸化,总Akt蛋白无明显变化,见图4。

图4 基因沉默IL-8抑制肿瘤干细胞中Akt的磷酸化
2.5 IL-8 siRNA抑制前列腺癌干细胞的自我更新和体外成瘤能力
IL-8 siRNA能显著抑制前列腺癌干细胞的干细胞特性,20 nM、40 nM和80 nM siRNA处理ALDH+的DU145细胞后,其悬浮细胞成球率依次降低为(8.67±0.34)%、(5.39±0.41)%和(4.22±0.22)%(图5a),其细胞克隆形成率降低为(10.87±0.57)%、(6.17±1.04)%和(5.19±0.20)%(图5b)。

图5 基因沉默IL-8对前列腺癌干细胞悬浮成球和克隆形成能力的影响
3讨论
激素非依赖期前列腺癌细胞能分泌IL-8,但是激素依赖期前列腺癌细胞和正常前列腺上皮细胞则不分泌。在前列腺癌中,乙醛脱氢酶(ALDH)的活性可以作为鉴定肿瘤干细胞的标志物。通过流式仪检测,我们发现DU145细胞中包含有一群ALDH+的细胞。其能高表达干细胞标记物CD44和Oct4。在无血清低黏附培养环境下,肿瘤干细胞和正常干细胞具有极强的稳定性,能形成悬浮细胞球,而非干细胞则不能存活。相比ALDH-细胞,ALDH+细胞具有很强的悬浮成球能力。本实验结果与之前报道一致,验证了ALDH+细胞具有很强的肿瘤干细胞特性,可以作为前列腺癌肿瘤干细胞的标志物[6]。同时我们发现IL-8蛋白在ALDH+细胞中的表达量明显高于ALDH-群。
为了探究IL-8与激素非依赖前列腺癌干细胞的关系,本实验用小干扰RNA沉默DU145细胞系,发现ALDH+细胞的比例明显下降。为了更进一步的探讨IL-8基因敲除对肿瘤干细胞的干细胞特性如自我更新和体外成瘤能力的影响,通过悬浮细胞成球和克隆形成实验,我们发现沉默IL-8基因,能显著抑制ALDH+细胞的自我更新和成瘤能力。
肿瘤干细胞能高表肿瘤耐药相关基因,因此对常规化疗药物并不敏感。通过细胞活性检测,IL-8基因沉默的前列腺癌干细胞对多西他赛的敏感性显著增强。
PI3K/Akt信号通路在维持前列腺癌干细胞的稳定性中起到非常重要的作用[7],同时PI3K/Akt也是IL-8参与肿瘤细胞的生存、血管生成和细胞迁徙的重要的下游通路[8]。我们发现,沉默IL-8基因,抑制了Akt的激活。这说明PI3K/Akt信号通路是IL-8参与维持激素非依赖前列腺癌干细胞稳定性的通路之一。
综上所述,沉默肿瘤细胞IL-8基因,能显著的清除激素非依赖前列腺癌肿瘤干细胞,明显抑制肿瘤干细胞的自我更新和成瘤能力,增加其对多西他赛的化疗敏感性。其机制可能是通过抑制PI3K/Akt通路。这个实验的结果证明IL-8基因沉默能靶向清除激素非依赖前列腺癌干细胞,增加对西他赛的化疗敏感性,为前列腺癌的临床治疗提供参考。
参考文献
[1]Murphy C,Mcgurk M,Pettigrew J,et al.Nonapical and cytoplasmic expression of interleukin-8,CXCR1,and CXCR2 correlates with cell proliferation and microvessel density in prostate cancer〔J〕.Clin Cancer Res,2005,11(11):4117-4127.
[2]Park SY,Han J,Kim JB,et al.Interleukin-8 is related to poor chemotherapeutic response and tumourigenicity in hepatocellular carcinoma〔J〕.Eur J Cancer,2014,50(2):341-350.
[3]Infanger DW,Cho Y,Lopez BS,et al.Glioblastoma stem cells are regulated by interleukin-8 signaling in a tumoral perivascular niche〔J〕.Cancer Res,2013,73(23):7079-7089.
[4]Ginestier C,Liu S,Diebel ME,et al.CXCR1 blockade selectively targets human breast cancer stem cells in vitro and in xenografts〔J〕.J Clin Invest,2010,120(2):485-497.
[5]Li B,Cheng XL,Yang YP,et al.GRP78 mediates radiation resistance of a stem cell-like subpopulation within the MCF-7 breast cancer cell line〔J〕.Oncol Rep,2013,30(5):2119-2126.
[6]van den Hoogen C,van der Horst G,Cheung H,et al.High aldehyde dehydrogenase activity identifies tumor-initiating and metastasis-initiating cells in human prostate cancer〔J〕.Cancer Res,2010,70(12):5163-5173.
[7]Dubrovska A,Kim S,Salamone R J,et al.The role of PTEN/Akt/PI3K signaling in the maintenance and viability of prostate cancer stem-like cell populations〔J〕.Proc Natl Acad Sci USA,2009,106(1):268-273.
[8]Waugh DJ,Wilson C.The interleukin-8 pathway in cancer〔J〕.Clin Cancer Res,2008,14(21):6735-6741.
(编辑:吴小红)
Effect of Interleukin-8 Silencing on Androgen-independent Prostate Cancer Stem Cells
SUNMengkui,ZHANGJiheng,CUIYun,etal.PekingUniversityFirstHospital,Beijing,100034
【Abstract】ObjectiveTo explore the effect of IL-8 silencing via small interfering RNA on androgen-independent prostate cancer stem cells and drug sensitive.MethodsDU145 cells transfected with different concentration of IL-8 siRNA were collected.The percentage of ALDH+cells were detected by flow cytometry.The sphere formation rate and cloning efficiency were determined by sphere formation assay and clonogenic assay.The viability of cells was detected by CCK-8 assay.The phosphorylation of Akt was evaluated by Western blot.ResultsThe percentage of ALDH+cells were declined under different concentration of IL-8 siRNA in DU145 cells.Sphere formation rate and cloning efficiency of prostate cancer stem cells were decreased by siRNA.The viability of IL-8 silencing DU145 cells was significantly suppressed compared with control groups and the Akt phosphorylation was activated.ConclusionIL-8 siRNA can eliminate androgen-independent prostate cancer stem cells and suppresses the self-renew and clonogenic capacity of prostate cancer stem cells.IL-8 silencing sensitizes prostate cancer stem cells to docetaxel and inactivates the Akt pathway.
【Key words】IL-8;DU145;Cancer stem cell;Akt
(收稿日期2015-03-19修回日期 2015-12-12)
中图分类号:R737.25
文献标识码:A
文章编号:1001-5930(2016)02-0191-04
DOI:10.3969/j.issn.1001-5930.2016.02.005
通讯作者:金杰
