SLC1A5在结直肠癌中的表达及与其转移的关系
2016-02-26刘婷
刘 婷
作者单位:101200 北京市平谷区医院
SLC1A5在结直肠癌中的表达及与其转移的关系
刘婷
作者单位:101200 北京市平谷区医院
【摘要】目的分析溶质载体家族1成员5(SLC1A5)蛋白在原发性结直肠癌组织和癌旁正常黏膜组织中的表达情况及其与结直肠癌临床病理参数的关系。方法应用组织芯片和免疫组化的方法,检测80例原发性结直肠癌组织和35例癌旁正常组织中SLC1A5的表达,分析SLC1A5表达与结直肠癌临床病理参数的相关性。结果SLC1A5在80例结直肠癌患者癌组织标本中的阳性表达率(88.75%)高于35例癌旁正常组织中阳性表达率(42.86%)(P<0.05)。SLC1A5高表达与结直肠癌患者是否存在远处转移有关(P<0.05)。但癌组织中SLC1A5的表达水平与患者性别、年龄、T分期、N分期和分化程度无明显相关性(P>0.05)。结论SLC1A5可能是一个促进肿瘤远处转移的因子。
【关键词】溶质载体家族1成员5;结直肠肿瘤;肿瘤转移
(ThePracticalJournalofCancer,2016,31:047~049)
结直肠癌是消化系统常见的恶性肿瘤,近年来其发病率快速增长,严重危害人类及健康。因此,寻找到一种能够早期诊断远处转移的标记物对转移性结直肠癌的综合治疗非常重要的。
溶质载体家族1成员5(SLC1A5),是氨基酸转运系统中重要的成员。多位学者在研究中发现SLC1A5在多种肿瘤中呈异常高表达[1-4],并通过反义RNA干扰、化学药物阻断等手段取得了可喜的实验结果[5]。目前,有关SLC1A5在结直肠癌方面的文献报道尚少,因此,我们采用免疫组化及组织芯片检测方法检测结直肠癌组织中的表达情况,并分析其与结直肠癌临床参数及预后的相关性,初步探讨其在结直肠癌发生发展的作用。
1材料与方法
1.1 病例资料
随机收集北京市平谷区医院2001年-2006年结直肠癌病例组织石蜡标本80例,其中结直肠癌组织80例,癌旁正常组织35例(距离肿瘤边缘5cm以上)。所有肿瘤组织标本和癌旁正常黏膜组织通过HE染色被证实。80例肿瘤患者中,男性45例,女性35例;年龄30~70岁,平均年龄60.07岁;淋巴结转移阳性34例,淋巴结转移阴性46例;无远处转移65例,远处转移15例,其中肝转移10例,肺转移2例,骨转移2例,颅骨转移1例。80例结直肠癌中Ⅰ期23 例,Ⅱ期24 例,Ⅲ期18 例,Ⅳ期15 例(按照2009年国际抗癌联盟制定的第7版TNM分期标准)。所有患者均未接受过术前放化疗,临床病理及随访资料包括性别、年龄、分化程度、TNM分期[根据肿瘤(T)、淋巴结(N)和转移(M)情况的分类法]。
1.2 主要仪器及试剂
ALPHELYS组织芯片制作仪;LeiCaRM2245型切片机;兔抗人SLC1A5抗体(BIOSS,bs-0473R);HRP-Peroxide-DAB试剂盒(DACO)。
1.3 方法
1.3.1制作组织芯片首先选择所需结直肠癌病理存档蜡块,根据HE切片形态学观察,确定具有代表性的病变部位并标记。每个标本取2个点,直径1 mm,按照组织芯片制作仪操作流程,制成组织芯片蜡块,每个芯片蜡块含12×8个点。将芯片蜡块切片,厚度4 μm,裱于载玻片上。
1.3.2免疫组化染色应用SABC免疫组织化学法染色,组织切片经二甲苯脱蜡,梯度乙醇水化,3%H2O2中消除内源性过氧化酶活性,pH 6.0的柠檬酸钠溶液中微波抗原修复。滴加适量SLC1A5抗体(浓度1∶200)4 ℃过夜,按DACO试剂盒说明进行染色,DAB显色和苏木精复染,用已知阳性片做阳性对照,以PBS代替一抗做阴性对照。
1.3.3结果判读SLC1A5染色的评分由2个独立和有经验的病理科医生判读。阳性表达为细胞质膜染色,主要表现为胞质及胞膜内非均匀棕黄色颗粒。0分为不着色或弱着色,阳性比率为<10%;1分为弱着色,阳性比率为10%~40%;2分为中等着色,阳性比率为40%~70%;3分为强着色,阳性比率>70%。
1.4 统计学分析
应用SPSS 16.0软件进行分析。采用χ2检验分析SLC1A5在正常黏膜组织和癌组织中的表达差异以及SLC1A5表达水平和各项临床参数的相关性。
2结果
2.1 SLC1A5在正常黏膜和结直肠腺癌中的表达
SLC1A5在正常黏膜和癌组织中表达均位于胞质膜,未见明显胞核着色。大部分癌组织显示SLC1A5强表达,为2~3分,而大部分正常黏膜显示弱表达,为0~2分。>0分为阳性表达。80例结直肠癌组织中,71例阳性表达;35例癌旁正常黏膜组织中,25例阳性表达。统计学分析发现,2组SLC1A5蛋白表达水平有明显差异,SLC1A5在结直肠癌组织中的表达率(88.8%)明显高于癌旁正常黏膜组织(71.4%),见表1。
2.2 SLC1A5表达与结直肠癌临床病理参数的相关性分析
SLC1A5表达与结直肠癌远处转移(P<0.05)呈正相关。然而,肿瘤组织中SLC1A5表达量与患者性别、年龄、T分期、N分期和分化程度无明显相关性(P>0.05),见表1。
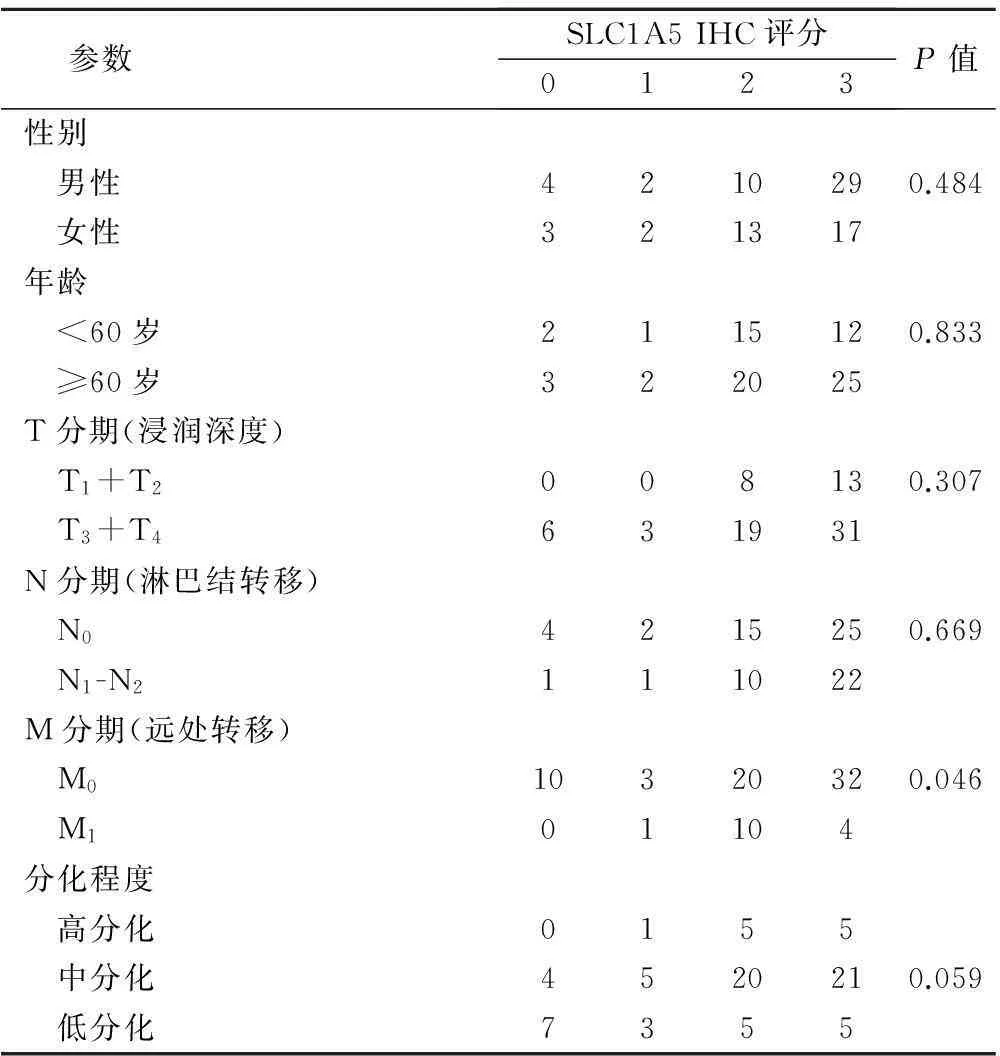
表1 SLC1A5蛋白表达与结直肠癌临床病理参数的关系/例
15例发生远处转移的结直肠癌标本中,SLC1A5均为阳性表达;在65例未发生远处转移的结直肠癌标本中, 55例SLC1A5阳性表达,发生远处转移者其阳性表达率比未发生远处转移者升高,这表明与未发生远处转移患者相比,发生远处转移的癌组织中SLC1A5蛋白表达水平更高。
3 讨论
近些年,氨基酸在肿瘤中的作用逐渐成为热点。谷氨酸胺是人体内含量最丰富的游离氨基酸和重要的代谢前体,在核苷酸、蛋白以及谷胱甘肽合成中发挥重要作用。最新的研究发现谷氨酰胺具有促进肿瘤增殖[6]、侵袭[7-8],刺激肿瘤组织新血管形成[9]等作用。而作为谷氨酰胺的最主要转运载体,SLC1A5在肿瘤中的作用自然也备受关注。Yuneva等[10]研究发现,通过阻断SLC1A5限制谷氨酰胺摄入可引起依赖MYC的细胞凋亡。Fuchs等[1]研究发现,在正常肝组织谷氨酰胺的主要载体是系统N;然而在肝癌组织中,谷氨酰胺主要转运载体却转变成SLC1A5,而且转运效率是系统N在正常组织的3倍。Kim等[2]通过对702例乳腺癌标本进行组织芯片和免疫组化对比分析,发现SLC1A5在乳腺癌中呈异常高表达。Wasa等[3]在神经细胞瘤细胞株的研究也发现SLC1A5呈高表达,并证实Na+依赖型谷氨酰胺摄入占该系细胞总谷氨酰胺摄入量的95%以上。另外,近些年发现SLC1A5高表达的肿瘤还有前列腺癌、肺癌等。Fuchs等[4]利用给予EST信息的数据库对肿瘤差异表达基因进行了筛选,共选取了15种常见组织类型的肿瘤组织及其对应的正常组织的EST文库,通过软件对比,发现SLC1A5在很多常见肿瘤表达中都有明显上调。
我们通过免疫组化的方法检测80例癌组织和35例癌旁正常的黏膜组织中SLC1A5的表达,其阳性率为分别为88.75%及42.86%,结果表明SLC1A5在结直肠癌患者的癌组织中表达较癌旁正常组织中升高。进一步分析SLC1A5的表达情况和各个临床参数的关系显示:在远处转移的结直肠癌组织中,检测到SLC1A5高表达的频率较没有远处转移患者的肿瘤组织标本中表达量高(P<0.05)。这表明SLC1A5可能在肿瘤的转移过程中扮演了非常重要的角色,这一现象和之前报道的在前列腺癌、乳腺癌中的研究一致。通过检测术后结直肠癌组织中SLC1A5的表达情况,可能对肿瘤的恶性程度做出判断和预测。
目前结直肠癌诊疗面临的最大的挑战之一是早期诊断结直肠癌的远处转移以及在此基础上进行的是否需行辅助治疗的判断[11]。对于早期的结直肠癌患者,仅仅需要外科手术治疗[12];而对于进展期的患者,除了手术治疗外还需要化疗或者放疗等辅助性治疗提高患者生存期[13]。我们的研究发现SLC1A5在转移的结直肠癌中表达是明显升高,这一现象预示SLC1A5的表达升高和结直肠癌转移密切相关。对于临床未发现远处转移,而肿瘤组织中SLC1A5高表达的结直肠癌患者我们需要更为密切的关注以及更多的辅助检查是否存在远处转移。
综上所述,高表达的SLC1A5和结直肠癌的远处转移相关,肿瘤组织中高表达SLC1A5的结直肠癌患者可能需要更多的辅助性治疗和更为密切的随访。但是,本研究中发生远处转移标本例数偏少,可能会带来统计学上的误差,SLC1A5能否作为临床上治疗选择标记为及其促进结直肠癌转移的机制仍需要进一步的实验研究证实。
参考文献
[1]Fuchs B C,Perez J C,Suetterlin J E,et al.Inducible antisense RNA targeting amino acid transporter ATB0/ASCT2 elicits apoptosis in human hepatoma cells〔J〕.Am J Physiol Gastrointest Liver Physiol,2004,286(3):G467-G478.
[2]Kim S,Jung WH,Koo JS.Expression of glutamine metabolism-related proteins according to molecular subtype of breast cancer〔J〕.Endocr-related cancer,2013,20(3):339-348.
[3]Wasa M,Wang HS,Okada A.Characterization of L-glutamine transport by a human neuroblastoma cell line〔J〕.Am J Physiol Cell Physiol,2002,282(6):C1246-C1253.
[4]Fuchs BC,Bode BP.Amino acid transporters ASCT2 and LAT1 in cancer:parters in crime?〔J〕.Semin Cancer Biol,2005,15(4):254-266.
[5]Reynolds MR,Lane AN,Robertson B,et al.Control of glutamine metabolism by the tumor suppressor Rb〔J〕.Oncogene,2013,33(5):556-566.
[6]Le A,Lane AN,Hamaker M,et al.Glucose-independent glutamine metabolism via TCA cycling for proliferation and survival in B cells〔J〕.Cell metab,2012,15(1):110-121.
[7]Metallo CM,Gameiro PA,Bell EL,et al.Reductive glutamine metabolism by IDH1 mediates lipogenesis under hypoxia〔J〕.Nature,2011,481(7381):380-384.
[8]刘刚,陆应麟.脂肪酸合成酶与肿瘤的治疗〔J〕.中华肿瘤防治杂志,2006,13(21):1666-1669.
[9]Vegran F,Boidot R,Michiels C,et al.Lactate influx through the endothelial cell monocarboxylate transporter MCT1 supports an NF-kappaB/IL-8 pathway that drives tumor angiogenesis〔J〕.Cancer Res,2011,71(7):2550-2560.
[10]Yuneva M,Zamboni N,Oefner P,et al.Deficiency in glutamine but not glucose induces MYC-dependent apoptosis in human cells〔J〕.J Cell Biol,2007,178(1):93-105.
[11]Chu D,Li Y,Wang W,et al.High level of Notch1 protein is associated with poor overall survival in colorectal cancer〔J〕.Ann Surg Oncol,2010,17(5):1337-1342.
[12]Booth RA.Minimally invasive biomarkers for detection and staging of colorectal cancer〔J〕.Cancer Lett,2007,249(1):87-96.
[13]Daniels IR,Fisher SE,Heald RJ,et al.Accurate steging,selective preoperative therapy and optimal surgery improves outcome in rectal cancer:a review of the recent evidence〔J〕.Colorectal Dis,2007,9(4):290-301.
Expression of SLC1A5 in Colorectal Cancer Tissues and its Correlation with Distant
Metastasis in Colorectal Cancer Patients
LIUTing.BeijingPingguHospital,Beijing,101200
【Abstract】ObjectiveTo investigate the expression of SLC1A5 in primary colorectal cancer and adjacent normal mucosa,and to analyze the relationship between SLC1A5 expression and clinicopathological parameters.MethodsThe expression of SLC1A5 in carcinoma tissues and normal mucosa was examined by a set of tissue microarrays and the method of immunohistochemistry.The potential relationship between SLC1A5 expression and clinicopathological features was also analyzed.ResultsThe positive expression rate of SLC1A5 in colorectal cancer tissues was 88.75%,which was significantly higher than in normal tissue(P<0.05).The expression rate in the patients with metastasis was also significantly higher than that in those with locally advanced disease(P<0.05).However,no correlation between SLC1A5 expression and age at surgery,sex,the depth of invision,lymph node metastasis,or differentiation grade was found(P>0.05).ConclusionSLC1A5 maybe a promotive factor in the process of distant metastasis.
【Key words】SLC1A5;Colorectal neoplasms;Neoplasm metastasis
中图分类号:R73-36
文献标识码:A
文章编号:1001-5930(2016)01-0047-03
DOI:10.3969/j.issn.1001-5930.2016.01.014
